用功能生态学方法揭示峨眉髭蟾蝌蚪和棘腹蛙蟾蝌蚪共存的原因
许 丹,吴小清,赵春霖,朱文博,赵 天,苏胜齐
1 西南大学动物科技学院,重庆 400715 2 中国科学院山地生态恢复与资源利用重点实验室&生态恢复与生物多样性保育四川省重点实验室,中国科学院成都生物研究所,成都 610041 3 中国科学院大学,北京 100049 4 成都师范学院化学与生命科学学院,成都 611130 5 西华师范大学生命科学学院,南充 637000
物种竞争理论指出,共生物种的资源分配影响群落结构。因此,探讨物种与物种之间资源分配的程度(即物种间的生态位关系)是研究群落结构和物种共存的重要组成部分[1]。Hutchinson认为物种基本的生态位应当是一个多维超体积,而每一个维度都反映了物种对环境和资源的需求[2]。因此,这些维度代表了物种所在环境中的生物和非生物变量。每一个物种在空间、时间和/或资源利用尺度上都占据着自己独立的生态位,而这种生态位的分化被认为是物种在群落中共存的主要机制[3- 5]。尽管Hutchinson提出的生态位概念被广泛用于探讨物种在时空尺度的重叠以及资源的竞争,但却无法了解物种对生态过程的影响[6]。近二十年来,随着功能生态学研究的兴起,生态位的发展也被延伸至这一领域并提出功能生态位(functional niche)的概念[6]。这种基于物种功能性状(即那些能够影响生物体机能进而影响生态系统功能的性状[7])的生态学研究方法被认为能够用来解析物种在生态系统中的重要功能性作用[8-9]。
同Hutchinson的生态位概念类似,功能生态位也是一个多维超体积,只是构成其的轴是多个功能性状。动物功能生态学研究中主要采用物种的生态形态学性状作为其功能性状(如鸟类[10]、鱼类[11]、蝌蚪[12]等等)。一方面因为这些性状能够在大量个体中较为容易的获取[13],另一方面更重要是因为这些性状与反映物种营养生态位的稳定同位素(δ13C和δ15N)存在显著的相关关系[11],能够在某种程度上反映物种对资源的真实利用。因此,功能生态位是研究物种共存的潜在、有效和较准确的方法,已经被广泛应用于现有的研究。例如,Aneesh Kumar等采用这种方法揭示了资源利用的分化是阿拉伯海东南部深海鱼类群落物种共存的原因[14]。又如,Woodward和Hildrew阐明了资源利用的分化和种内的捕食是英国布罗德斯通溪流中底栖无脊椎动物物种内不同发育阶段个体共存的原因[15]。但已有的研究大都关注植物、浮游生物、无脊椎动物、鱼类和鸟类等,极少有研究采用功能生态位解析两栖动物,特别是其幼体蝌蚪共存的原因。
蝌蚪在水生生态系统中具有重要的角色和功能,特别在缺乏更高营养级生物(如捕食性鱼类等)的水生生态系统中表现得尤为明显[16]。例如滤食性的蝌蚪(filtering tadpoles)可以改变藻类的丰度和物种组成,进而影响叶绿素a和初级生产力[17],改善水体的浊度和富营养化程度等[18-19]。而刮食性的蝌蚪(grazing tadpoles)可以通过在水体底部活动和摄食附生藻类来影响其他初级消费者[20],进而改变淡水生态系统的结构和功能等。因此,揭示蝌蚪物种间共存的机制不仅能够帮助我们了解物种、环境和生态系统之间的关系,还能为两栖动物多样性和生态系统的保护提供基础数据和支撑。
在本研究中,我们以两种在森林溪流生境中共存的无尾两栖类蝌蚪(即峨眉髭蟾Leptobrachiumboringii蝌蚪和棘腹蛙Quasipaaboulengeri蝌蚪)为研究对象,通过计算两个物种在功能生态位中的分离程度(即功能丰富度functional richness和功能定位functional identity),以及二者之间功能生态位的重叠程度(functional overlap)来揭示它们共存的主要原因。
1 材料与方法
1.1 模式动物和标本
峨眉髭蟾(Leptobrachiumboringii)属于无尾目角蟾科髭蟾属,主要分布在四川峨眉和洪雅;棘腹蛙(Quasipaaboulengeri)属于无尾目叉舌蛙科棘胸蛙属,广泛分布在四川、重庆、湖南、湖北等多个省份[21]。这两个物种的IUCN等级均为濒危(EN)[22],在《中国生物多样性红色名录2015版》和《中国两栖动物受威胁现状评估》中均被列为易危种(VU)[23],急需开展相关保护工作。前期在四川峨眉山的野外调查发现,这两个物种的蝌蚪主要大量共存于清音阁附近的黑龙江(103.3970°E,29.5781°N;海拔680m)中。为了不破坏野生资源,我们选择采用中国科学院成都生物研究所两栖爬行动物标本馆保存的峨眉山黑龙江共计51号峨眉髭蟾蝌蚪和69号棘腹蛙蝌蚪福尔马林浸制标本进行研究。这两批标本均在1963年3月用手抄网随机采集,能较为准确的代表在黑龙江共存的棘腹蛙蝌蚪种群和峨眉髭蟾蝌蚪种群。福尔马林浸制标本被广泛用于形态学[24]、系统学[25]、保护生物学[26]和生态学[12]研究,在全球生物多样性极速下降的背景下扮演着越来越重要的角色和作用。
1.2 数据获取
在实验室中结合游标卡尺和带有图像分析系统(Mc50-N)的体式解剖镜(JSZ8T,江南永新,中国)测量每一号蝌蚪标本的10个外部形态学性状并精确到0.01mm。这些形态学性状包括全长、体长、体高、体宽、尾长、尾肌宽、尾高、口宽、眼间距、吻到出水孔距离(图1)。同时采用电子天平测量每一号蝌蚪标本的体重并精确到0.01g。测量工作由同一人完成以保证性状测量的一致性。
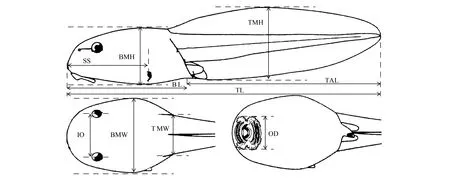
图1 蝌蚪10个外部形态学性状测量图[27]Fig.1 The measurement of 10 external morphological traits of tadpoles[27]TL,全长 Total length;BL,体长 Body length;BMH,体高 Body maximum height;BMW,体宽Mody maximum width;TAL,尾长 Tail length;TMW,尾肌宽 Tail muscle width;TMH,尾高 Tail muscle height;OD,口宽 Oral disk width;IO,眼间距 Interocular distance;SS,吻到出水孔距离 Distance from tip of snout to opening of spiracle
对动物体来说,功能性状通常是通过生态形态学性状的测量和计算来获取的。这些性状尽管不是动物在生态系统中真实的功能表现,但仍然被广泛认为能用来评估动物在生态系统中的重要功能(如鱼类的运动和捕食[28];鸟类的觅食和运动[10]等等)。事实上,蝌蚪在淡水生态系统的重要功能跟鱼类相似,主要通过运动和捕食来表现[29]。因此,基于功能性状需要相对容易地在大批量样本中获取的准则[13],并结合已有研究(表1),我们用前期测量的形态学性状计算得出10个蝌蚪的功能性状,这些功能性状均为无单位的比值,因而排除了个体大小对形态学变动的干扰[28,30]。具体来说,其中的3个功能性状与蝌蚪的摄食相关,包括了口器形状、口器位置和眼睛位置;另有6个功能性状与蝌蚪的运动相关,包括了尾部形状、尾部位置、尾部控制方式、身体形状、躯干弯曲形状和出水孔位置;而体重的对数值同时与摄食和运动相关(表1)。每一个功能性状都具有其特有的生态学意义。例如,口器形状值越低,表明个体能捕获的食物越小,而该值越高则表明个体的口器大而圆,能捕获的食物也相应较大[31]。又如,躯干弯曲形状揭示了蝌蚪的游泳方式和运动耐力,其值越低表明个体主要采用背腹弯曲的游泳方式,越高则表明个体主要采用大幅度脊柱弯曲的游泳方式[32]。
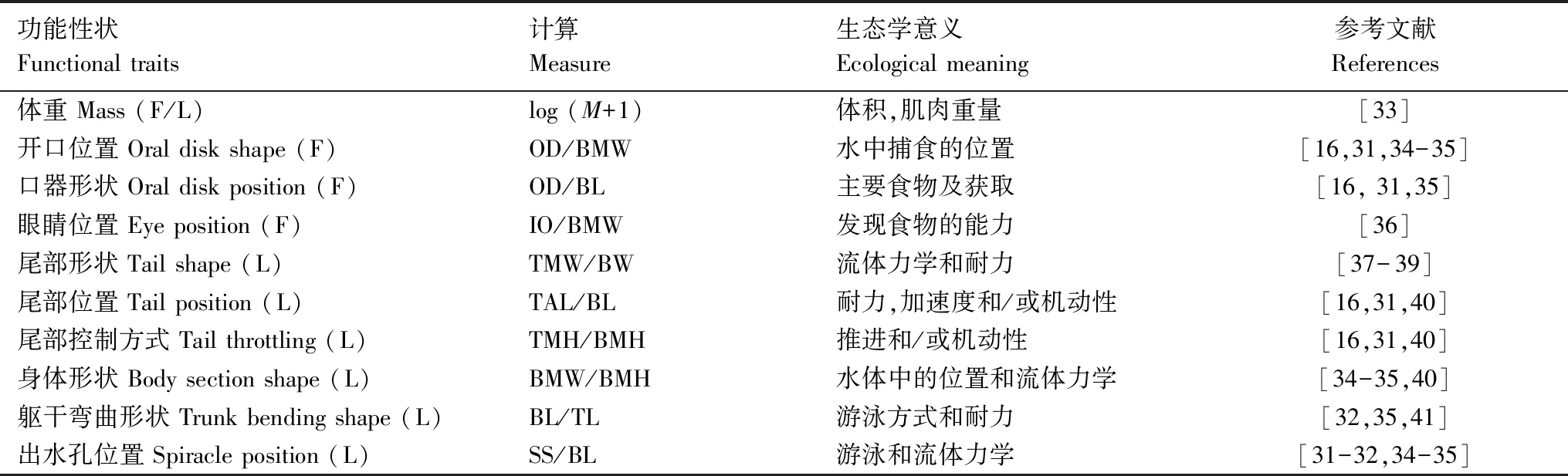
表1 与蝌蚪捕食和运动功能相关的10个功能性状
括号内的字母表示性状的主要功能(F:捕食;L:运动);TL,全长 Total length;BL,体长 Body length;BMH,体高 Body maximum height;BMW,体宽Mody maximum width;TAL,尾长 Tail length;TMW,尾肌宽 Tail muscle width;TMH,尾高 Tail muscle height;OD,口宽 Oral disk width;IO,眼间距 Interocular distance;SS,吻到出水孔距离 Distance from tip of snout to opening of spiracle
1.3 数据统计分析
为了赋予每个功能性状有相同的权重,在进行统计分析之前先将上述提及的10个功能性状进行离差标准化(均值为0,方差为1)[42]。然后基于已标准化的每个个体的功能性状,采用主成分分析方法(PCA)构建多维功能生态位,并选择特征值大于1的主成分作为主轴。采用公式(1)分别计算两个物种的功能定位(FIde,即功能性状的丰度加权平均值)[43]。
(1)
式中,Pi表示物种i在群落中的相对丰度。n表示物种数,ti表示物种i的功能性状值。然后采用非参数的多元方差分析(permutational multivariate analysis, PERMANOVA)检验两个物种的功能定位是否存在显著性差异。接下来采用快速凸包算法(quickhull algorithm)计算了两个物种的功能丰富度的实际值(功能生态位大小,即两个物种所有个体在功能生态位中分别形成的凸多边形的体积)和二者之间功能生态位重叠程度的实际值[44]。功能生态位重叠程度(FOve)的计算基于Villéger提供的方法[45],采用公式(2)计算两个蝌蚪种群共享的功能丰富度的百分比:
FOve=FRic(leb∩qub)/(FRic(leb)+FRic(qub)-FRic(leb∩qub)
(2)
式中,FRic(leb)是峨眉髭蟾蝌蚪种群所占据的凸多边形体积,FRic(qub)是棘腹蛙蝌蚪种群所占据的凸多边形体积,而FRic(leb ∩ qub)是二者占据的凸多边形体积的交集。功能生态位重叠程度越接近0表明两个物种的功能相似性越低,越接近1则表明二者的功能相似性越高。
由于功能丰富度和功能生态位重叠程度通常会受到个体数的影响,因此采用自助法(bootstrap)从初始样本中重复10000次随机替换抽样,每次从峨眉髭蟾蝌蚪和棘腹蛙蝌蚪中分别抽样15个个体(功能生态学研究中通常在每个物种中测量15个个体来反映该物种的平均功能性状值[28,46])和51个个体(峨眉髭蟾蝌蚪总数)并重新分别计算二者的功能丰富度和功能生态位重叠程度的随机抽样值,以及产生的平均值和95%置信区间,并比较两个物种功能丰富度的显著性差异。所有的计算和统计分析均在R软件中进行。
2 结果
共测量峨眉髭蟾蝌蚪51只,处于Gosner 25—43期之间,其全长的平均值为(60.27±24.11) mm (SD)。而棘腹蛙蝌蚪标本共有69只,处于Gosner 24—37期之间,其全长的平均值为(38.03±13.77) mm (SD)。PCA分析中前4个主成分的特征值大于1,解释了80.04%的总变异量(表2),被选为构成多维功能生态位的4个主轴。其中,PC1主要与解析蝌蚪运动的功能性状相关。随着PC1值的增加,蝌蚪个体表现为更重,多采取背腹弯曲运动的方式,因而游泳时的推进能力和灵活性较强,但耐力较差。PC2主要与解析蝌蚪摄食的功能性状相关。因此,PC2值越大,表明蝌蚪个体更轻,其口器大而圆,可选择捕食食物的范围较大。
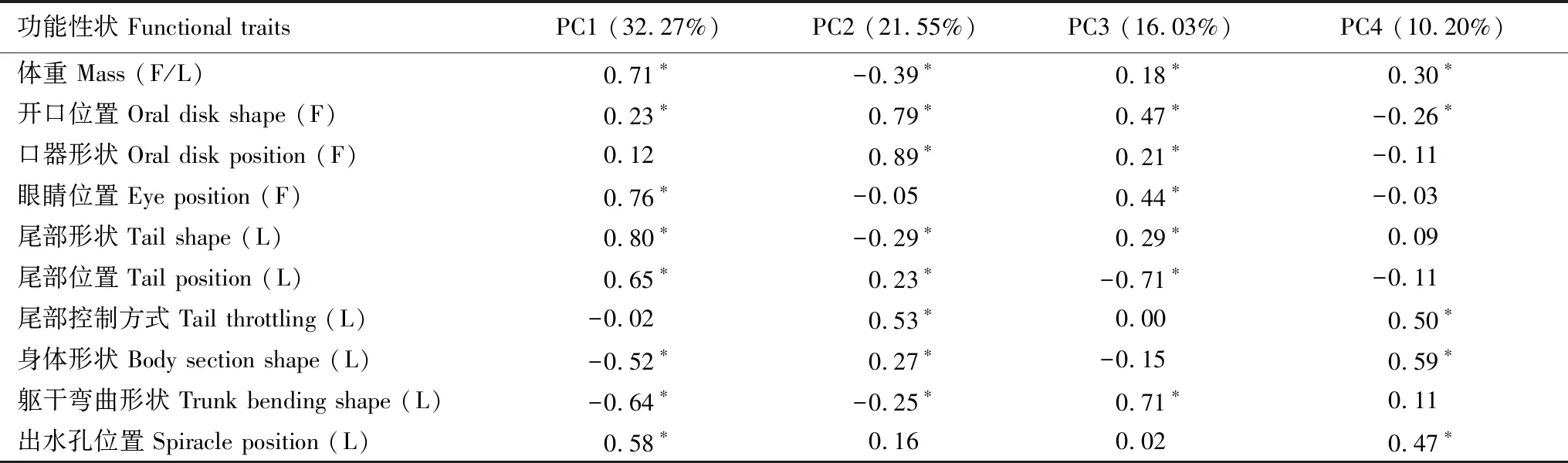
表2 前4个主成分与10个功能性状的Pearson相关系数分析
*数值表明二者存在显著的相关关系(P< 0.001)
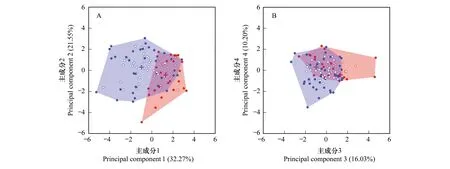
图2 峨眉髭蟾蝌蚪和棘腹蛙蝌蚪在功能生态位中的分布情况(红色圆点:峨眉髭蟾蝌蚪个体;蓝色圆点:棘腹蛙蝌蚪个体)Fig.2 The distribution of Leptobrachium boringii and Quasipaa boulengeri tadpoles in the four dimensional functional niche (red and blue circles represent Leptobrachium boringii and Quasipaa boulengeri tadpoles, respectively) (A)构成四维功能生态位的PC1和PC2轴;(B)构成四维功能生态位的PC3和PC4轴;彩色多边形代表峨眉髭蟾蝌蚪(红)和棘腹蛙蝌蚪(蓝)的功能丰富度(多边形面积);实心圆点代表两个物种分别在四维功能生态中形成的多边形的顶点
两个蝌蚪种群在四维功能生态位中的功能定位存在显著性差异(PERMANOVA,P< 0.001,图2)。峨眉髭蟾蝌蚪主要分布于PC1的正值和PC2的负值区域,而棘腹蛙蝌蚪主要分布于PC1的负值和PC2的正值区域。峨眉髭蟾蝌蚪种群功能丰富度的实测值为12.59%(n=51),而棘腹蛙蝌蚪种群功能丰富度的实测值为46.67%(n=69)(表3)。采用自助法计算所得的结果表明,当从两个蝌蚪种群中分别随机抽样15个个体时,峨眉髭蟾蝌蚪种群功能丰富度的平均值为2.08%±1.24%(SD),而棘腹蛙蝌蚪种群功能丰富度的平均值为7.40%±2.93%(表3)。比较二者的95%置信区间,棘腹蛙蝌蚪种群功能丰富度的平均值显著高于峨眉髭蟾蝌蚪种群功能丰富度的平均值。当从两个蝌蚪种群中分别随机抽样51个个体时,棘腹蛙蝌蚪种群功能丰富度的平均值为36.32%±3.90%(表3)。二者的95%置信区间表明棘腹蛙蝌蚪种群功能丰富度的平均值仍旧显著高于峨眉髭蟾蝌蚪种群功能丰富度的平均值。两个蝌蚪种群功能生态位重叠程度的实测值为1.47%。当采用自助法从两个种群中分别随机抽样15个个体时,二者功能生态位重叠程度的平均值为0.06%±0.19%。当从两个种群中分别随机抽样51个个体时,二者功能生态位重叠程度的平均值为0.99%±0.55%。
表3 峨眉髭蟾蝌蚪种群和棘腹蛙蝌蚪种群的个体数,功能丰富度的实测值、自助法随机抽样值(个体数为15和个体数为51)的95%置信区间
Table 3 Number of individuals inLeptobrachiumboringiiandQuasipaaboulengeritadpole populations, observed and bootstrap functional richness values when considering 15 or 51 individuals(95% confidence interval)

种群 Population功能丰富度 Functional richness个体数 Individuals实测值 Observed valueBootstrappedn=15Bootstrappedn=51峨眉髭蟾蝌蚪 L. boringii tadpoles5112.59%0.57%—2.72%-棘腹蛙蝌蚪 Q. boulengeri tadpoles6946.67%5.35%—14.09%28.00%—43.12%
3 讨论
本研究通过功能生态学的研究方法,采用3个指标(即功能丰富度、功能定位和功能生态位重叠程度)来揭示峨眉髭蟾蝌蚪和棘腹蛙蝌蚪共存的机制。结果表明,峨眉髭蟾蝌蚪的功能丰富度显著低于棘腹蛙蝌蚪的功能丰富度,二者的功能定位存在显著差异,且二者功能生态位的重叠程度极低。以上所有结果表明这两种蝌蚪的功能生态位存在显著分化。本课题组之前的研究表明功能性状和稳定同位素(δ13C和δ15N)之间存在显著的相关关系[11],而稳定同位素被广泛用于研究消费者和食物资源之间的关系[47]。另一方面,食物资源的分化被认为主要与物种捕食食物的大小和运动能力相关[48]。因而本研究中峨眉髭蟾蝌蚪和棘腹蛙蝌蚪功能生态位的显著分化在某种程度上反映了二者利用的主要食物资源存在明显分化,是促使二者共存的主要机制。类似的研究结果在两种大量共存的海洋鱼类(Psenopsiscyanea和Bembropscaudimacula)中也被发现,支持了功能生态位重叠程度和群落中共存物种的丰度存在负相关关系的观点[49]。即共存物种的丰度越高时,功能生态位的重叠程度越低,功能生态位的分化程度越高。
本研究的结果还表明,棘腹蛙蝌蚪和峨眉髭蟾蝌蚪功能生态位的分化主要是二者摄食和运动能力的分化。具体来说,棘腹蛙蝌蚪主要分布于PC1的负值和PC2的正值区域。在该区域分布的蝌蚪表现为开口较大,眼睛间距较小,水面取食,因此更多的利用浮游生物和较大的水生昆虫。同时,这些蝌蚪的身体较为扁平,尾部较为短小,多采用脊椎弯曲的游泳模式,游动速度快但耐力较差,对生态系统自上而下的影响相对较小。而峨眉髭蟾蝌蚪主要分布于PC1的正值和PC2的负值区域,表现为个体较大,开口较小,眼睛位置偏向于头部两侧,水中或水底取食,多利用水中的固着生物和底栖腐殖质。同时,它们的尾部发达,多采用背腹弯曲的游泳模式,游动速度慢但耐力较强,对生态系统自上而下的影响较为明显。这种共存物种之间功能性状的分化还被认为能在某种程度上反映其主要栖息地微生境的分化[50]。因而我们推测棘腹蛙蝌蚪主要栖息于溪流中水流较缓、浮游生物和水生昆虫较为丰富、初级生产力较高的区域;而峨眉髭蟾蝌蚪主要栖息于溪流中有一定流速、固着藻类和腐殖质较为丰富的区域。下一步的研究将围绕这两种蝌蚪对微生境的选择和食性分析来验证这一推测。
实际上,功能生态位只是物种的基础生态位,反映了物种在生态系统中具有的潜在的生物学功能[51]。因而其能否真实准确的反映共存物种对资源利用的相似程度还存在一定的争议。例如,Pool等[52]利用北美洲的鱼类为模式动物揭示了群落中功能相似性和营养相似性之间的相关性很弱,占据较大功能生态位的鱼类也可能对单一食物具有较强的偏好。因此,单纯采用功能生态学的方法来阐明物种共存的原因存在一定的局限性。将来的研究可结合功能生态位和基于稳定同位素分析的营养生态位(即物种的真实生态位)来揭示物种间稳定共存的机制,以及具体哪些资源是降低共存物种间竞争的主要贡献者[53]。

