上皮-间充质转变的概念变迁及与肿瘤转移研究进展
张益玮,彭秀达,肖帅
(南华大学附属第一医院 肝胆胰外科/胃肠外科/临床研究所,湖南 衡阳 421001)
恶性肿瘤已成为我国居民的首要死因[1],而肿瘤转移一直是肿瘤患者的主要死因,因此,深入探索调控转移的机制是研发有效治疗肿瘤策略的前提[2]。上皮-间充质转变(epithelialmesenchymal transition,EMT),即上皮细胞向间充质细胞表型转变的生物学过程,是近10余年来肿瘤转移的研究热点。研究[3-4]发现并证实EMT在促进肿瘤转移的启动到完成各步骤中均起到关键作用,并与不良预后密切相关,是肿瘤转移的标志性事件。鉴于此,深入研究EMT在肿瘤转移中的作用及其调控机制,开发靶向EMT各关键调控环节的新型干预策略,有望成为控制肿瘤转移的重要研究方向。
然而,尽管目前对EMT的研究已较多和深入,但无论是国外还是国内的研究报道中,EMT的命名、定义仍存有不少混淆[5-7],亟需统一规范,以利于后来研究者明确概念、规范使用命名以及深入理解EMT的意义。同时,随着EMT研究的不断拓展,EMT在肿瘤转移各步骤中的确切角色[8-9]、具体调控机制和靶向干预EMT策略的研究也越来越多[10-13],各种理论和研究方法不断快速更新,亟需进行归纳总结以利于理解和深入学习。因此,本文主要围绕EMT的概念变迁及与肿瘤转移研究的最新相关进展进行简要介绍。
1 EMT的概念、命名及译名变迁
早在1890年,Ramón Y Cajal就在乳腺癌的研究中发现一些导管上皮细胞可以发生类似间充质细胞形态改变而侵犯基质,此后在其他一些肿瘤的研究也发现了该现象。但直到1968年Elizabeth Hay在鸡胚胎原条发育形成的研究中才正式提出EMT的概念,且最初的名称为epithelial to mesenchymal transformation,即上皮细胞间充质转化[5,14]。1982年,Greenburg等[15]首次在正式发表的论文中使用EMT这一术语。1991年Elizabeth Hay进一步发现当胚胎细胞迁移到达目的地后又可重新转变为上皮细胞表型,即发生MET[5]。但在这数十年的时间里,EMT一直没有统一的命名,分别被称为epithelial-mesenchymal transformation,epithelial-mesenchymal interactions及epithelialmesenchymal transition等。直到2003年,Kalluri等[16]在论文中提及既往EMT名称的混乱,焦点是使用transformation还是transition,基于EMT是指上皮细胞和间充质细胞之间表型的转换,且这种转换是可逆的,而transformation意指转化,往往不可逆,建议统一采用epithelial-mesenchymal transition这一术语,这一观点得到了学术界的共同认可。
而在国内,王伟铭等[17]1998年首先将EMT的概念引入到肾间质纤维化的研究中。2004年,金鸿雁等[18]首次在肿瘤转移的研究中使用EMT的概念,此后EMT的研究在国内呈暴发式增长。然而,与国外早期研究类似,国内EMT译名亦不统一、规范,导致不能很好地表达其本意。笔者结合中国知网、万方数据库及维普数据库中的论文粗略统计,发现主要有以下几种译名:上皮-间质转化/转变、上皮-间叶转化/转变、上皮-间充质转化/转变,而尤以上皮间质转化多用[7,19-22]。然而,结合前文所列EMT的研究历史,已明确建议使用transition而非transformation一词,且mesenchymal尽管翻译为间充质、间叶和间质均可,但其准确定义为间充质/间叶细胞,是由胚胎细胞时期的间充质发生而来,主要特征是分化低、有很强的分裂和分化能力,能分化成为多种结缔组织细胞、内皮细胞和平滑肌细胞等,而间质细胞主要包括成纤维细胞、巨噬细胞和载脂细胞等,是间充质细胞分化而成的一部分[23]。因此建议中文译名统一使用上皮-间充质转变可能更为准确。
2 EMT与肿瘤转移的关联
2007年波兰及2008年冷泉港的EMT会议建议将其分为3型:I型为胚胎发育相关EMT,II型为器官纤维化及组织再生相关EMT,III型为肿瘤进展和转移相关EMT[10,14]。上皮细胞发生EMT使其尖-底极性逐渐丧失而获得前-后极性,细胞间连接(紧密连接、黏附连接、桥粒/半桥粒等)解体,肌动蛋白骨架改变导致细胞由鹅卵石样形态逐渐成为纺锤体样形态,细胞表面的上皮标志物(E-cadherin、cytokeratin、ZO1等)表达逐渐降低而间充质标志物(N-cadherin、vimentin、fibronectin等)表达升高,基底膜降解及细胞外基质重构,最终使细胞获得运动、迁移和侵袭能力[10]。此后研究[10,24]相继发现,肿瘤细胞发生EMT后还可获得肿瘤干细胞特征、化疗抵抗、免疫逃避、代谢改变、阻止衰老等功能。在乳腺癌、结直肠癌、肺癌等上皮源性肿瘤的病理组织研究中发现在肿瘤侵袭前沿存在发生EMT样改变的肿瘤细胞,而最新的生物发光谱系示踪(lineage tracing)方法也在体内证实肿瘤细胞转移中发生EMT表型的转变,并与肿瘤的进展和复发密切关联[9-10,25]。这些研究结果充分证实EMT与肿瘤转移密切相关。
2011年Valastyan等[26]结合以前研究结果提出肿瘤侵袭转移级联(invasion-metastasis cascade)理论,认为肿瘤完成临床转移可分为局部侵袭、进入循环、循环中存活、远处脏器捕获、渗出循环、靶器官存活并形成微转移及转移定殖形成七大步骤。EMT具有可促进肿瘤细胞运动、侵袭、存活能力增强、形态转变等特性,较好地契合侵袭转移级联理论,成为肿瘤转移的标志事件之一[4]。因此,近年来大量研究集中于可驱动肿瘤细胞发生EMT的因素。并发现一些特异性的基因、非编码RNA、表观遗传修饰、外泌体、自噬等均可参与多种肿瘤的EMT调控,并在侵袭转移级联的不同步骤中发挥相应的作用,协同完成肿瘤转移过程[9,27-32]。因此,EMT是肿瘤转移的重要驱动因素之一。
3 EMT的调控机制
近年来,EMT与肿瘤转移的调控机制研究不断深入和拓展。调控EMT的生物学机制尽管多种多样,但根据其对EMT转录因子(EMT transcriptional factor,EMT-TF)及重要蛋白的调控层面可以主要归纳为5大类:转录调控、表观调控、转录后调控、翻译调控及翻译后调控,分别从不同层面调控EMT转录因子和关键基因的表达,进而诱导或抑制EMT(图1)[10-11,33-35]。
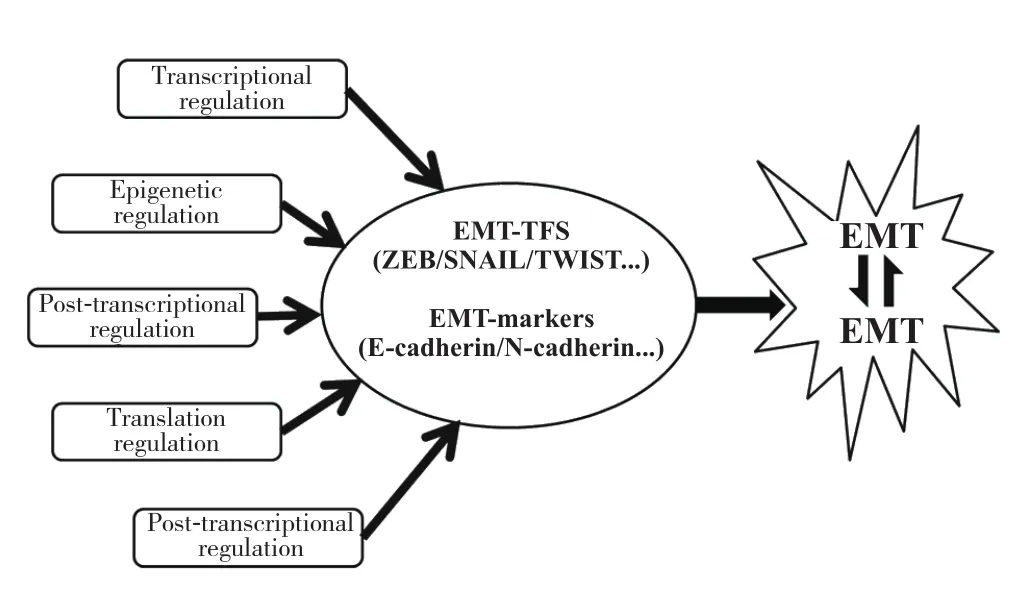
图1 EMT的调控层面Figure 1 The regulatory levels of EMT
3.1 EMT的转录调控层面
EMT-TFs是EMT关键的转录调控因素,其主要包括锌指结合转录因子SNAIL、E盒结合锌指蛋白(ZEB)和碱性螺旋-环-螺旋转录因子(TWIST)3大家族成员,以及一些其他成员如Fox转录因子、Sox转录因子、Prrx1等[11,24,36]。其中,Snail家族成员(SNAI1、SNAI2、SNAI3)主要与CDH1的启动子区域E盒结合募集多梳抑制复合物而抑制其转录,并可以抑制紧密连接和尖-底极性的基因表达,还能直接转录激活诱导间充质表型的基因,最终降低E-cadherin的表达,增强细胞的迁移、运动、侵袭和转移能力,导致不良预后[24,36]。ZEB家族成员(ZEB1、ZEB2)结构包含两个广泛分离以及两个保守的锌指结构域簇,其中心位置含有一个同源结构域,可以与YAP1、PCAF等发生蛋白-蛋白交联作用。与Snail家族类似,ZEB也主要是直接与E盒元件结合来抑制E-cadherin的表达,进而促进肿瘤细胞迁移和侵袭能力[24]。TWIST家族(TWIST1、TWIST2)成员除与E盒应答元件形成二聚体来发挥转录调控作用外,还可以募集组蛋白去乙酰酶或抑制乙酰转移酶,发挥转录抑制因子的作用,也可直接或间接与其他转录因子协作而起转录激活剂作用,其诱导EMT主要通过激活SNAI2来间接抑制E-cadherin的转录而实现[36]。其他一些转录因子也可通过转录调控各种上皮表型或间充质表型的关键基因表达,进而诱导EMT的发生[24]。
3.2 EMT的表观调控层面
表观遗传是指基于非DNA序列改变所致基因表达水平的变化,可对目的基因提供长期、稳定和可逆的改变,其在EMT表型可塑性中发挥重要作用。其调控EMT主要方式有三种:DNA甲基化、组蛋白修饰和RNA干扰。DNA甲基化:CDH1启动子超甲基化后可与EMT-TFs相互作用募集DNA甲基转移酶(DNMT)到其CpG岛,DNMT与EMT-TFs相互调节形成反馈环路,进而影响E-cadherin和EMT-TFs的表达、细胞的可塑性和分化等功能,最终调控肿瘤细胞的EMT[37]。组蛋白修饰:当组蛋白氨基端发生修饰时,可改变组蛋白-DNA的相互作用直接调控、或募集染色质重构复合物/RNA聚合酶复合物间接调控目的基因的表达。如发生EMT时,上皮表型基因活化时以H3Kac、H3K4me3为标志,当进入中间状态时以H3K27me3和H3K4me3为标志,而上皮表型完全抑制时以H3K27me3、H3K9me3为标志[38]。而LSD1、NuRD复合物、SWI/SNF复合物、PRC复合物等均可通过组蛋白修饰直接或间接调控EMT-TF的表达[37]。RNA干扰:目前已发现最常见的RNA干扰主要为microRNA(miRNA)和long noncoding RNA(lncRNA)。miRNA是一种长度约为21~23个核苷酸的小RNA,通过与目的基因mRNA的3'UTR或者CDS序列直接配对,抑制其翻译或促进降解,从而抑制目的基因的表达。已有研究[39]发现miR-200、miR-34、let-7d等可在肿瘤中直接或间接调控EMT-TF来诱导肿瘤细胞发生EMT而促进转移。lncRNA是一种长度大于 200 个核苷酸的非编码 RNA,其既可以与EMT-TF直接结合影响EMT,又可以作为竞争性内源RNA(ceRNA)与miRNA竞争性结合而干预EMT-TF的转录来调控EMT[40]。
3.3 EMT的转录后调控层面
转录后的hnRNA在加工为成熟mRNA过程中的调控可以影响蛋白产物的形成,其主要调控方式有mRNA前体(pre-mRNA)的选择性剪接和非编码RNA的调控。选择性剪接是pre-mRNA通过不同的剪接方式产生不同的mRNA剪接异构体进而翻译成具有不同功能的蛋白产物[11]。调控EMT选择性剪接相关蛋白主要包括:上皮剪接调控蛋白(ESRP1/2)、 RNA结合基序蛋白47(RBM47)、RNA结合蛋白Fox1同源物2(RBFOX2)等,这些蛋白通过对pre-mRNA的各种剪接修饰来影响EMT关键基因特别是EMT-TFs的表达,进而调控EMT标志物的表达以及运动、迁移和侵袭能力的改变[41-42]。非编码RNA特别是miRNA和LncRNA的转录后调控,是以其与靶基因的转录本形成互补双链而干扰mRNA的剪切,产生不同的剪切形式,进而翻译出不同功能的蛋白;LncRNA还可作为miRNA海绵而影响其转录后调控功能[11, 39]。
3.4 EMT的翻译调控层面
在mRNA被翻译为氨基酸的过程中,翻译起始、mRNA的稳定性和3'PolyA尾的长度等都能影响蛋白质的合成。如Y盒结合蛋白1(Y-boxbinding protein-1,YB-1)可直接激活SNAI1 mRNA的Cap依赖的翻译诱导乳腺癌发生EMT而促进转移[24]。新近研究[43]发现翻译调节LncRNA(translational regulatory lncRNA,treRNA)能增强肺癌细胞SNAI1转录本的表达,而敲除treRNA能抑制SNAI1下游基因的表达,并抑制肿瘤细胞的迁移、运动能力;treRNA还可以调控CDH1的翻译而抑制E-cadherin的表达进而诱导EMT。胚胎致死异常视觉样RNA结合蛋白1(embryonic lethal abnormal vision-like RNA binding protein 1,ELAVL1)则能稳定SNAI1 mRNA的水平[11]。除直接调控翻译,基因亚细胞定位的改变也可以影响蛋白的翻译[44],如胞质聚腺苷化元件结合蛋白1(cytoplasmic polyadenylation element binding protein 1,CPEB1)可以缩短MMP9的PolyA尾而抑制其翻译,因此,抑制CPEB1的表达则可诱导EMT增强肿瘤细胞的侵袭转移能力[11]。
3.5 EMT的翻译后调控层面
翻译后调控主要指的是影响蛋白稳定的调控方式,包括磷酸化、赖氨酰氧化、泛素化、乙酰化等[11]。其中糖原合成激酶3β(GSK3β)、PKD1等主要调控蛋白的降解,而丝裂原活化蛋白激酶(MAPK)、共济失调性毛细血管扩张突变丝氨酸苏氨酸激酶(ATM-STK)等主要稳定蛋白的表达。如酪蛋白激酶1(CK1)作为启动激酶作用于SNAI1,继之SNAI1被GSK3β介导磷酸化,接着被E3泛素连接酶识别并泛素化降解,最终抑制SNAI1的表达而抑制EMT[11]。而受体酪氨酸激酶(RTK)信号途径可以拮抗GSK3β的磷酸化,稳定SNAI1蛋白的表达。PAK1和LATS2激酶过表达则可以磷酸化SNAI1使其滞留于细胞核内,增强SNAI1核蛋白的稳定性和转录活性。赖氨酰氧化酶样酶2(LOXL2)可以与SNAI1直接相互作用而稳定SNAI1的蛋白表达。组蛋白乙酰化转移酶p300可以乙酰化TWIST1和SNAI1而影响其稳定性、定位以及与其他蛋白的相互作用[11-12,45]。综上,这些不同类型的酶可以在翻译后的调控层面通过不同方式影响EMT-TFs的蛋白稳定进而调控EMT。
4 部分EMT(partial EMT,pEMT)与肿瘤转移的研究进展
尽管EMT的定义直观且易于理解,但EMT在肿瘤转移中的确切作用一直极富争议,其焦点之一在于体内研究极少发现有呈完全EMT状态的肿瘤细胞,而许多肿瘤细胞既表达上皮表型标志物,同时又表达间充质表型标志物;或是上皮表型标志物表达消失而不伴随间充质表型标志物表达的出现。这种不完整的EMT现象促使研究者们又进行了深入探索,并提出pEMT的概念[30,46]。EMT可以在上皮表型和间充质表型之间动态变换的特征,更进一步说明了pEMT的普遍存在,以及这种状态可能往上皮或间充质表型任一阶段倾
5 靶向EMT治疗肿瘤转移的研究进展
基于EMT与肿瘤转移各环节密切相关,因此针对EMT关键调控机制设计靶向干预策略成为治疗转移的研究热点。最初干预EMT的策略是直接阻断或逆转EMT使细胞重新获得上皮细胞特征,例如靶向N-cadherin的ADH-1、靶向TGF-β的Fresolimumab、靶向EpCAM的Catumaxomab以及靶向SNAIL的GN-25等[13,50]。这些研究均已进入I/II期临床实验,然而因EMT调控的多层面、多途径交叉性,导致初期实验结果尚不能令人满意。更甚的是,研究者[46,50]还发现在干预EMT后,细胞在获得上皮特征的同时间充质特征往往不能充分逆转,导致发生pEMT反而可能促进转移。近期,研究者[51]发现循环中的肿瘤细胞到达靶器官后,斜的广泛异质性可能。兼具这种上皮和间充质混合表型称之为亚稳态细胞状态,体现了EMT的可逆性[3,46]。
pEMT最初主要在胚胎发育和器官纤维化中研究较多[47],目前研究认为其对肿瘤转移的意义可能更大,在部分间充质表型获得的情况下pEMT既能赋予原发部位肿瘤细胞迁移潜能,而保留一定程度的上皮表型又可维持部分细胞间黏附,因此可更有效地促进成群肿瘤细胞迁移;同时pEMT也有利于肿瘤细胞到达转移部位后启动肿瘤生长、快速增殖成为大的转移灶[30]。相应地,近年来研究者[11,36,48]在肝癌、皮肤癌、乳腺癌、胰腺癌等多种肿瘤中发现pEMT能明显促进肿瘤转移的启动以及最终临床转移灶的形成,并导致差的预后;特别是采用尾静脉注射肺转移模型中发现发生pEMT的肿瘤细胞最容易发生转移;而单细胞测序技术更在体内从单个细胞层面证实pEMT的存在。这些研究充分提示和证实肿瘤细胞发生pEMT是转移启动和完成的重要机制之一。pEMT也潜在反映了驱动和抑制EMT因素之间的动态平衡,这种平衡也必将受到表观遗传、细胞骨架以及促进细胞迁移和侵袭等多种相关机制调控。EMT-TFs如ZEB、SNAIL和TWIST家族成员是诱导和维持pEMT状态的关键环节[10,49]。肿瘤细胞分泌的TGF-β也可以通过旁分泌方式激活肿瘤相关成纤维细胞(CAFs)诱导pEMT的发生[34]。总之,上皮表型和间充质表型混合的pEMT是肿瘤转移的另一个重要研究热点。微转移灶需发生MET才能形成大的临床转移灶,而逆转EMT可能恰恰促进了大的转移灶的形成。基于此,研究者[11]又提出针对已发生转移的肿瘤患者,应采取策略维持转移肿瘤细胞的间充质表型,使其不进入MET环节而不能形成临床转移灶,进而控制转移的进。最后,诱导发生EMT的肿瘤细胞转分化为其他类型细胞也成为最近的一个研究热点。最新一项研究显示,联合采用MET抑制剂PD98059和罗格列酮成功在动物模型中诱导乳腺癌细胞转分化为脂肪细胞,为靶向EMT治疗转移提供了新的思路[52]。
6 小 结
EMT的研究发展历经100余年,特别是近10余年呈暴发式增长,研究者们无论是在EMT的概念、生物学功能,还是在调控机制及潜在靶向应用等方面都进行了深入研究和系统拓展,EMT已成为肿瘤转移的标志性事件。然而,由于EMT这一生物学过程的广泛异质性,以及在体内监控肿瘤细胞发生EMT的全过程极其困难,因此其在转移各环节中的确切作用仍有待进一步阐明。随着现代分子机制研究领域的不断拓展,已被发现可调控EMT的生物学机制越来越多、越来越复杂,因此,其一方面导致特异性靶向EMT的干预策略敏感性不高,但另一方面却为干预EMT提供了更多的选择。综上,继续深入研究EMT与转移的关联及调控机制,有望在不久的将来开发出更多、更有效的治疗肿瘤转移的靶向药物。

