肺结核患者肺部局灶性磨玻璃样病灶的CT征象分析
吕岩 王珏 李芳 贺伟 周震 穆晶 周新华
近年来随着公众健康意识的提高,低剂量CT检查被广泛应用于日渐增多的居民体格检查(简称“体检”)中,从而越来越多的肺内局灶性磨玻璃样(focal ground-glass opacity, fGGO)病灶被发现。fGGO是多种疾病的肺内表现形式,需要进行多种疾病间的诊断和鉴别诊断,但由于fGGO表现与肺癌密切相关[1-6],在临床中有着更多的关注和研究。虽然fGGO影像在肺结核中为少见征象,但由于与其他疾病的治疗方案截然不同,误诊误治可造成严重危害;加之笔者尚未见fGGO影像表现在肺结核患者中的研究报道,故希望通过对比分析具有fGGO 影像表现的11例肺结核患者和44例肺癌患者的CT扫描特征,提高临床医师对fGGO影像表现的认识及诊断和鉴别诊断能力。
资料和方法
一、一般资料
收集2009—2019年首都医科大学附属北京胸科医院确诊的11例具有fGGO病灶的肺结核患者(肺结核组,11个病灶),其中男4例,女7例,年龄15~67岁,中位年龄35岁;11个病灶的最大径均≤2 cm; 3例经手术后组织标本病理检查、1例经皮肺穿刺活检病理、7例经临床综合诊断且抗结核药物治疗后吸收好转而确诊;10例患者经体检发现,1例患者因肺结核症状就诊且并发其他肺外结核病灶;所有患者均无糖尿病、艾滋病(AIDS)等免疫功能低下疾病及长期使用糖皮质激素史。同时按照1∶4的比例选取同期时间段(距离每一例肺结核患者发现病灶的最近时间)CT表现为fGGO病灶的44例肺癌患者(肺癌组,44个病灶),其中男12例,女32例,年龄19~73岁,中位年龄50岁;原位腺癌2例,微浸润腺癌30例,浸润性腺癌12例;44个fGGO病灶的最大径均≤2 cm;所有患者均经我院手术病理确诊;为与肺结核组患者匹配,也同时排除并发糖尿病及其他系统免疫缺陷者。
二、CT检查方法
使用GE High LightSpeed 16排SCT、64排VCT仪和GE revolution 64排CT仪。患者吸气状态下常规从肺尖至横膈水平进行扫描,层厚5 mm,管电压120 kV,自动管电流。所有病灶进行层厚1.25 mm薄层重建。本研究3例肺结核患者及所有肺癌患者使用非离子型对比剂(碘海醇或碘普胺350 mg I/ml,注射流率为2.5~3.0 ml/s,剂量为100 ml)进行CT增强扫描,肺窗窗宽、窗位分别为1500、-500 HU,纵隔窗窗宽、窗位分别为350、40 HU。
三、图像分析
由3名有经验的高年资放射科医师共同阅片,观察内容包括:fGGO病灶的分布位置,是否位于胸膜下区(与胸膜距离≤1 cm);形态及边缘(与邻近肺野交界面清晰或模糊,有无分叶,有无毛刺);病灶内是否有支气管影或空泡征;病灶内是否存在增粗或扭曲的血管影(根据上下连续层面观察与周围肺野内血管关系);病灶内是否存在结节样影,并观察结节的数量(≥3个定义为多个)及分布状态;病灶内是否存在间质增厚(厚、薄层图像相结合,观察上下连续层面及其走行判断间质改变);病灶内是否具有胸膜凹陷征(典型者计入,与胸膜有索条状粘连者不计)。对比分析两组患者fGGO病灶的以上CT表现特点。
四、统计学处理
采用SPSS 17.0软件进行数据的统计学分析,计数资料的比较采用χ2检验,当最小理论频数值T<1时应用Fisher精确概率法,均以P<0.05为差异有统计学意义。
结 果
一、CT扫描表现
1.病灶分布:11例肺结核患者的fGGO病灶中,位于左肺4例,右肺7例;上叶7例,中叶1例,下叶3例,上叶病灶明显多于中下叶,主要位于上叶尖后段;位于胸膜下区者6例。44例肺癌患者的fGGO病灶中,位于左肺27例,右肺17例;上叶29例,中叶5例,下叶10例,上叶病灶明显多于中下叶,上叶者位于前段居多;位于胸膜下区者20例。两组病灶在上、中、下叶分布见表1,各段分布情况见表2,两组病灶的分布差异均无统计学意义。
2.病灶形态及边缘:肺结核患者的fGGO病灶中,呈圆形或椭圆形4例,病灶形态不规则7例,局部呈方形或与邻近小叶间隔平直形态一致;病灶边缘与肺交界面模糊者10例,仅1例边缘较清晰;6例胸膜下病灶中,3例病灶与胸膜粘连,呈局部相贴或粘连带呈扭曲索条状。44例肺癌组的fGGO病灶中,呈圆形或椭圆形34例,病灶与邻近肺交界面清晰者41例,20例胸膜下区病灶者中13例可见胸膜凹陷征,其中3例叶间胸膜凹陷征呈典型“V状”,边缘清晰僵直。两组间CT征象对比见表3。
3.病灶内部CT表现:11例肺结核fGGO病灶中,密度不均匀者10例,表现为磨玻璃样影伴多发点状结节样病灶,结节呈簇状排列,边缘模糊(图1~6);5例结节样病灶间可见条状分隔样高密度影,符合间质走行。44例肺癌fGGO病灶中,24例密度均匀,均未见多发结节,4例伴单发斑点影;伴有斑片状高密度影及间质增厚者(即病灶内短条状高密度影)各11例,斑片与邻近磨玻璃样影界限较清晰者8例;17例(38.6%)病灶内可见支气管影或空泡,1例空泡内见不全分隔样影;34例(77.3%)可见增粗或走行扭曲的血管影(图7)。具体见表4。

表1 两组患者fGGO病灶在肺叶中的分布情况
注括号外数值为“患者例数”,括号内数值为“构成比(%)”

表2 两组患者fGGO病灶在肺叶各段的分布情况
注括号外数值为“患者例数”,括号内数值为“构成比(%)”;“-”为采用Fisher精确概率法

表3 两组患者fGGO病灶形态及边缘CT表现
注括号外数值为“患者例数”,括号内数值为“构成比(%)”
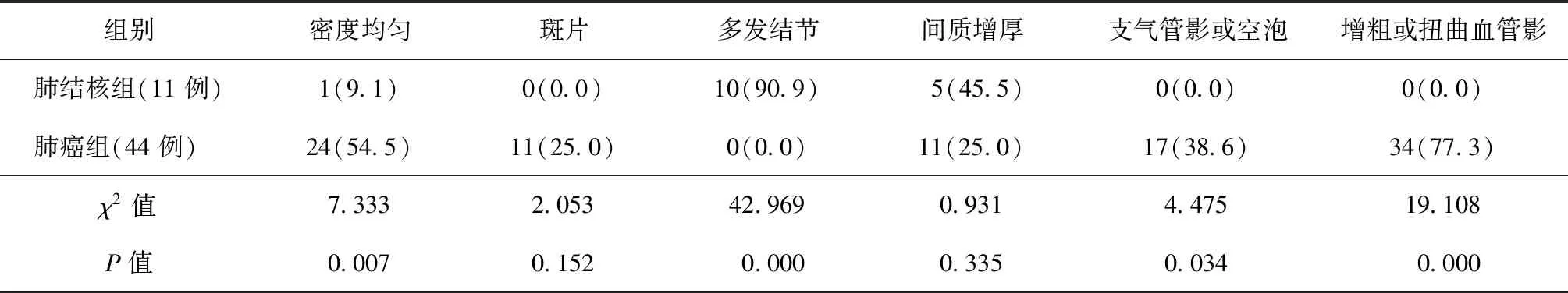
表4 两组患者fGGO病灶密度及内部伴随CT征象分布情况
注括号外数值为“患者例数”,括号内数值为“比率(%)”
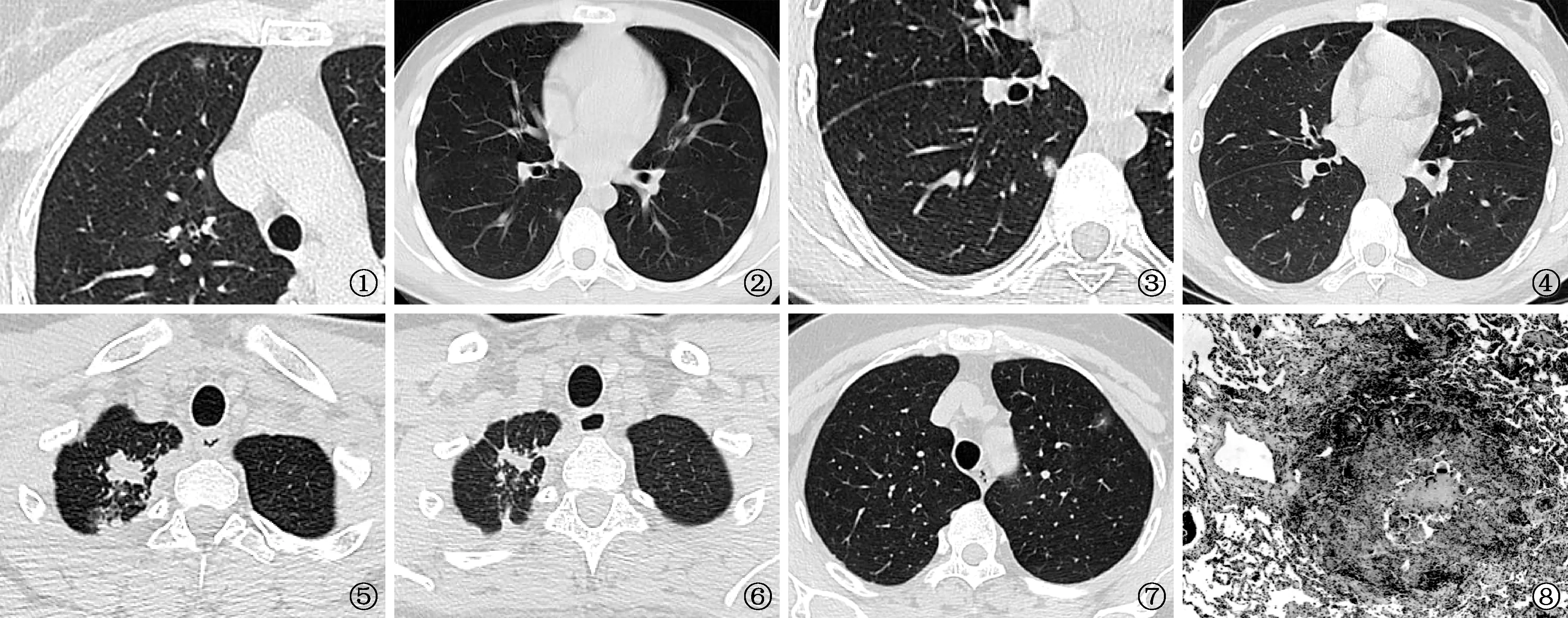
图1 患者,女,56岁。体检发现,术后病理确诊为肺结核。CT肺窗薄层扫描(层厚1.25 mm),显示右肺上叶前段fGGO病灶,边缘模糊,其内见多发点状高密度结节样影,主要位于周边部 图2~6 患者,男,18岁,经抗结核药物治疗临床诊断肺结核。图2~4为同一层面,其中图2、3为治疗前胸部CT扫描图像,图2为5 mm厚层扫描图像,显示右肺下叶背段胸膜下磨玻璃样结节影,边缘模糊,密度较均匀;图3为1.25 mm薄层扫描的放大图像,病灶内见多发点状结节影,呈簇状排列。图4为抗结核药物治疗后CT薄层扫描复查,显示病变吸收。图5、6为该患者同一层面治疗前后2次的CT图像对比,右上肺结核病灶亦见吸收缩小减少 图7 患者,女,52岁。体检发现,手术病理证实为肺腺癌。薄层CT扫描(层厚1.25 mm)肺窗,显示左肺上叶前段fGGO病灶,边缘清晰,可见浅分叶,密度较均匀,内见增粗血管影 图8 同图1患者。术后病理切片检查(HE ×40),可见肺组织慢性炎,较多淋巴细胞浸润,小灶坏死性肉芽肿,肺泡上皮增生
二、fGGO病灶的病理所见
3例肺结核fGGO病灶经手术活检病理、1例经皮肺穿刺活检病理证实,显微镜下可见肺组织慢性炎性反应,较多淋巴细胞浸润及散在淋巴滤泡形成,小灶坏死性肉芽肿,肺泡上皮增生,以及肺泡腔内类上皮细胞肉芽肿和多核巨细胞(图8)。肺癌组病理组织形态表现为:原位腺癌2例,呈肺泡上皮异型增生,肺泡间隔增宽;微浸润腺癌30例,以贴壁生长为主,浸润成分呈腺泡型、乳头型;浸润性腺癌12例,其中组织学亚型5例以乳头型为主,4例以腺泡型为主,3例以伏壁生长为主。
讨 论
肺部fGGO病灶是指在厚层及薄层CT肺窗上均表现为局限性肺野密度轻度增高影,边界清晰或模糊,呈斑片状或结节状;结节形态可呈规则圆形、椭圆形,亦可不规则,但病灶内均可见血管纹理影像,是一种非特异性的影像学表现,不能直接判别为某一种疾病。fGGO病理基础是由于肺泡腔内含气量减少,为液体充填、肺泡上皮细胞增生、细胞数量增多、肺泡间质增厚和终末细支气管部分充填等原因所致;按照病理性质,fGGO可以是良性病变如局灶性炎症(包括非特异性炎症以及肺结核等特异性炎症)、出血等,亦可为癌前病变如非典型腺瘤样增生、原位癌,甚至微浸润腺癌以及浸润性腺癌等。
肺结核主要依据临床表现、实验室及影像学检查、抗结核药物试验性治疗有效等进行综合诊断,而表现fGGO病灶的患者通常无症状,且痰涂片或痰培养多为阴性、血液相关结核病化验指标特异性不高、胸部X线摄片(简称“胸片”)分辨率不高、正电子发射计算机断层显像(PET-CT))对发现fGGO的敏感性较差,使CT扫描成为最有效的检查手段。肺结核CT表现中,典型特征包括斑片、结节、实变伴干酪样坏死、空洞、支气管播散的“树芽征”等多种性状共存的特点,以及相应的好发部位[7-9],一般不难诊断。但当病灶部位发生改变或者出现肺结核少见或不典型的CT扫描形态时,往往诊断困难;必须依据其基本病理变化掌握其渗出、增生和变质性改变的特点[10],并注意病理阶段是在不断变化的且可相互转化,同一患者可同时存在不同病理改变[11-12]。
临床工作中,首次发现较小的fGGO或者磨玻璃样结节(GGN)病灶,依据国内专家共识和国际肺癌或胸科相关研究领域协会对GGO处理指南建议[13-15],通常采用抗感染治疗后复查或者动态观察的方法,对于普通炎症常容易诊断,但当一般抗感染治疗无效、短期内病灶变化不明显时,除考虑癌前病变或者肺癌外,还应该注意一些如肺结核等特异性炎症的危害性,应加以重视与鉴别。
一、发病部位及分布
两组病变在各叶、段之间的分布差异均无统计学意义,但两组病变均上叶多发,上叶病变明显多于中下叶,肺结核上叶者约为下叶的2.33倍,肺癌组上叶者约为下叶病变的2.9倍,虽然两者分布比较差异均未见统计学意义,但肺结核上叶尖后段居多,而肺癌上叶前段居多,可认为肺结核fGGO病灶分布虽与肺癌分布差异无统计学意义,但其分布仍符合肺结核典型的好发部位。
二、CT表现
11例肺结核fGGO病灶中,10例病灶与邻近肺交界面模糊,符合炎性渗出的病理学改变,认为是炎性液体渗出通过肺泡孔向邻近肺野或邻近肺泡间隔扩散致水肿增厚[16],使得CT表现为边界不清;肺结核病变形态以不规则为主,局部呈方形或与邻近小叶间隔形态一致,同样符合炎性病变表现,可能与炎性细胞伴液体渗出,容易受到小叶间隔阻挡有关。一个重要的CT征象值得我们重视,本组11例肺结核病灶中10例fGGO病灶密度不均匀,内见多发点状、结节样稍高密度影,“簇状”排列或周边部出现为主,此种征象既往文献未见报告;对照4例手术病理,分析认为完全符合肺结核的病理生理及免疫学改变,认为是当结核分枝杆菌感染细支气管及肺泡时,是以单核巨噬细胞及淋巴细胞为主的细胞免疫和Ⅳ型变态反应导致的炎性渗出,在影像学上最终表现为fGGO;而多数结核病变经过短暂渗出,随即出现增殖性改变而形成肉芽肿性结节及干酪样变质,填塞到肺泡及肺泡管内,即表现为伴有簇状结节样病灶的磨玻璃样影的原因。当患者抵抗力增强,病变内间质水肿吸收、增生而出现间质增厚的网状改变,周围亦可见到纤维索条状影;如病变靠近胸膜,可与胸膜粘连,但结核病变的胸膜粘连呈局部相贴或粘连带呈扭曲索条状。
44例肺癌患者中,34例(77.3%)fGGO呈形态规则的圆形或椭圆形结节样病灶,41例(93.2%)与邻近肺交界面清晰,从肺癌的病理对照所见,病变区可有不同比例的肺泡上皮异型增生或乳头型、腺泡型及伏壁生长的肿瘤细胞,部分肺泡壁轻度增厚,肺泡腔不完全闭塞,从而CT表现为边缘清晰的fGGO病灶,与文献研究结果一致[17]。另外,肺癌组fGGO病灶内支气管气像或空泡征及增粗扭曲血管影与肺结核组比较差异均有统计学意义,与既往文献研究肺癌fGGO病灶的结果类似[4-5,18];可能与肿瘤组织生长代谢的增加使得所需供血量增加,进而导致供血血管增粗有关[19],或与肿瘤血管趋化生长或释放血管生成因子导致其形态及走行僵直、扭曲或聚集有关[20]。而肺结核组fGGO病灶无此征象,可作为鉴别点。
胸膜凹陷征作为肺癌特征性表现,仅在肺癌组13例患者中出现,但与肺结核组比较差异无统计学意义。分析原因认为,44例肺癌fGGO病灶中近胸膜下区病灶仅有20例,所以总体发生率相对较少,但如果按照20例胸膜下病变中占比计算,发生率可为65%,尤其叶间胸膜处表现更典型,呈边缘清晰僵直的“V状”,与近胸膜的肺结核病灶与胸膜相贴或者与胸膜间索条状粘连带的CT表现截然不同,也可作为鉴别诊断的参考征象。
综上所述,fGGO病灶是肺结核的不典型CT表现,病灶与肺交界面模糊及病变内多发簇状排列的高密度结节样影是与肺癌fGGO病灶相鉴别的相对特征性CT表现;同时,肺结核fGGO病灶中缺乏肺癌病灶内的支气管影、空泡征、扭曲增粗的血管影,以及典型胸膜凹陷征等亦可在鉴别诊断时作为参考。但由于本研究肺结核组患者例数较少,且只有4例病理对照,可能导致结果具有一定局限性并存在一定的偏倚,待今后进一步做大样本多中心研究后加以深入探讨。
志谢本院科研办姜慧和流行病学研究室康万里两位老师对本文统计学处理中进行了悉心指导。

