小鼠CYP2J5基因组织差异表达及蛋白质结构与功能分析
白 皓, 路宏朝, 王 令, 王珊珊, 杜伟立, 张 涛
(陕西理工大学 生物科学与工程学院,汉中 723000)
细胞色素P450,家族2,亚家族j,多肽5(Cytochrome P450,family 2,subfamily j,polypeptide 5,CYP2J5)属于细胞色素P450(Cytochrome P450,CYP450)超家族,CYP2J亚家族的一员。CYP450是一种含血红素的酶,其能催化多种异生素和内源性化合物的代谢[1-2],包括临床药物、环境污染物及化学致癌物,因此一直是毒理学家和药学家研究的重点[3-5]。CYP2J亚家族可以将哺乳动物细胞膜中的多不饱和脂肪酸花生四烯酸(Arachidonic acid,AA)环氧化为具有生物活性的环氧二十碳三烯酸(EETs)或羟基化为羟基二十碳五烯酸(HETEs)[6]。相关研究发现EETs在血管扩张、抗炎、心脏保护、纤维蛋白溶解和血管生成方面都有作用,且在体外和体内均有影响[7]。King等[9]研究发现CYP2J2基因中的单核苷酸多态性与人类高血压有关。Athirakul等[10]研究发现小鼠的CYP2J5可将AA和亚油酸代谢为EETs,从而具有调节肾小管功能和血管张力的能力。研究显示,CYP2J5在肾脏中含量丰富,尤其是在肾近端小管中[11]。此外,CYP2J5蛋白在AA对EET的代谢过程中具有活性。Ma等[12]研究发现在小鼠青春期后,随着小鼠年龄的增长在雄性小鼠肾脏中CYP2J5蛋白表达水平比雌性小鼠更高,并发现CYP2J5蛋白的表达由性激素调节,但具体调节机制并不清楚。
鉴于此,本研究通过分析小鼠CYP2J5基因在不同组织的表达差异、生物信息学特征、构建超表达载体并检测相关通路关键基因表达差异,以期为今后研究CYP2J5基因对生物学过程的调控奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 供试动物
选取3只90日龄C57BL品系雄性小鼠,实验室小鼠均购自空军军医大学实验动物中心。
1.1.2 主要试剂与仪器
限制性内切酶、PrimeScript反转录试剂盒、SYBR Premix E×TaqTMⅡ试剂和ECL曝光液由TaKaRa公司提供;Q5Taq和T4 DNA连接酶购自New England Biolabs公司;含10% FBS的高糖DMEM培养基(Gibco);Lipofectamine 2000(Invitrogen);细胞总蛋白提取试剂盒(HEART);HRP标记的二抗(康为世纪,1∶1000);GeneGnome XRQ化学发光系统(Synoptics, USA);倒置荧光相差显微镜(Leica, DFC450, USA);实时荧光定量PCR仪购自美国ABI公司;TM3细胞购自上海赛百慷公司。
1.2 方法
1.2.1CYP2J5基因组织差异表达
分别取3只90 d小鼠肺、心、肝、肾、皮肤、肌肉、小肠和睾丸8种组织,采用Trizol法提取雄性小鼠肾脏组织总RNA,核酸/蛋白浓度测定仪检测其浓度。以总RNA为模板,Oligo(dT)为引物(表1),按照PrimeScript(TaKaRa)反转录试剂盒说明,反转录获得相应cDNA。以鼠β-actin作为内参基因,采用实时荧光定量PCR检测小鼠不同组织中CYP2J5基因的mRNA表达水平,每种组织设置3个重复。扩增体系:SYBRⅡ (TaKaRa) 5 μL,Primer F/R 0.8 μL,cDNA 1 μL,H2O 2.4 μL。反应程序:95 ℃预变性10 min;95 ℃变性15 s;60 ℃退火1 min。溶解曲线收集信号的程序:95 ℃预变性15 s;60 ℃变性1 min;95 ℃退火15 s。
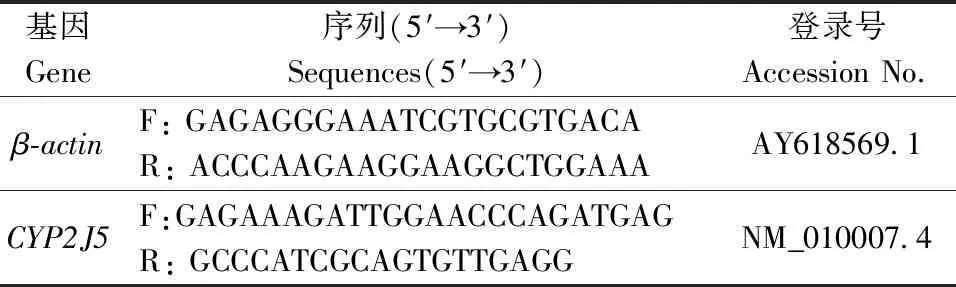
表1 目的基因引物信息
1.2.2 生物信息学分析
利用ProtParam(https://web.expasy.org/protparam/)分析蛋白理化参数;利用Protscale(https://web.expasy.org/protscale/)分析蛋白亲疏水性;利用Signal IP 4.1(http://www.cbs.dtu.dk/services/SignalP/)分析蛋白信号肽;利用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析蛋白跨膜区结构;利用PSORT Ⅱ(https://psort.hgc.jp/form2.html)分析蛋白亚细胞定位;利用STRING 10.5(https://string-db.org/cgi/access.pl?sessionId=ZeLv9N87S0Ow&footer_active_subpage=archive)进行分子功能预测;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析蛋白二级结构;利用SWISS-MODEL(https://swissmodel.expasy.org/)同源建模预测蛋白三级结构。
1.2.3 引物设计与合成
参照小鼠CYP2J5基因(GeneBank登录号:NM_010007.4),应用Primer 5.0软件设计其CDS区引物。上游引物CYP2J5-HA-F 5′-CCAAGCTTATGTACCCATACGATGTTCCAGATTACGCTATTATGTTTTTGAGCTCCCT-3′,下游引物CYP2J5-HA-R 5′- GCTCTAGATCACACTCTAGGGATAGCAC-3′,单下划线表示Hind Ⅲ酶切位点,双下划线表示XbaⅠ酶切位点,加粗部分为HA标签。
1.2.4CYP2J5基因扩增和克隆
以小鼠肾脏cDNA为模板,进行PCR扩增。扩增体系分别用CYP2J5-HA-F、CYP2J5-R和CYP2J5-F、CYP2J5-HA-R为引物。Q5Taq50 μL体系扩增CYP2J5 A、B两段,后overlap-PCR扩增含HA标签的CYP2J5基因CDS区全长。PCR产物经1%琼脂糖凝胶电泳检测后由DNA纯化试剂盒回收。加A试剂盒后与载体pMD19-T于16 ℃过夜连接后转化至E.coliTop10感受态细胞。以通用引物M16-F/M16-R为引物采用菌落PCR,Hind Ⅲ和XbaⅠ双酶切以及测序鉴定,获得重组载体PMD19-T-CYP2J5-HA。
1.2.5 真核超表达载体的构建
Hind Ⅲ和XbaⅠ双酶切纯化PMD19-T-CYP2J5载体和骨架载体pCDNA3.1,然后用T4连接酶连接后转化至E.coliTop10感受态细胞于37℃过夜培养。以CMV-F/CYP2J5-HA-R为引物采用菌落PCR和双酶切鉴定,获得重组载体pCDNA3.1-CYP2J5-HA。
1.2.6 重组载体表达分析
将已构建好的pCDNA3.1-CYP2J5-HA重组载体转染至TM3细胞中,空载pCDNA3.1作为对照组。Opti-MEM稀释质粒和Superfect转染试剂后静置5 min,混合质粒及转染试剂后静置30 min,加入细胞培养皿,于细胞培养箱培养。48 h收取RNA样品;72 h收取蛋白样品,通过Western Blot检测其超表达水平。
1.2.7 脂代谢与性激素通路基因检测
采用Trizol法提取实验组与对照组细胞RNA,核酸/蛋白浓度测定仪检测其浓度。以总RNA为模板,Oligo(dT)为引物(表2),按照PrimeScript(TaKaRa)反转录试剂盒,进行反转录反应,合成相应的cDNA。以cDNA为模板,选取小鼠β-actin作为内参基因。采用实时荧光定量PCR检测CYP2J5基因及脂代谢与性激素相关基因mRNA表达水平。扩增体系:SYBRⅡ (TaKaRa) 5 μL,Primer F/R 0.8 μL,cDNA 1 μL,H2O 2.4 μL。反应程序:95 ℃预变性10 min;95 ℃变性15 s;60 ℃退火1 min。溶解曲线收集信号的程序:95 ℃预变性15 s;60 ℃变性1 min,95 ℃退火15 s 。

表2 性激素通路基因引物信息
2 结果与分析
2.1 小鼠不同组织中CYP2J5表达水平
以小鼠β-actin为内参基因,qPCR技术检测小鼠8种组织中CYP2J5表达水平。结果显示,在小鼠肺、心、肝、肾、皮肤、肌肉、小肠和睾丸共8种组织中均可检测到CYP2J5的表达,说明该基因广泛表达,在不同组织中均发挥相对重要的功能。实验结果显示肺组织中的CYP2J5表达量最低,肝脏中表达最高,其次是心、皮肤、肌肉、小肠和睾丸。以肺组织的表达水平为参照,该基因在心、肝、肾、皮肤、肌肉、小肠中表达量与其相比较差异极显著(P<0.01),睾丸中表达水平与肺组织之间没有显著差异(图1),结果说明CYP2J5基因在不同组织中的生物学功能存在一定差异。
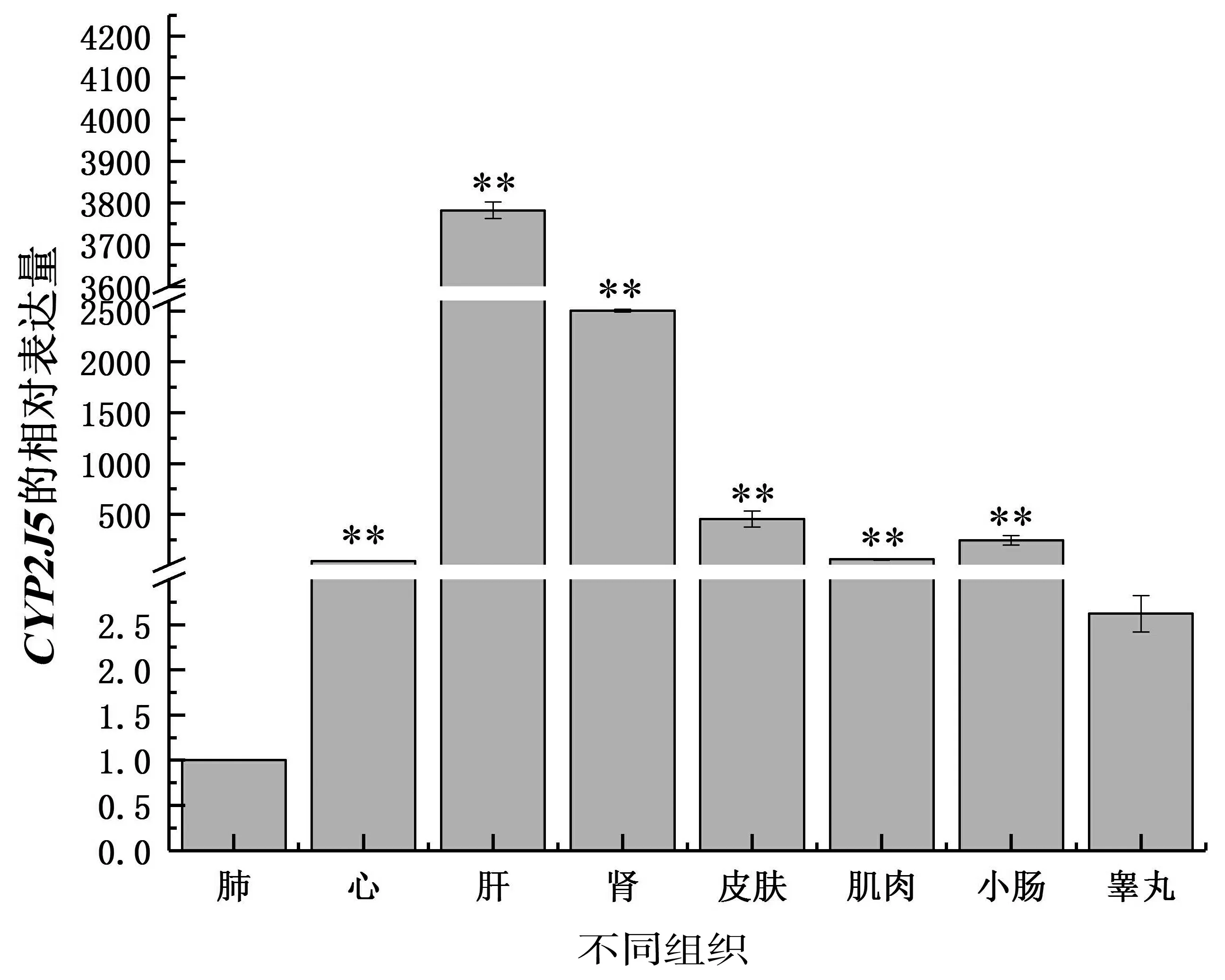
**表示差异极显著(P<0.01)
图1小鼠CYP2J5基因组织表达谱
Figure 1 Relative mRNA expression ofCYP2J5 at different tissues in mouse
2.2 生物信息学分析
2.2.1 理化性质分析
利用ProtParam软件分析小鼠CYP2J5蛋白的理化性质,分析结果见表3。
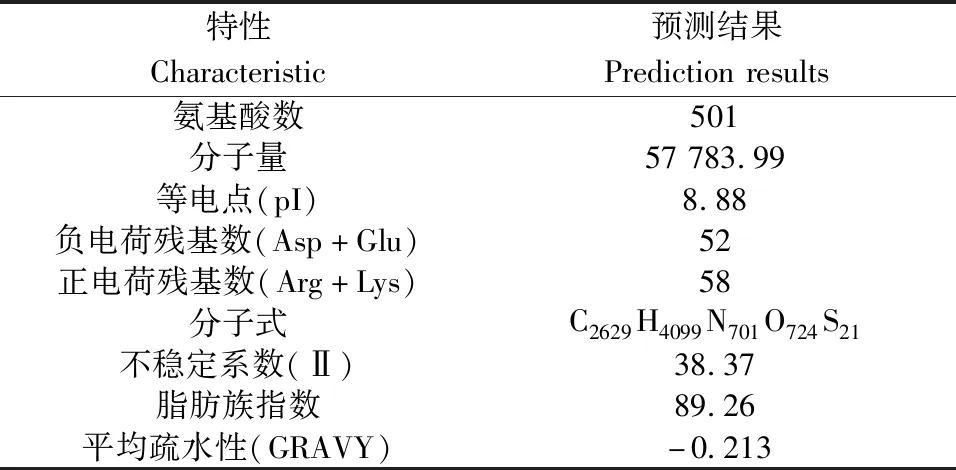
表3 小鼠CYP2J5蛋白的理化性质分析
2.2.2 疏水性分析
利用Protscale软件进行小鼠CYP2J5蛋白亲疏水性分析,结果见图2,正值表示疏水,值越大疏水性越强;负值表示亲水,值越低亲水性越强。第25位缬氨酸(Val)疏水性最强(3.100),第267位赖氨酸(Lys)亲水性最强(-3.100)。按分值大小(Score<-2)划分,CYP2J5蛋白属于可溶性蛋白质。
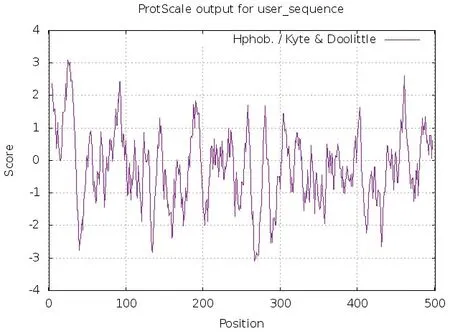
图2 CYP2J5蛋白的疏水性预测
2.2.3 信号肽及跨膜信号分析
利用Signal IP 4.1软件进行CYP2J5蛋白信号肽分析,结果(见图3)显示,C值为剪切位点值,S值为信号肽分值,Y值为综合分值。其C、Y、S最大值分别为0.283、0.248和0.725。以上数据得知此蛋白有信号肽存在。
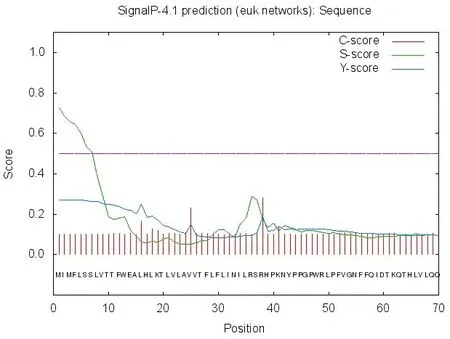
图3 CYP2J5蛋白信号肽预测
利用TMHMM 2.0软件进行CYP2J5蛋白跨膜区结构分析,结果见图4。表明蛋白存在跨膜区,跨膜区在第13~35及75~97个氨基酸之间。
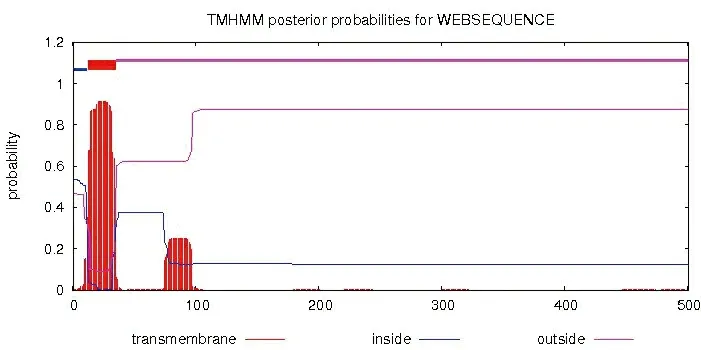
图4 CYP2J5蛋白跨膜区结构分析
2.2.4 亚细胞定位分析
利用PSORTⅡ软件进行亚细胞定位分析,结果发现,小鼠CYP2J5蛋白在细胞质、线粒体、细胞核和内质网的分布比例分别为39.1%、17.4%、17.4%和13.0%。该蛋白属于细胞质蛋白质。
2.2.5 分子功能预测分析
为了分析CYP2J5的潜在分子功能,利用String 10.5预测与CYP2J5相互作用的蛋白质,结果如图5所示。Ugt2b5、Cyp4a12a、Cyp4a12b、Cyp3a11、Cyp3a41a、Cyp4a10、Cyp3a25、Ugt2b1、Cyp2c70和Ephx2共10个蛋白质与CYP2J5相互作用(分值>0.9)。
对以上10种蛋白质编码基因进行GO注释,发现这些蛋白主要参与细胞脂代谢和脂肪酸代谢等生物调节过程。如单细胞生长过程(GO:0055114)、单羧酸代谢过程(GO:0032787)、细胞脂代谢过程(GO:0044255)、脂肪酸代谢过程(GO:0006631)、二十烷类代谢过程(GO:0006690)等生物过程相关的GO条目分别富集9个、5个、5个、4个和3个基因。
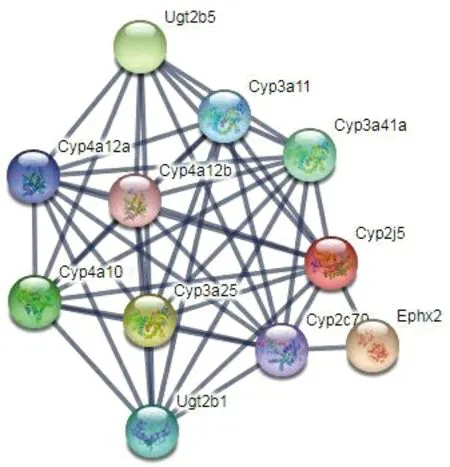
图5 与CYP2J5相互作用的蛋白质
2.2.6 结构预测
利用SOPMA软件预测CYP2J5蛋白二级结构,结果如图6。CYP2J5蛋白的二级结构237个氨基酸为α-螺旋,56个氨基酸为延伸链,177个氨基酸为无规则卷曲和31个氨基酸为β-转角,分别占47.31%、11.18%、35.33%和6.19%。
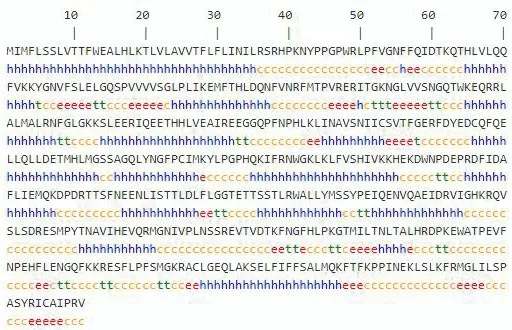
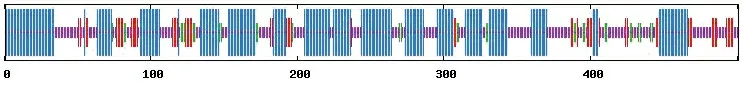
H:α-螺旋;e:延伸链;t:β-转角;c:无规则卷曲
图6小鼠CYP2J5蛋白二级结构预测
Figure 6 Prediction of secondary structure of mouse CYP2J5 protein
利用SWISS-MODEL同源建模预测三级结构,结果(如图7)表明,其三级结构主要由17个α-螺旋和14个β-转角组成,与预测二级结构结果相符,只有一个p450功能结构域,位于第44~496氨基酸序列间,主要参与多种化合物的氧化降解。
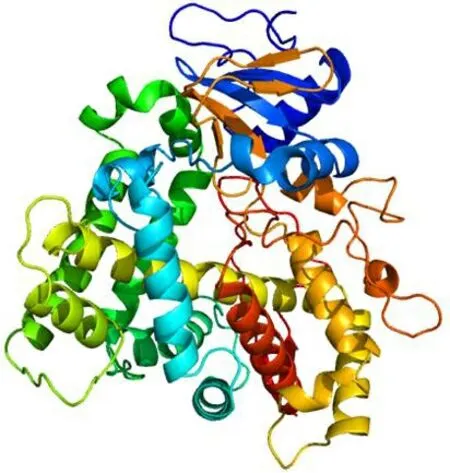
图7 小鼠CYP2J5蛋白三级结构预测
2.3 Overlap-PCR扩增CYP2J5基因与TA克隆
以小鼠肾脏cDNA为模板,overlap-PCR扩增后经1%琼脂糖凝胶电泳检测,1号泳道出现与1533 bp大小一致的片段。回收含HA标签的CYP2J5片段与pMD19-T连接转化后挑取21个单菌落,菌落PCR检测,发现3、17号菌落符合目的条带大小。测序鉴定表明3号质粒为成功克隆的含HA标签的CYP2J5基因CDS区序列(图8和图9)。

M:DNA 标准 DL2000
图8CYP2J5基因的PCR扩增
Figure 8 PCR amplification ofCYP2J5 gene
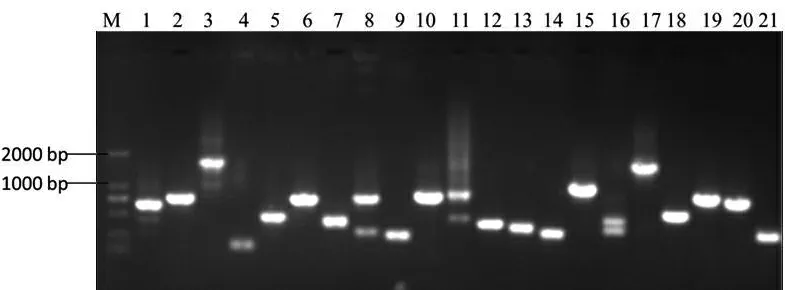
M:DNA 标准 DL2000; 1~21:单克隆菌落
图9菌落PCR鉴定
Figure 9 Identification of colony PCR
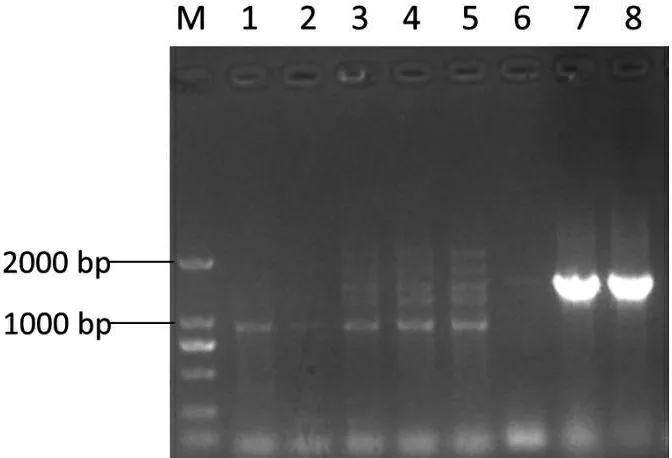
M:DNA 标准 DL2000; 1~8:单克隆菌落
图10菌落PCR鉴定
Figure 10 Identification of colony PCR
2.4 CYP2J5真核超表达载体构建
从培养皿挑取8个单克隆进行菌落PCR鉴定,电泳检测发现7、8号泳道有单一条带,大小约为1664 bp,与目的片段大小一致(图10);然后选取7和8号单克隆,提取质粒双酶切鉴定。结果表明8号质粒能切出1533 bp的含HA标签的CYP2J5基因和骨架载体两条带,与预期结果相一致,说明成功构建重组表达载体pCDNA3.1-CYP2J5-HA(图11)。
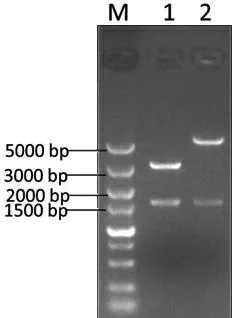
M:DNA 标准 DL5000; 1~2:双酶切产物
图11pCDNA3.1-CYP2J5-HA酶切验证
Figure 11 Enzyme-digested products of plasmids
2.5 超表达载体表达分析
将pCDNA3.1-CYP2J5-HA重组载体转染至TM3细胞,72 h后收取细胞蛋白样,Western Blot检测转染之后CYP2J5蛋白表达情况。结果发现,超表达组在59 ku出现与目的条带大小一致条带(图12)。实验证明成功构建CYP2J5超表达载体。
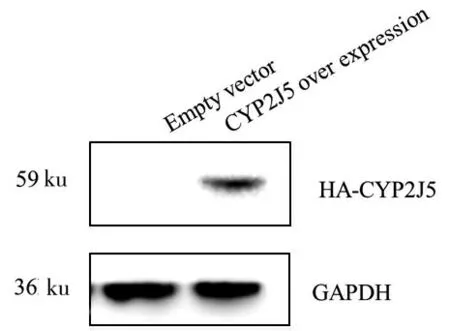
图12 CYP2J5蛋白表达水平
2.6 脂代谢与性激素相关基因检测
以小鼠β-actin为内参基因,qPCR技术检测TM3细胞中CYP2J5及脂代谢与性激素相关基因表达水平。结果显示,超表达CYP2J5基因之后,脂代谢通路关键基因脂蛋白脂肪酶(Lipoprotein lipase,LPL)、硬脂酰-辅酶A去饱和酶1(Stearoyl-Coenzyme A desaturase 1,SCD-1)和FK506结合蛋白51(FK506 blinding protein 51,FKBP51)表达量显著降低(P<0.01),脂肪酸结合蛋白4(Fatty acid binding protein 4,FABP4)表达量显著增高(P<0.01),具体见图13。性激素通路关键基因蛋白激酶A (cAMP-dependent protein kinase,PKA)表达量显著降低(P<0.01),类固醇生成因子-1(Steroidogenic factor-1,SF-1)基因表达量显著增高(P<0.05),磷脂酶C(Phospholipase C,PLC)基因表达量无显著差异(图14)。
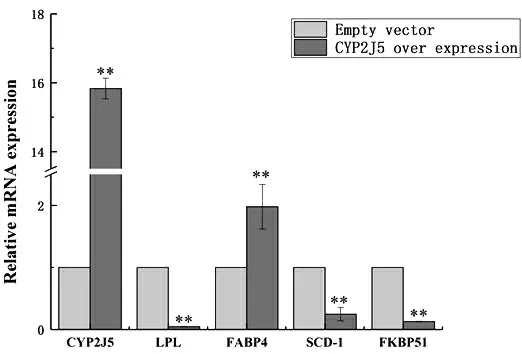
图13 脂代谢通路基因表达谱
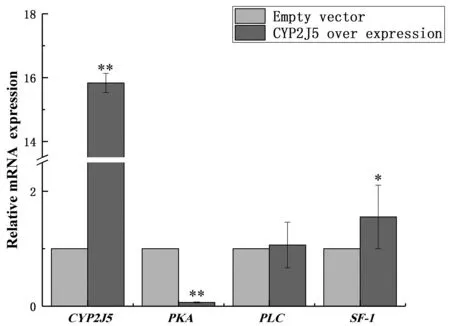
图14 性激素通路基因表达谱
3 讨论
CYP450家族是一种含血红素的酶,可以参与内源性底物的代谢,包括花生四烯酸和类固醇激素的代谢,代谢产物会影响肾脏中电解质的转运和血管张力,可能影响肾功能和血压调节能力[4,13]。CYP2亚型可通过氧化花生四烯酸生成4种同源异质的5,6-EET、8,9-EET、11,12-EET或14,15-EET和EETs,通过肾脏和血管作用降低血压,并可能改善葡萄糖稳态[14]。陈文树等[15]构建大鼠肺缺血再灌注损伤模型,发现CYP2J2过表达或外源性EETs可减轻再灌注导致的氧化应激及凋亡,并对损伤有正调节作用,说明CYP2J2对血管内皮细胞具有调节能力。戴梅艳[16]发现超表达CYP2J2后其产物EETs可以改善组织炎症信号通路和胰岛素通路,抑制炎症并改善高脂饮食诱导的胰岛素抵抗。油文亭[17]发现CYP2J3可显著增强心肌细胞活力并抑制凋亡,对心肌细胞起保护作用。Athirakul等[10]敲除小鼠CYP2J5基因后发现其发育正常并且无明显肾脏病理学特征。进一步研究发现CYP2J5基因的缺失与血压升高、近端肾小管转运速率增加和血管紧张素Ⅱ及内皮素Ⅰ过度传入小动脉反应有关。Leon等[18]通过荧光共振能量转移技术证明了小鼠CYP2J5蛋白与微粒体环氧化酶(mEH)存在相关性。CYP2J5本身具有花生四烯酸环氧化酶的特征,CYP2J5和mEH在小鼠海马神经元中的共定位,另外,mEH有助于花生四烯酸环氧化物的脑转换,表明mEH在调节这些重要内源信号分子时具有重要作用,并可能与CYP2J5相互协调发挥作用。
前期的酵母双杂交实验发现CYP2J5蛋白与维生素D受体(VDR)存在互作关系[19],并发现CYP2J5基因可能与雄性生殖和激素代谢等生物学功能有关。因此本研究欲通过qPCR、生物学信息学预测分析、CYP2J5基因载体构建和小鼠TM3细胞中过表达效应分析等方面系统探索CYP2J5在雄性生殖方面的生理作用。研究发现CYP2J5在小鼠肺、心、肝、肾、皮肤、肌肉、小肠和睾丸共8种组织中均有表达,且在肝脏和肾脏中表达水平相对最高,说明该基因生物学功能比较广泛,并可能主要参与脂类、激素代谢和维持机体内环境稳态的作用。生物信息学分析发现该蛋白属于可溶性蛋白质,有信号肽存在并在第13~35及75~97个氨基酸之间存在跨膜区。亚细胞定位分析发现其属于细胞质蛋白质。高级结构预测显示,CYP2J5蛋白含有47.31%的α-螺旋,11.18%的延伸链,35.33%的无规则卷曲和6.19%的β-转角,且第44~496氨基酸序列间有一个p450功能结构域,主要参与多种化合物的氧化降解。通过功能分析,发现了10个与CYP2J5相互作用的蛋白质,GO注释分析它可能主要参与细胞脂代谢和脂肪酸代谢等生物调节过程,该预测结果与文献报道的CYP450家族蛋白的功能基本一致[20],也符合本研究前期的结果分析和实验预期[19]。本研究成功构建了带有HA标签的CYP2J5基因超表达载体,并在TM3细胞超表达CYP2J5分析脂代谢与性激素通路关键基因的表达情况,发现脂代谢通路关键基因LPL、SCD-1、FKBP51表达显著下降,FABP4表达显著上升;性激素通路关键基因PKA表达显著下降,SF-1表达显著上升。表明CYP2J5在脂代谢及性激素过程中可能发挥重要作用,并可能具有调控机体脂肪酸代谢及性激素合成的能力,这一实验结果进一步确认了生物信息学预测的生物学功能。CYP2J5基因在小鼠肾脏和肝脏中高表达并显著影响脂代谢与性激素通路关键基因,进一步表明该基因可能对血压血糖、糖代谢、脂代谢及性激素代谢具有生理调控作用。
4 结论
本研究成功克隆CYP2J5基因并系统地对其理化性质及蛋白结构进行预测,构建其表达载体并检测脂代谢与性激素通路关键基因,为研究CYP2J5基因对脂代谢、性激素和血压血糖调控机制提供理论基础。

