应用双能计算机断层水肿图改进脑卒中介入治疗后早期梗死的可视性
李鹏飞 赵施竹
河南省鹤壁煤业公司总医院神经内科,河南省鹤壁市 458000
脑卒中介入治疗(Endovascular stroke treatment,EST) 是急性脑卒中患者近端脑内病变治疗的重要方法,无论是否进行溶栓。使用计算机断层(CT)扫描排除颅内出血(Intracerebral haemorrhage,IH)[1]或确定ASPECTS评分[2],EST后使用CT,高密度IH与高密度的血脑屏障(Blood-brain barrier,BBB) 破坏有时难以区别。这二者都可以掩盖潜在进展脑梗死[3]。DECT能够可靠区分IH和造影剂外渗,也可用于EST之前的梗死早期检测[4]。 DECT技术是基于光和物质相互作用,并且依赖物质和放射能量。 三种物质分解技术(Three-material decomposition technique,TMDT)可以重建混合图像,即物质图,在使用造影剂时则谓之碘图(Iodine map,IM),或虚拟非对比(Virtual noncontrast,VNC)图[5-6]。此技术应用可量化三种物质混合成分,包括碘和血液之间的区分,检出肺栓塞或心肌缺血、动脉粥样硬化斑块、痛风病变影像或金属伪影消除[7-8]。近来,DECT派生TMDT新用途是尽可能早期检测脑水肿与梗死[8-9]。这些改良VNC系列[8]或骨髓水肿系列,称为“X线图”[9]。此技术基于脑的主要组成为白质(White matter,WM)、灰质(Grey matter,GM)和水,WM和GM之间吸收不同是由于脂质成分不同,而梗死发生过程中积聚相对多数量的水。本研究的目的是评价改良GM和水含量图,即“水肿图”,是否能够在EST后比标准VNC或BW系列更好发现早期脑梗死。
1 对象和方法
1.1 观察对象 选取2016年1月—2018年6月共46例患者进入研究,男25例,女21例,平均年龄63岁(35~90岁)。患者入院后即刻进行CT检查,并进行EST及治疗后DECT检查。从发病至DECT扫描时间为(6±2)h。所有患者进行血管介入治疗。
1.2 双能计算机断层 使用DECT扫描仪(Somatom Definition Flash,Siemens Healthcare,Erlangen,Germany)在EST后1h内进行脑扫描,管电压和管电流分别为100kV和360mA及140kV和360mA,螺距因子0.45,采集模式增量,准直32mm×0.6mm, 层厚4mm,图像内核H30f,中度光滑,视野200mm。
1.3 图像重建 所有二次重建图像与源图像的轴向排列一致,显示视窗200mm,图像矩阵512 ×512像素(EM和BW系列层厚4mm,增量4mm;内核:H30f中度光滑;标准VNC系列层厚1mm,增量1mm)。图像重建在专用后处理工作站进行(Brain Hemorrhage;Syngo CT workplace 2012B,Siemens Healthcare,Erlangen, Germany)。EM设定是根据18例患者数值确定, EM是可视化GM和水含量的成像方法,是在假设脑由GM、WM和水组成前提下生成的[9]。18例患者的GM密度100kV时为(38.7±2.7) HU、Sn140kV时为(31.4±3.1)HU,WM的密度分别为(29.7±1.8)HU(100kV)和(27.1±0.6) HU(Sn140kV)。 梗死灶密度为(29.5±3.8)HU(100kV)和(25.8±3.7)HU(Sn140kV)。与WM密度相似。 最终选定39/31HU(100kV/Sn140kV)生成EM第一个组件, 30/26HU为第二组件。 选取斜率1.3,因其或使梗死达到最好主观视觉效果。优化EM系列使梗死可视化更理想,可以补偿GM和WM之间的差别,与文献一致[10]。 EM 系列比源图像噪声高,与颅骨相邻大脑周围呈现相对稍低密度 ,然而总的质量很好。
1.4 图像分析 所有患者EM和其他系列的梗死主观可检测性由两名经验丰富专家评估。成像数据按随机顺序呈现。梗死和邻近大脑视觉对比(1=对比良好; 2=中度;3=低度;4=无法对比)及图像噪声出现(1=无噪声;2=小噪声不影响梗死评价;3=中度噪声对梗死评价稍有影响;4=严重噪声明显影响梗死评价)评定依据相关文献进行[3]。
1.5 随访影像 随访影像评价由2名经验丰富专家在治疗后(24±4)h进行,分析随访影像评估梗死(图1和图2),患者进行标准化CT(n=32)或弥散/和磁敏感加权成像(SWI)序列(n=14)。应用内部图片存档和通信系统(PACS;IMPAX EE R20 XIV v2014,Agfa,Mortsel,Belgium)和专用工作站测量密度兴趣区(ROI),将3个 ROIs (直径5~10mm)放置在每位患者明显梗死区及相应对侧区域。 从平均组织密度出发,计算各系列上与脑梗死对侧差异(CID),作为两组织对比的客观指标。所有重建DE序列中和随访成像的梗死体积采用三维后处理工作站(Advantage Workstation 4.6/VolumeShare 5;General Electric Company; Fairfield,CT,USA)测量。为此,所有系列进行数字化传递到工作站。 梗死是在轴向平面上使用标记工具进行环形标记。一旦在所有切片中标记完毕,该对象就会被“剪刀工具”在所有切片中进行裁剪,保留选定的部分。在此之后,可以使用另一个工具来确定梗死体积。

图1 尾状核(红色箭头)和壳核(黒色箭头)缺血性病变示例
注:BW(A)、VNC(B)和EM(C)系列图像。BW和VNC图像病变显示不太清楚,而EM图像可清楚识别低密度梗死灶。图D为随访CT描绘梗死范围。
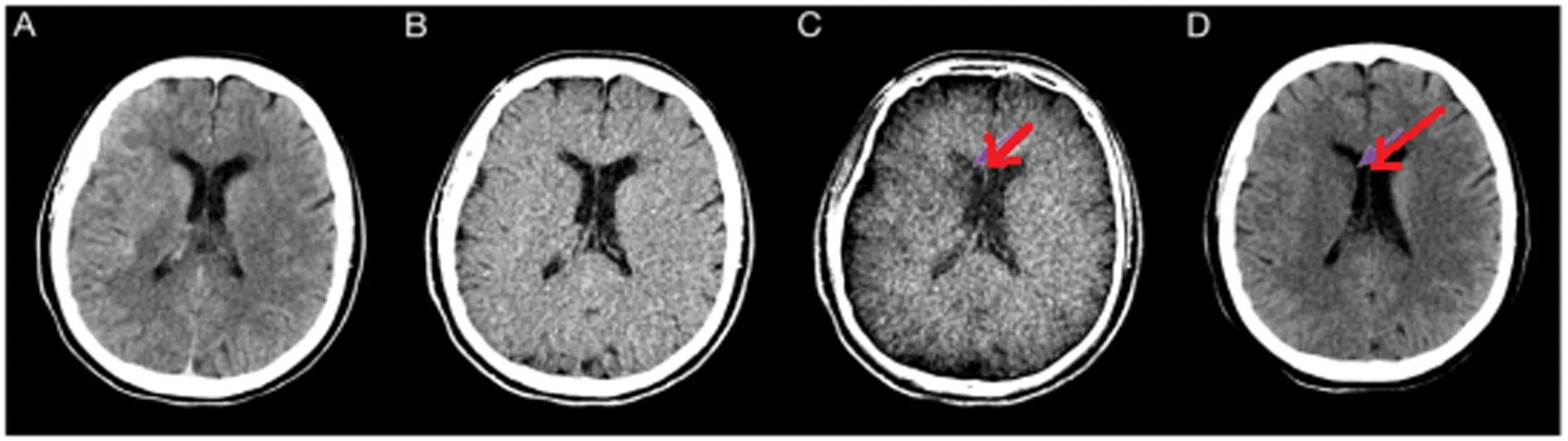
图2 尾状核梗死示例
注:BW(A)、VNC(B)和EM(C)图像。EM图像梗死灶显示与邻近脑实质相对明显的对比(箭头所示)。D为随访CT结果(箭头所示)。
1.6 统计学方法 使用GraphPad Prism,Version 7(GraphPad Software Inc,La Jolla,CA,USA)和 SPSS23。连续性数值组应用Mann-Whitney检验或Kruskal-Wallis检验及Dunn’s事后。分类变量比较使用χ2检验。ROC分析用于确定各系列敏感性和特异性。由ROC图派生优登指数的最大值分析计算分界值[11]。两位解读者之间的内部分级变异应用组内相关系数(ICC) 或Cohen’s kappa 系数确定。取P<0.05为差异有统计学意义。
2 结果
描述性资料见表1,共确定110处梗死,95处为幕上,15处为幕下:丘脑7处、壳核22处、尾核12处、脑桥4处、小脑11处、岛叶19处、在枕叶8处、额叶6处、颞叶11处、顶叶10处。EM系列梗死灶密度最低(1.64±4.25)HU,其次是VNC(25.44±5.51)HU和BW(37.49±13.75)HU。EM显示最高 CIDs(73.34±49.32)HU,高于VNC(8.30±4.74)HU和BW(-1.72±13.29)HU。 EM上,周围梗死密度(8.67±26.13)HU高于幕下梗死密度(-2.72±50.07)HU与中央梗死密度(-4.44±57.59)HU(P=0.628)。 密度测量和梗死体积的等级内一致度很好(表1)。第一位读片者对EM系列110处梗死检出99处(90.0%),第二位读片者为100处(90.9%),显著优于 VNC 或 BW系列(P<0.01)。 梗死的可检测性独立于梗死部位:第一位读片者46处深部脑梗死在EM系列上确定44处,49处幕上梗死确定22处;第二位读片者分别确定45/46处和 44/49处。 进而,经EM系列第一位读片者确定11/15处幕下梗死,第二位读片者确定89/95处幕上梗死和11/15处幕下梗死。

表1 脑窗(BW)、虚拟非增强(VNC)和水肿图(EM)系列及随访图像(FU)影像学检查的资料
梗死可检测性的ROC分析,临界值< 50.70 HU时,EM系列显示最大的曲线下面积(AUC=0.97,P<0.01),最高的敏感性(90.91%)和特异性(93.64%)及优登指数(0.84) ;然后是VNC(AUC=0.91,P<0.01;敏感性=80.91%;特异性=90.91%,优登指数=0.72)和BW系列(AUC=0.54,P=0.27;敏感性=40.00%;特异性=79.09%;优登指数=0.19)。
主观视觉评价方面,EM 系列显示最高的视觉梗死对比(2.30±1.20,P<0.01),其主观影像噪声亦最严重 (2.37±0.70,P<0.01)。 VNC 系列 (3.25±0.85) 梗死对比较低,BW系列最低 (3.57±0.70,P=0.02)。BW系列噪声(1.21±0.51)稍低于VNC(1.28±0.55),(P=1.00),4例患者发生出血转化,1例为右侧岛叶、1例为右侧壳核、1例为左侧丘脑、1例为左侧尾核。
3 讨论
本研究中,改良VNC系列重建DECT检查 ,能够更好检出早期脑梗死,优于标准BW或VNC系列。这种方法又称为水肿图,即EM,它可以描述为改良GM水地图[9],由TMDT生成,最初用于EST后检测梗死。EM系列显示显著低的梗死客观密度值,在梗死和相应对侧区之间密度差异较高,假定其代表梗死可检测性,EM系列检测能力远远优于其他系列。EM系列对梗死的主观检测能力非常优秀,其敏感性和特异性最大,虽然具有最大的噪声,仍然优于其他系列。读片者之间的可重复性很高。
脑卒中期间,常常发生BBB破坏,这比出血转化更加多见。如果出现BBB的破坏,EST期间碘CA应用导致造影剂染色脑组织,可能会掩盖BW系列脑梗死病变,而VNC不然[3]。在这种情况下使用CA,DECT是区别造影剂染色和IH的实用工具[4-7],可能优于常规VNC系列对EST后患者梗死范围的检测[12]。不过,EST后24h,在大多数情况下BW系列能够看到梗死。最近两项使用DECT的研究目的是为了印证梗死发生后尽可能早发现梗死[8-9]。检测率具有可比性, Mohammed 等得出的敏感性为93.3%,特异性为100%,而文献[9]则“与DWI相似”,本研究分别为90.91和93.64%。 在这三种研究中,视觉形象的印象是相同的。噪声大,出现边缘变暗伪影。 由于发病时间至应用新术前或EST后梗死检测缺乏有用的数值,这一时间只能通过水在梗死区内积聚的假设来确定。梗死可检测性的限制,即颅骨旁或颅底附近,需要进一步研究。其他的影像内核应用,或对管电压参数的设置,需要有一个统一的标准。
本研究中9%的患者有梗死的出血转化,与其他研究相似[13-15]。根据目前的指南,患者开始给予40mg依诺肝素,2次/d,并给予负荷量的阿司匹林,但是,对于新发或是IH增长患者应当停止或减量。
综上,本研究应用DECT EM图即改良VNC图,在EST后早期检测梗死是很可靠的。溶栓和EST后尽早抗凝是很必要的, 但需要重视脑出血的风险。

