卡托普利通过下调α-平滑肌肌动蛋白、波形蛋白、人单丝氨酸蛋白激酶抑制心肌纤维化
宋晶 刘爱东 郭家娟 高楠 李鹏飞
(1长春中医药大学,吉林 长春 130117;长春中医药大学 2附属第三临床医院;3附属医院)
心肌纤维化是很多心血管疾病发展终末期心脏的病理改变,如冠状动脉慢性缺血,或血管狭窄、堵塞导致的急性心肌缺血;或是扩张型心肌病、肥厚型心肌病;或者是非血管因素导致高血压性心肌病及炎症性心肌病等。心肌发生纤维化改变时,α-平滑肌肌动蛋白(SMA)、波形蛋白(Vimentin)为肌成纤维细胞骨架中主要标志蛋白,目前认为α-SMA是肌成纤维细胞的主要标志,Vimentin是上皮细胞向肌成纤维转化过程中的产物。目前研究中心肌纤维化有多种信号通路,其中转化生长因子(TGF)-β信号通路是最为广泛、常见的信号通路,而人单丝氨酸蛋白激酶(LIMK)是TGF-β信号通路中下游的相关因子,且多数用于研究肿瘤细胞的发生机制〔1~4〕,近年来发现LIMK的表达亦参与心肌纤维化过程。血管紧张素转化酶抑制剂(ACEI)类药物可有效抑制心肌重构,减轻心肌纤维化。研究卡托普利抑制心肌纤维化的机制有助于对其病理生理有更进一步的了解,从而对其临床治疗与新药开发有指导意义。
1 材料与方法
1.1实验动物 健康雄性SPF级SD大鼠30只(长春市亿斯实验动物技术有限公司),体重(180±10)g,动物合格编号:SCXK(吉)-2018-0007。
1.2实验药物 卡托普利片由杭州民生药业有限公司提供(批号:T15H048),盐酸异丙肾上腺素由Sigma-adrich公司提供(批号:1351005)。
1.3实验试剂 RNA提取试剂盒(全式金生物技术有限公司),基因引物(吉玛基因-九牧农校),α-SMA抗体和Vimentin抗体(爱博泰克生物技术有限公司)。LIMK抗体(ab-clon)、预制胶(碧云天生物技术公司)。胎牛血清(Cellmax)。
1.4实验器材 聚合酶链反应(PCR)仪器(AnalytikJena);离心机为长沙湘智离心机仪器有限公司;移液管和培养皿(Corning)。
1.5造模与含药血清的制备 分为对照组、模型组、卡托普利组各10只。大鼠常规饲养7 d适应环境后,此过程无死亡,对照组常规喂养,模型组、卡托普利组给予异丙肾上腺素注射液5 mg/kg腹腔注射。造模当天,卡托普利组每日按5 mg/kg灌胃卡托普利片悬液;对照组每日给予等体积自来水灌胃,共连续进行3 d后将各组麻醉取心尖部,放入4%多聚甲醛固定液,眼球摘除收集血清在离心管中,-20℃冰箱保存。
1.6苏木素-伊红(HE)染色法观察大鼠心肌组织变化 心肌组织取中间1/3置于4%甲醛固定液试管中固定,梯度酒精溶液脱水,二甲苯溶液中透明后,进行浸蜡与包埋,最后将蜡块切片、烘箱内烤片。HE染色:将切片脱蜡,水洗,苏木精染色3~5 min,普通清水水洗,分化液分化,水洗,伊红染色液中染色,酒精脱水(酒精浓度递减),二甲苯溶液脱水透明,封片,显微镜下观察。
1.7羟脯氨酸含量测定 取心肌组织心尖部位,盐水洗涤后剪碎,沸水水浴水解,按照说明书加入试剂后离心,根据试剂盒使用说明书测定。
1.8细胞培养 将大鼠来源的心肌成纤维细胞用10%高糖血清培养液,加1%双抗,37℃、二氧化碳浓度为5%的培养箱培养,根据细胞生长状况,2~3 d换液,待细胞长至80%左右时,胰蛋白酶(浓度为0.25%)消化2~4 min,待细胞变圆后,用移液枪吹打至悬浮状态后,移至移液管中,12 000 r/min,5 min离心机离心。加入有血清培养液,反复吹打至细胞均匀,分组依次为对照组、模型组、卡托普利组。24 h后细胞贴壁,换液并加入无血清培养液2 ml(细胞饥饿),24 h后,弃废液,每组加入2 ml对应的血清,24 h后收集细胞。
1.9荧光定量PCR 每孔细胞弃废液后用冷却的磷酸盐缓冲液(PBS)洗3次,加入1 ml裂解液,反复吹打,按照RNA提取试剂盒说明书操作提取RNA,按照逆转录试剂盒操作对cDNA进行合成,将cDNA当做模板,借助荧光定量 PCR 仪实施测定,以GAPDH作内参,计算出各组细胞中α-SMA、Vimentin、LIMK的相对表达量。相关基因引物序列如下:α-SMA-正向-3 TCT TGA CCT GGC TGG ACG,反向-3 TCTC CTT GAT GTC TCG CAC A;Vim-正向-3 CCG CTT CGC CAA CTA CAT,反向-3 GCT GAT CCA CCT GCC G;LIMK-正向-2 TCC CTC CGA GTG GTT TGT C,反向-2 GAA GTT CAG CCG CTT GTC C。
1.10Western印迹法 蛋白裂解液按照放射免疫沉淀(RIPA):苯甲磺酰氟(PMSF)=100∶1配制,每孔细胞弃废液后用冷却的PBS洗3次,每孔加入150~200 μl裂解液,用细胞刮刀将细胞及细胞试剂刮下,收集到离心管中,并标记分组。离心机12 000 r/min、15 min离心,收集上清液即为提取的蛋白。二喹啉甲酸(BCA)法测定蛋白浓度。蛋白变性后上样。电泳:130 V电压、50 min。转膜:按照分子量大小,低温,200 mA转膜15~60 min;封闭:5%脱脂奶粉封闭1 h;加一抗:脱脂奶粉用Tween-20 Tris盐酸缓冲液(TBST)洗3遍,加入一抗(1∶500),4℃冰箱过夜。第二天一抗室温摇床1 h,收集一抗,TBST洗一抗3遍。加二抗:根据一抗来源属性加入相应的二抗。洗膜:TBST洗二抗洗3遍。显影:将电化学增强(ECL)曝光液滴于膜上,由凝胶成像系统进行曝光处理。 借助软件Image-J来分析各抗体条带灰度值。
1.11统计学分析 采用SPSS26.0软件进行t检验。
2 结 果
2.1HE染色 与对照组比较,模型组与卡托普利组细胞排列紊乱,细胞变大,细胞核分布不均匀,出现坏死灶。与模型组比较,卡托普利组心肌细胞坏死面积较小。见图1。说明异丙肾上腺素注射液5 mg/kg腹腔注射大鼠后,大鼠心肌出现纤维化改变,纤维组织增多。卡托普利组与模型组比较,出现心肌纤维化改善,说明卡托普利可以抑制心肌重构,改善心肌纤维化。
2.2心肌组织中羟脯氨酸含量 与对照组〔(0.168±0.024)μg/mg〕比较,模型组羟脯氨酸含量〔(0.228±0.011)μg/mg〕明显增加(P<0.05);与模型组比较,卡托普利组羟脯胺酸含量〔(0.180±0.015)μg/mg〕明显减少(P<0.05)。
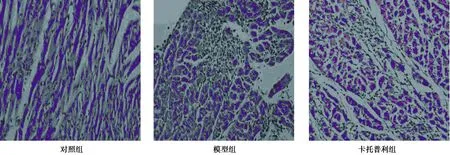
图1 各组心肌组织(HE染色,×200)
2.3荧光定量PCR检测α-SMA、Vim、LIMK mRNA相对表达量 与对照组比较,模型组、卡托普利组α-SMA、Vim、LIMK mRNA相对表达量均明显增加(P<0.05);与模型组比较,卡托普利组α-SMA、Vim、LIMK mRNA相对表达量均明显减少(P<0.05)。见表1。
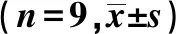
表1 各组成纤维细胞中α-SMA、Vim、LIMK mRNA表达
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05;表2同
2.4各组成纤维细胞中α-SMA、Vim、LIMK蛋白相对表达量 与对照组比较,模型组卡托普利组α-SMA、Vim蛋白及模型组LIMI蛋白相对表达量均明显增加(P<0.05);与模型组比较,卡托普利组α-SMA、Vim、LIMK蛋白相对表达量均明显减少(P<0.05)。见图2和表2。
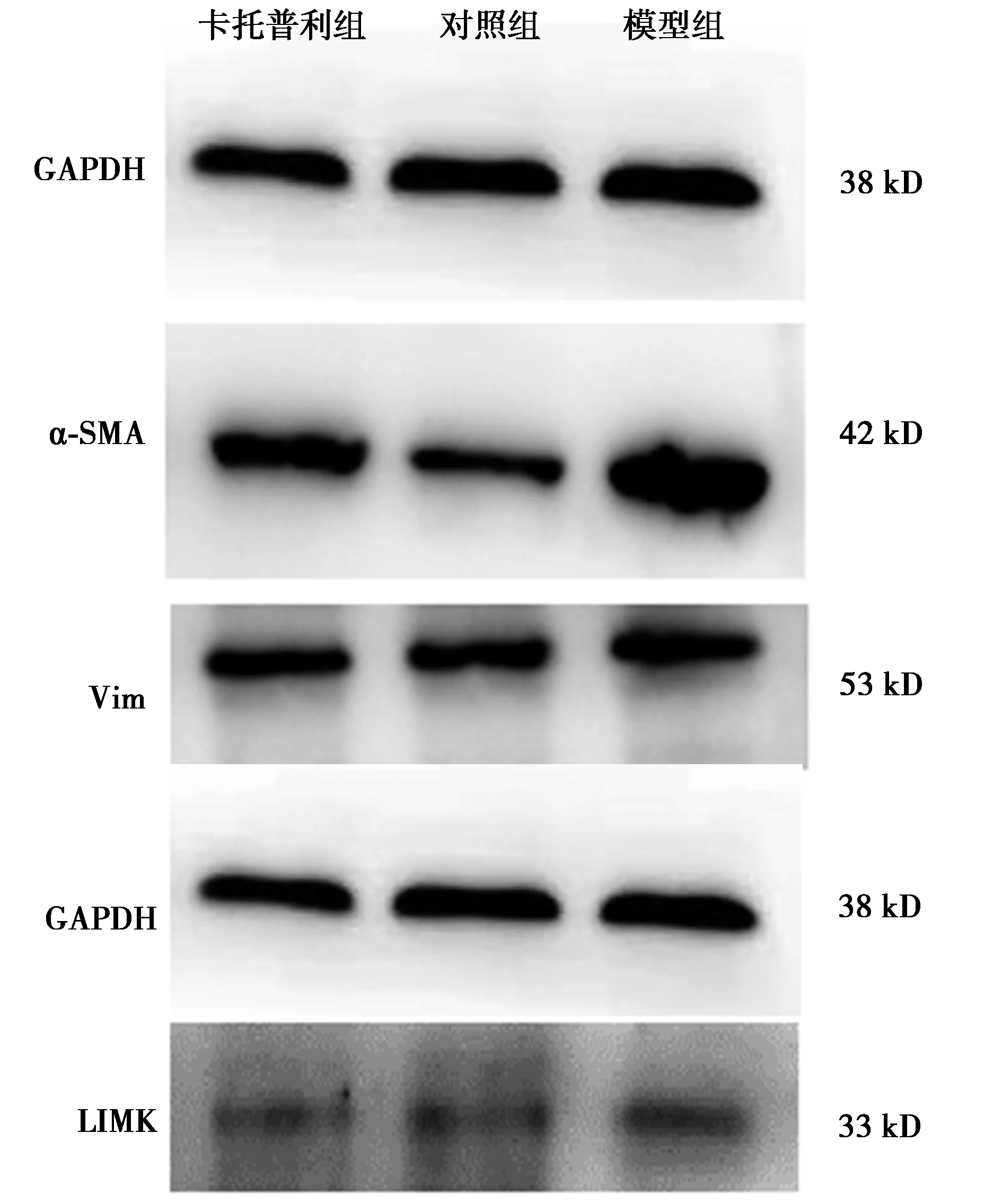
图2 各组成纤维细胞中α-SMA、Vim、LIMK蛋白表达
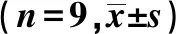
表2 各组成纤维细胞中α-SMA、Vim、LIMK蛋白相对表达
3 讨 论
心肌纤维化过程是复杂而多样的,各种原因均可导致纤维化,如炎症反应、血管内皮功能障碍、氧化应激、肾素-血管紧张素-醛固酮系统(RAAS)、TGF的激活等。研究〔5,6〕表明通过调控TGF相关蛋白表达可以降低心肌纤维化的发生。在纤维化分子生物学中,上皮细胞向间充质细胞的转分化(EMT)发挥重要作用,而发生间质纤维化的间质细胞表达肌成纤维细胞标志性蛋白为α-SMA和Vim〔7,8〕。α-SMA存在于人类小鼠(小家鼠)和其他哺乳动物的横纹肌中,包括骨骼和心脏及平滑肌中〔9〕。当某些因素如损伤、TGF作用下,使成纤维细胞激活,进而表达α-SMA,形成Vim细胞骨架,使其向肌成纤维细胞分化。同时细胞外基质成分的合成分泌及细胞增殖能力均显著增强,参与组织损伤修复〔10,11〕、纤维化疾病过程〔12〕。Vim蛋白是EMT过程中间充质细胞的标志物,通过使上皮细胞失去极性、减弱黏附力、增加运动能力等,从而破坏细胞的紧密连接结构,改变细胞骨架的结构,促进细胞纤维化〔13〕。卡托普利可能通过下调α-SMA及Vim蛋白的相对表达量,抑制EMT,从而达到抑制心肌纤维化的目的。肌成纤维细胞是从TGF-β中的内皮细胞中衍生而来的〔14〕,LIMK是TGF信号通路下游的一个相关蛋白,Mardilovich 等〔15〕研究发现,LIMK 抑制剂可以降低细胞中磷酸化丝切蛋白(Cofilin)蛋白表达水平,同时也可以促进肿瘤细胞的凋亡。TGF-β/LIMK信号通路虽然被证实与纤维化有关,但目前关于心肌纤维化的研究较少。LIMK1是一种丝氨酸/苏氨酸蛋白激酶,磷酸化并灭活Cofilin〔16〕,Cofilin与细胞内肌动蛋白骨架重组关系密切〔17〕,卡托普利在干预大鼠心肌成纤维细胞时,通过下调TGF-β信号通路中的LIMK蛋白,并且可能进一步磷酸化并灭活Cofilin而抑制细胞内肌动蛋白骨架重组,进一步达到抑制心肌纤维化作用。当心肌发生纤维化改变时,由于Ⅰ型及Ⅲ型胶原蛋白大量沉积,且两种蛋白具有一定黏附性,一般的酸性或碱性环境均很难测定出其含量,而羟脯氨酸是胶原蛋白含量最高的氨基酸,由于通过羟脯氨酸含量检测可以大致计算出胶原蛋白含量,反映胶原蛋白沉积程度,所以将其用于心肌纤维化的衡量标准。当用盐酸异丙肾上腺素制备大鼠心肌纤维化模型时,羟脯胺酸含量增高,说明胶原蛋白沉积加重,心肌纤维化形成。说明卡托普利抑制了胶原蛋白的形成。本实验中卡托普利是ACEI类药物,可以抑制血管紧张素Ⅰ向血管紧张素Ⅱ转化,当体内血管紧张素Ⅱ浓度升高时,则可引起氧化应激反应〔18〕,过度的氧化应激反应可以导致炎症发生,促进细胞凋亡,引起组织不同程度损伤,甚至坏死〔19〕。氧化应激水平的升高可以产生胶原纤维、促纤维化细胞因子、生长因子等,进而促进纤维化的发生〔20〕。而用盐酸异丙肾上腺素制备大鼠心肌纤维化模型时,同样使大鼠发生氧化应激反应,卡托普利在降低血管紧张素Ⅱ浓度、抑制氧化应激反应的同时,LIMK及α-SMA、Vim蛋白含量下降,而LIMK、α-SMA是 TGF-β信号通路上的重要相关蛋白,说明TGF-β/LIMK信号通路参与改善心肌纤维化作用,并且当LIMK、α-SMA蛋白下调时,可以抑制或逆转心肌纤维化,这为以后治疗心肌纤维化找到新靶点,提供新思路。心肌纤维化发病机制有多种,TGF-β信号通路是心肌纤维化机制中的一个重要通路,在这条信号通路上游,还有丝氨酸/苏氨酸激酶(ROCK)/小G蛋白超家族的亚家族成员之一(ROHA)等相关因子,在下游仍有胶原蛋白及Cofilin相关蛋白,可以进行进一步相关研究。本研究可明确卡托普利抑制心肌纤维化的机制为下调LIMK及α-SMA、Vim因子,同时证实了TGF-β/LIMK信号通路参与了心肌纤维化的抑制作用。

