右半结肠毗邻层面的应用解剖学观察及其临床意义
王旭 苏军龙 马延生 王奔 刘力强 刘瑞廷 邱健
手术是非转移性右半结肠癌的主要治疗手段,目前国际上针对右半结肠癌的手术理念有两种:(1)日本结直肠癌学会(Japanese Society for Cancer of the Colon and Rectum,JSCCR)对术前或术中怀疑淋巴结转移,肿瘤浸润达到或超过固有肌层者,为提高转移淋巴结清除率、防止局部复发所推荐的D3根治术[1]。其清扫范围包括肠旁组、中间组和中央组淋巴结[2],以及为实现手术操作规范,按照胚胎发育理念指导下的膜解剖理念[3]。(2)德国Hohenberger教授[4]提出的“全结肠系膜切除术”(complete mesocolic excision,CME)的理念。CME包括两个原则:①强调沿着结肠胚胎发育过程中形成的疏松无血管间隙进行解剖,将“信封样”的结肠系膜及引流淋巴管彻底切除;②高位结扎(central vascular ligation,CVL)相应的结肠主支血管。CME与D3根治术貌似强调的手术要点不同,其实两者实属异曲同工[3]。龚建平教授团队[5]更将D3与CME理论的要点有机结合,提出右半结肠D3+CME膜解剖手术理念,强调在遵循胚胎发育形成的结肠周围间隙游离,保证结肠系膜筋膜的完整,于肠系膜上动脉的起始部结扎并切断右半结肠的供血血管,清扫右半结肠系膜根部的第3站淋巴结。当前结肠癌手术已进入腹腔镜时代,在D3+CME膜解剖手术理念指导下,借由腹腔镜所提供的拉近、放大的清晰画面,外科医生追求更为精细、准确、无血的层面解剖。但是,限于手术范围所及,对右半结肠毗邻的层面结构,不能给术者形成清晰、全面的感性认识。例如手术入路、原始后腹膜存在与否,Toldt′s融合筋膜的构成、胰头十二指肠前后间隙、大网膜的右侧边界以及大网膜第3层、第4层与胰体、横结肠系膜的关系等概念,仍有混淆欠清之处。本研究通过对尸体右半结肠周围的层面解剖观察,详尽描述右半结肠毗邻的层面关系,澄清以上的概念,为精准右半结肠根治性膜解剖手术提供应用解剖学依据。
材料与方法
一、材料
福尔马林固定尸体5具,男性4具,女性1具,其中1具为完整躯干,3具来自西安医学院解剖教研室,2具来自西安交通大学基础医学部解剖教研室。解剖器械1套,摄录器材1部。尸体均无腹部严重疾患,无腹部手术史。
二、解剖方法
1. 确认盲肠与侧腹膜愈着线,于该愈着线偏结肠侧0.5 cm切开脏层腹膜,可见盲肠及其系膜后方疏松结缔组织,进入该疏松结缔组织内分离,向头侧游离升结肠及其系膜(见图1,2)。

图1 沿红色箭头切开盲肠与侧腹膜愈着线

图2 将升结肠及其系膜沿红色箭头翻向内侧,可见腹后壁光滑致密的膜性结构
向左沿小肠系膜与后腹膜愈着线偏小肠系膜侧0.5 cm切开脏层腹膜,在小肠系膜后方可见疏松结缔组织,在疏松间隙内向头侧游离,直至十二指肠尾侧。
在十二指肠背侧疏松结缔组织内游离胰头十二指肠,探寻后腹膜层面的延伸与延续。
2.自侧腹壁切开处从后腹壁剥离后腹膜,游离右侧后腹膜层面,并向对侧翻起,观察后腹膜后方的层面结构形态与起止延续。
3.向右侧切开十二指肠降段与结肠肝区愈着之脏层腹膜,在胰头十二指肠与结肠肝区之间的疏松间隙游离,与升结肠后方Toldt′s融合筋膜间隙贯通(见图3)。观察此间隙内结构。

图3 沿红色箭头切开胰头十二指肠与结肠肝区之间的疏松间隙
4. 继续沿胰头十二指肠前疏松间隙向头侧拓展,将大网膜与结肠肝曲愈着缘切开,可见大网膜与横结肠系膜固有筋膜之间为疏松结缔组织间隙,进入该间隙并沿该间隙拓展平面(见图4)。
5.继续向左侧在疏松间隙内游离至结肠脾区,在胰腺下缘观察大网膜、横结肠系膜、胰腺以及后腹膜之间的层面关系。

图4 切开大网膜与横结肠系膜筋膜之间疏松结缔组织间隙
结 果
一、解剖发现
根据右半结肠及其系膜与周围毗邻层面的关系,可将右半结肠划分为3个融合筋膜区域:①右Toldt′s融合筋膜区,包括盲肠、升结肠及其系膜;②胰头十二指肠融合筋膜区,即结肠肝曲;③大网膜-横结肠融合筋膜区,即横结肠区域。以下按照该区域划分分述右半结肠毗邻之层面关系。
二、右Toldt′s融合筋膜区
头侧界为十二指肠环下缘,内侧界为肠系膜上动脉右缘,右侧与尾侧边界为回盲部、升结肠与后腹膜的愈着缘。在右Toldt′s融合筋膜区背侧依次存在后腹膜延续层面(原始后腹膜)和泌尿生殖层2个层面,各层面之间形成了右Toldt′s融合筋膜间隙、肾前间隙和肾后间隙等3个间隙。
(一)后腹膜延续层面(原始后腹膜)
沿盲肠、升结肠与后腹膜愈着线偏结肠侧切开脏层腹膜,进入疏松结缔组织间隙,沿此间隙拓展,可将盲肠、升结肠及其系膜游离,其背侧为后腹膜延续之单层膜样结构(见图5),向头侧延伸至十二指肠环下缘,向左侧拓展该间隙,可将全部小肠及其系膜自腹后壁游离,沿该后腹膜层面向左拓展,其与左半结肠系膜的脏层腹膜相延续。

图5 右半结肠后方完整的后腹膜呈单层膜样结构
追循该后腹膜层面,见该层面延伸至胰头十二指肠背侧,向头侧延续,覆盖于肾周脂肪与下腔静脉浅面,与肝周及膈下腹膜相延续。
(二)泌尿生殖层[6]
于后腹壁完整剥离上述后腹膜层面,并向左侧翻起,可见其下为肾周筋膜包被右侧肾上腺、肾脏以及肾周脂肪,向尾侧包被输尿管、生殖血管下行构成一完整层面,我们称之为泌尿生殖层,其表面的固有筋膜为泌尿生殖筋膜(见图6)。该层面向尾侧延续,大部进入盆腔,构成泌尿生殖层盆部,男性一部包含生殖血管、输精管穿出内环构成精索部,女性一部包含子宫圆韧带穿出内环。泌尿生殖层背侧为腰肌筋膜-腹横筋膜,泌尿生殖层外侧缘借侧锥筋膜附着于腹横筋膜。泌尿生殖层前方与后腹膜之间为肾前间隙,泌尿生殖层后方与腰肌筋膜-腹横筋膜之间为肾后间隙。

图6 位于腹膜后的泌尿生殖层
三、胰头十二指肠融合筋膜区
切开十二指肠降段与结肠肝曲之间的脏层腹膜,可进入结肠肝曲及其系膜与胰头十二指肠之间疏松的融合筋膜间隙。其头侧界为胃大网膜在十二脂肠球部附着处,尾侧界为十二指肠环下缘,外侧界为十二指肠环外侧缘,内侧界为大网膜的右缘(其内标志为胃网膜右静脉)。右Toldt′s融合筋膜间隙向头侧延续,被胰头十二指肠层面分隔,形成胰头十二指肠前间隙与胰头十二指肠后间隙。胰头十二指肠融合筋膜区背侧依次为胰头十二指肠、后腹膜延续层面(原始后腹膜)和泌尿生殖层3个层面,依次形成了胰头十二指肠前间隙、胰头十二指肠后间隙、肾前间隙、肾后间隙等4个融合筋膜间隙。在胰头十二指肠前间隙内向左侧拓展,可见大网膜右缘,其内为幽门下静脉-胃网膜右静脉-Henle干连线,越过此缘,该间隙与大网膜-横结肠融合筋膜间隙相贯通。在胰头十二指肠前间隙内,胰头十二指肠前上静脉起自胰头,跨越胰头十二指肠前间隙,汇入肠系膜平面的Henle干(见图7)。
四、大网膜-横结肠系膜融合区
沿胰头十二指肠前间隙向左侧拓展,越过大网膜右缘,将大网膜与横结肠愈着缘切开,可见大网膜与横结肠系膜前叶之间为疏松结缔组织间隙,进入该间隙并沿该间隙向左侧及背侧拓展。越过结肠中血管,沿横结肠系膜边缘血管弓分离大网膜后,可见横结肠系膜无血管区与大网膜第4层紧密融合难以分离,离断该区域大网膜第4层,进入大网膜第3层与第4层之间,可见大网膜第3层覆盖于胰体部浅面,大网膜第4层在胰腺下缘水平与横结肠系膜分离,自背侧包被胰腺体部,向头侧延续(见图8),大网膜3、4层之间形成胰周间隙。横结肠系膜前叶与左侧后腹膜相延续,在胰腺下缘,与大网膜第4层之间构成胰后间隙,横结肠系膜后叶与腹主动脉前方之后腹膜相延续,横结肠系膜前叶、后叶在胰腺下缘缺乏脂肪填充、融合紧密,难以分离。

图7 此图中Henle干由胰头十二指肠前上静脉、上右结肠静脉和胃网膜右静脉构成

图8 第3层覆盖于胰体部浅面,大网膜第4层在胰腺下缘水平与横结肠系膜分离,自背侧包被胰腺体部,向头侧延续
大网膜第4层无血管区与横结肠系膜无血管区的紧密融合,在横结肠系膜左结肠血管分支处逐渐出现疏松间隙,继续向左游离,可见大网膜第4层包绕胰尾与脾脏,与结肠脾区分离(见图9)。

图9 沿着横结肠系膜左结肠血管分支处疏松间隙游离。在胰腺下缘大网膜第4层与横结肠系膜分离
讨 论
一、从胚胎发育来看右半结肠周围层面关系
原肠形成时头褶部分的原肠称为前肠,尾褶部分的原肠称为后肠,其间与卵黄囊相通部分为中肠,动脉支配分别为:前肠器官为腹腔干,中肠器官为肠系膜上动脉,后肠器官为肠系膜下动脉。解剖学的分界为:前-中肠分界为十二指肠乳头,中-后肠分界为结肠脾区。前、中肠的旋转、转位、贴附、固有筋膜相互融合形成了右半结肠周围复杂的层面毗邻关系。
二、胃的旋转及大网膜的形成
前肠器官有背侧系膜与腹侧系膜,背侧胰腺与脾发自背侧系膜内,肝脏、胆囊、胆总管、腹侧胰腺发自腹侧系膜内。胃大弯侧的快速生长与腹侧系膜内肝脏的发育,使胃沿胚体纵轴逆时针旋转90°(从尾侧角度看),十二指肠转向右侧,贴附在右侧腹后壁的原始后腹膜,形成十二指肠后的融合筋膜;而胃的背侧系膜转向左侧及尾侧膨胀形成网膜囊,其背侧贴附于横结肠系膜,形成“大网膜-横结肠融合筋膜区”。
发自十二指肠背侧系膜内的背侧胰腺向左上发展,伸入胃背侧系膜(大网膜)发育成胰体尾部。十二指肠腹侧系膜内的腹侧胰腺向后绕至背侧胰腺后方并与之融合,形成胰腺钩突。所以,胃大网膜只包被胰体尾部,结肠肝曲与没有大网膜包被的胰头十二指肠区贴附,形成了“胰头十二指肠融合筋膜区” (见图10)。
三、中肠的胚胎发育[7]
中肠形成以肠系膜上动脉为轴的初级肠袢,突入脐部的胚外体腔称为“生理性脐疝”。前肠逆时针的旋转,使中肠袢逆时针旋转90°,头段转向胚体右侧,尾段转向左侧。胚胎第10周,由于腹腔增大,中肠袢由脐腔返回腹腔,空肠和回肠等头段先行返回腹腔中部,其系膜与腹后壁原始后腹膜发生融合;右半结肠后行返回,此时中肠袢再逆时针旋转180°,头段转向胚体左侧,尾段转向右侧。随着结肠延长,盲肠和阑尾转位延伸至髂窝。盲肠、升结肠及其背侧系膜与腹后壁原始后腹膜发生融合,成为 “右Toldt′s融合筋膜”。

图10 胰头十二指肠融合筋膜区(包绕胰腺体尾部的大网膜在此处缺如)。(Right Gastroepiploic Vein,RGEV):胃网膜右静脉;MCV(Middle Colonic Vein,MCV):结肠中静脉
四、右半结肠不同融合筋膜区域的临床意义
(一)右Toldt′s融合筋膜区域的手术入路
回盲部、升结肠及其系膜筋膜背侧叶与原始后腹膜形成右侧Toldt′s融合筋膜。在右半结肠Toldt′s融合筋膜区背侧依次存在①后腹膜延续层面(原始后腹膜);②泌尿生殖层两个层面,形成了右Toldt′s融合筋膜间隙、肾前间隙和肾后间隙等三个间隙。其空间关系见以下模式图(图11)。
右半结肠系膜因脏腹膜下脂肪多呈黄色,后腹膜后的脂肪少且发白[8],所以右半结肠与后腹膜愈着线呈黄白交界线,又称 Monk′s White Line。在该线靠近结肠侧(黄色侧)切开即进入Toldt′s融合筋膜间隙,即右半结肠固有筋膜与后腹膜延续层面之间,即经典“尾侧入路”[9]。沿此间隙向头侧拓展,可至十二指肠环下缘,在十二指肠前方游离,进入胰头十二指肠前间隙,在十二指肠后方沿后腹膜游离,则进入胰头十二指肠后间隙(Treitz间隙)[10](见图 12)。
如果在Monk′s White Line后腹膜侧(白色侧)切开,将进入后腹膜与泌尿生殖筋膜脏层(肾前筋膜)之间的肾前间隙,沿此间隙向头侧游离,将在后腹膜层面之后将胰头十二指肠一同游离。既往开放手术要求距肿瘤数厘米[11]的后腹膜切开,这样一般会进入肾前间隙,将胰头十二指肠一同翻起,往往需要再切开后腹膜后显露十二指肠,以避免损伤;因为肾以下的泌尿生殖层逐渐变窄,如果在肾平面以下切开后腹膜,可能进入泌尿生殖层后方,向内侧游离可将输尿管、生殖血管游离至结肠侧,向头侧拓展甚至可将肾游离向前方。
内侧中间入路切开回结肠系膜后,其背侧的疏松组织间隙就是右Toldt′s融合筋膜间隙,由此向头侧拓展进入胰头十二指肠前间隙,有回结肠系膜做参照,一般不易进入错误间隙。
(二)右Toldt′s融合筋膜区域的手术层面
对于右Toldt′s融合筋膜区的结肠肿瘤,如果T1/T2期肿瘤,未侵透结肠肠壁,局限于结肠及其系膜内,可在Toldt′s融合间隙内游离。优点为层面清晰,易于拓展,十二指肠位于层面内,不易损伤[12]。
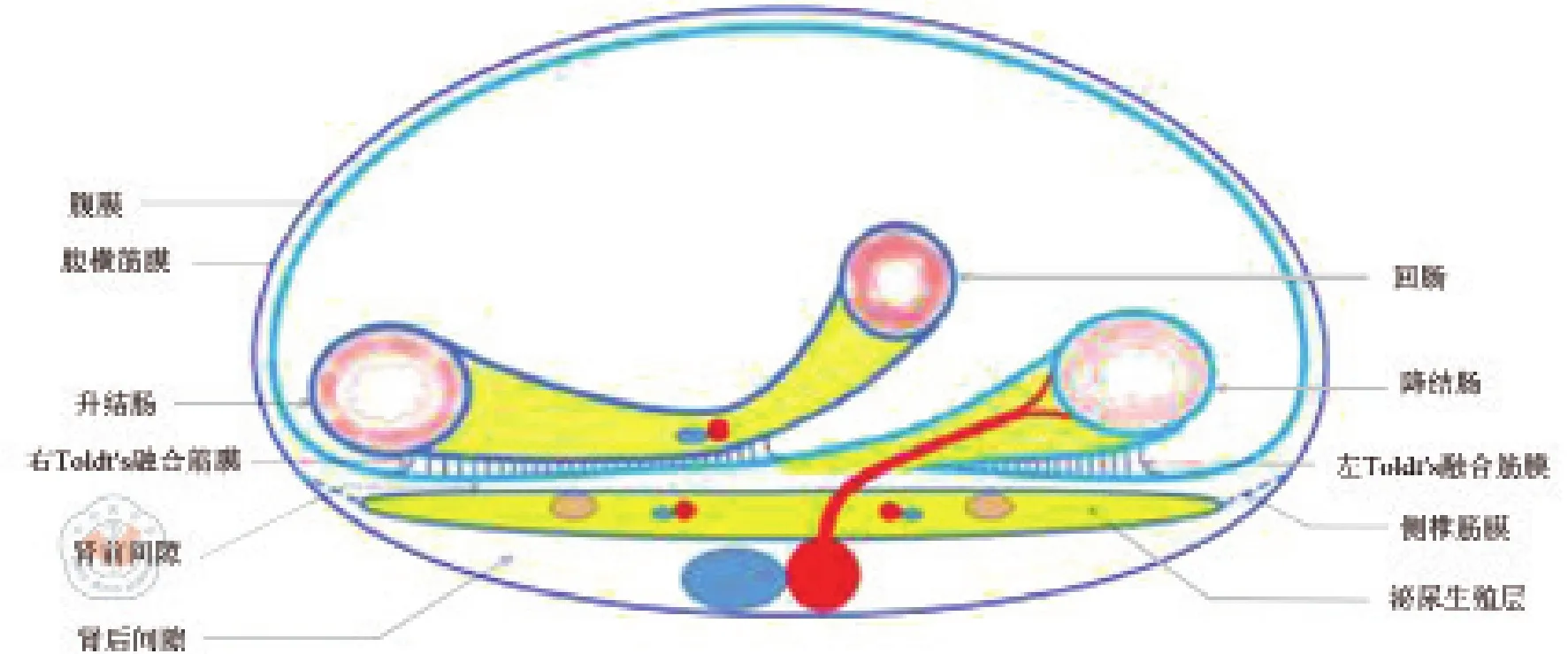
图11 肠系膜下动脉平面层面、融合筋膜与筋膜间隙模式图

图12 红色区域代表十二指肠;蓝色区域代表右半结肠后方腹膜与黄色区域的十二指肠后方腹膜延续
如果为T3、T4肿瘤,可在Monk′s White Line外侧切开后腹膜,进入后腹膜与肾前筋膜(Gerota筋膜)之间,后腹膜层面是抵御结肠癌侵犯的一层筋膜屏障[13]。在此疏松间隙向头侧游离,可将胰头十二指肠游离至腹侧。需仔细辨认十二指肠并在十二脂肠下缘离断后腹膜,然后再进入胰头十二指肠前间隙。如果T4肿瘤侵犯后腹膜、肾周脂肪,可深入泌尿生殖层内,切除部分肾周脂肪后,在十二指肠下缘依次切开肾周脂肪、后腹膜,再返回Toldt′s融合筋膜层面。
回盲部、升结肠癌理论上不应采取经典尾侧入路,避免术中操作挤压、翻动肿瘤,而应采取内侧中间入路,首先高位结扎回结肠血管等供血、回流血管,然后再根据不同的侵犯深度而切除相应的结肠后层次。
(三)胰头十二指肠融合筋膜区的手术安全策略
胰头十二指肠融合筋膜区是结肠肝曲与胰头十二指肠直接贴附形成的,T4结肠肝曲的肿瘤可直接侵犯胰头十二指肠,需要术前影像的安全评估。该区域也是结肠系膜、胰头十二指肠系膜以及胃背侧系膜(大网膜)相互贴附融合区域、是三处系膜回流静脉的交汇处,其中上右结肠静脉(superior right colonic vein,SRCV)回流入同层面的SMV,胰十二指肠前上静脉(anterior superior pancreatoduodenal vein,ASPDV)横跨胰头十二指肠前间隙,汇入SMV,RGEV跨越该间隙的右缘汇入SMV,在汇入SMV之前,三个不同系膜的回流静脉在胰头十二指肠前间隙形成变异复杂的共干Henle干,是手术中容易损伤出血的危险区域,是右半结肠根治性切除术的要点与难点所在。困难主要表现在:(1)如何在层面拓展时定位3个系膜回流静脉,(2)如何安全地处理Henle干及其分支。
尾侧入路或内侧中间入路在Toldt′s融合筋膜间隙向头侧游离,越过十二指肠进入胰头十二指肠前间隙,在此疏松间隙内首先遭遇的是横跨该间隙的ASPDV,该血管出现率84.5%,较为恒定[14],发现ASPDV,即可定位Henle干在其左侧流出段,与中间入路相结合,可以估计Henle干汇入SMV的部位,减少盲目分离带来的意外出血。同时,发现ASPDV后,胰头十二指肠前间隙向头侧游离即结束,未游离SRCV与RGEV之前,避免该狭小空间的血管损伤出血。
发现ASPDV定位Henle干后,内侧中间入路沿SMA、SMV上行,依次处理回结肠血管、右结肠血管至Henle干下方,此时不急于处理Henle干及其分支。宜先沿SMA解剖处理定位更明确的结肠中动脉(middle colonic artery,MCA)或其右支,继而沿SMV处理伴行的MCV后,切开横结肠系膜根部以及菲薄的大网膜第4层,即可显露胰腺颈部,沿胰颈下缘向胰腺钩突部游离,可见大网膜右缘以及位于其内的RGEV,从而顺其游离确定Henle干上缘,自此,Henle干及其分支血管完全确定,可以得到稳妥的处理。
(四)大网膜-横结肠系膜融合区的外科层面
大网膜来自胃的背侧系膜,具有左、右两叶系膜筋膜,随胃的旋转大网膜转向左侧,像帆一样膨胀形成网膜囊,原来的两叶结构形成由腹侧到背侧的4层结构,即胃背侧系膜左叶在外,形成大网膜第1层并反转形成第4层,胃背侧系膜右叶在内,形成大网膜第2层并反转形成第3层。第1层与第2层之间有胃网膜血管弓,自胃大弯侧至横结肠附着缘形成胃结肠韧带;第2层与第3层之间为网膜囊。胰腺体尾部、脾在胃背侧系膜内发育,所以在胰头前可观察到从幽门下延伸到胰颈部下缘的大网膜右缘,其内的标志为幽门下静脉-RGEV-Henle干,胰腺体尾部、脾脏包被于大网膜第3层与第4层之间,形成胰周间隙。大网膜第4层在胰体尾与脾脏后方与原始后腹膜形成Toldt′s融合筋膜,该融合筋膜间隙为胰后间隙。
1.头侧入路:劈开大网膜游离缘,在横结肠附着处切开大网膜第1层与第2层,进入网膜囊,即右半结肠头侧入路首先进入的外科层面[15]。然后根据肿瘤的位置与侵润深度选择胃网膜弓内或胃网膜弓外切除大网膜胃结肠韧带,沿RGEV解剖至胰颈前的大网膜右缘,显露RGEV。在胰腺下缘切开大网膜第3层与第4层,解剖SMV,根据RGEV确认Henle干上缘。可根据肿瘤的位置与侵润深度,保留胃网膜右血管清扫6v组淋巴结或切除胃网膜右血管彻底清扫6组淋巴结。一般到此告一段落,很少选择完全头侧入路向尾侧解剖处理SMV、SMA分支如MCV、MCA分支。联合尾侧入路,确定ASPDV、SRCV以及Henle干下缘后再安全处理胰头十二指肠区域。这种手术方式称为联合入路。
2.横结肠系膜穿越:由内侧中间入路上行,由于结肠中血管位置相对固定且变异率低[14],自根部游离切断MCA、MCV,切开横结肠系膜根部、切开胰腺下方的大网膜第4层,可发现胰腺表面(胰周间隙),沿胰腺向右游离,发现RGEV,沿此完成对Henle干的解剖处理。这样可类似经典头侧入路安全地处理胰头十二指肠前间隙的Henle干及其属支,由此大网膜-横结肠系膜融合区的处理会变得简单快捷,从而避免了联合入路的腹腔镜下的场景转换,可以流畅、高效、安全地完成右半结肠根治性切除术,类似于内侧中间入路的回结肠系膜穿越,我们称这一操作为“横结肠系膜穿越”或“微头侧入路”。
五、总结
胚胎发育过程中,前肠、中肠的旋转过程造就了右半结肠的复杂层面关系。在胚胎发育基础上,应用解剖学揭示了右半结肠毗邻层面关系,基于右Toldt′s融合筋膜区、胰头十二指肠融合筋膜区、大网膜-横结肠融合筋膜区这3个不同区域,熟悉这些层面关系以及层面之间的融合筋膜间隙,有助于安全、精准和高效的进行右半结肠根治性膜解剖手术。

