分子印迹光子晶体阵列传感器的构建及其对双酚A和双氰胺的检测
张 鑫 李彦松 韩 睿 蒋艳艳 刘哲涵
1(南阳师范学院,生命与科学技术学院,南阳473061)2(北京理工大学,生命学院,北京100081)
1 引 言
双酚A(Bisphonel A,BPA)作为一种化工原料,广泛用于聚碳酸酯塑料和环氧树脂的制造生产,也常用于食品、饮料、塑料奶瓶等生活消费品的包装内衬[1,2]。研究表明,BPA是一种环境雌激素,食品、饮料容器中的微量BPA会通过降解扩散至水及土壤中,通过生物富集到人体中,导致内分泌失调,诱发疾病以及新陈代谢紊乱,给人体健康带来极大危害[3~5]。目前,用于检测微量BPA残留的方法主要有电化学法[6]、高效液相色谱法[7]、生化传感器[8]、液相色谱-质谱联用技术[9]等。这些方法成本较高、检测过程需要经过采样、预处理、提取、衍生化、纯化等过程,需要复杂而精密的设备和专业培训的操作人员,耗时耗力,不便于野外考察以及现场快速检测。双氰胺(Dicyandiamide,DCD)是一种有机化工原料,在农业生产中常作为硝化抑制剂添加到复合肥中,防止土地中的氮流失,促进牧草生长[10]。然而,水土中的DCD会残留在牧草中,奶牛食用后会导致乳制品中微量的DCD残留,对婴幼儿的健康有着潜在的危害[11]。DCD分析技术需要复杂的样品前处理过程和精密仪器,检测成本高,操作复杂,不便于操作和推广使用[12~14]。因此,有必要开发出操作简单、携带方便、能快速准确地测定BPA以及DCD的检测方法。
光子晶体(Photonic crystals,PCs)是一种可以由人工设计和制备的,在光学尺度上具有周期性介电结构的晶体材料[15~17]。分子印迹技术(Molecular imprinting technique,MIT)是一种模拟抗原和抗体的特异性结合,人工构建与目标物在大小、形状、功能基团互补结合的聚合物技术[18]。采用对应的洗脱体系对聚合物上的模板分子的洗脱,可得到与模板分子互补匹配的分子印迹聚合物(Molecularly imprinted polymer, MIP)。在适合的条件下,此印迹空穴可选择性捕获模板分子,实现目标物的特异识别和分离检测。因此,将光子晶体与分子印迹聚合物结合,可以构建出同时兼具分子印迹聚合物和光子晶体的优点的分子印迹反蛋白石光子晶体聚合物(Molecularly imprinted inverse-opal photonic crystal polymers,MIPPs)。基于分子印迹作用,MIPPs可以特异结合模板分子,引起MIPPs上的空穴结构改变,使其衍射峰发生位移甚至结构色产生明显的变化。因此,这种材料可以作为传感元件,用于特定物质的光学分析检测,具有操作简单、响应快速、灵敏性和选择性高等优点[19~22]。
目前,已有很多关于 MIPPs应用的报道[23~27],但对BPA和DCD的检测研究不多且集中在单一物质检测[28~30],而利用MIPPs作为传感元件同时对实际样品中两种物质传感分析的应用更少。本研究设计开发了基于BPA、DCD的 MIPPs的阵列传感器,以期建立一种快速准确、操作简单、成本低廉的检测方法,用于环境水样、食品中微量BPA和DCD的快速检测。
2 实验部分
2.1 仪器与试剂
SB-5200DTD超声波清洗仪(宁波新芝生物科技股份有限公司);Specord高精密紫外-可见分光光度计(德国耶拿公司);中兴101恒温鼓风干燥器(北京中兴伟业仪器有限公司);Sigma 500/VP场发射扫描电镜(德国卡尔蔡司公司);NovaNano 430扫描电子显微镜(美国FEI公司)。
DCD、丙烯酰胺购自国药集团化学试剂有限公司;BPA、偶氮二异丁氰(AIBN)、甲基丙烯酸(MAA)、乙二醇二甲基丙烯酸酯(EGDMA)购自上海阿拉丁生物化学技术有限公司;无水甲醇、无水乙醇、乙腈、浓H2SO4、H2O2(30%)、HF(≥40%)等试剂购自北京化工厂。实验用水为二次蒸馏水。
2.2 实验方法
2.2.1 膜基质的准备将清洗后的玻片裁为 75 mm×10 mm大小,置于Piranha溶液(98% H2SO4-30% H2O2,7∶3,V/V)中浸泡 12 h,用水洗涤干净后用氮气吹干。另将聚甲基丙烯酸甲酯(PMMA)裁剪为厚度1 mm、尺寸为75 mm×8 mm的薄片,备用。
2.2.2 光子晶体模板的制备采用垂直沉降的胶体自组装法制备光子晶体模板[31]。首先,将粒径220~260 nm的SiO2在无水乙醇中超声分散;然后,加入10 mL离心管中,用无水乙醇稀释(其中SiO2质量浓度为2.5%);最后,将玻片基质以45℃倾斜插入管中,将离心管放到组装板上,密闭空间下恒温30℃静置5~7天左右,待乙醇挥发完毕后,即制得蛋白石结构的光子晶体模板。
2.2.3 MIPPs的构建分别制备BPA和DCD MIPPs的预聚合溶液。选用BPA与DCD为模板分子,致孔剂为乙醇-水(3∶2,V/V),功能单体为MAA,交联剂为EGDMA,引发剂为AIBN。
采用后填充技术[32]构建MIPPs。 具体过程如下:首先,将按上述比例配制的预聚合溶液在毛细管作用的推动下缓慢注入SiO2颗粒组装的光子晶体模板内,然后 PMMA或PET膜覆盖在光子晶体模板表面,并给予一定压力,保证膜的成型以及减少聚合溶液蒸发面积;其次,将覆盖完成的玻片迅速转移到密闭容器中,通入氮气除去氧气,然后在密闭容器中,用紫外光引发聚合反应3 h;将膜片取出,此时已制备成功与硅胶光子晶体模板具有互补结构的反蛋白石MIPPs聚合膜;最后,将得到的膜片分子印迹聚合物膜浸入5% (V/V)HF中缓慢搅拌过夜,直至完全刻蚀除去膜上的SiO2微粒,用电镜观察。将得到的光子晶体印迹膜用甲醇-乙酸(9∶1,V/V)混合溶液反复洗脱3次,每次1 h,除去模板分子。作为对照,非印迹光子晶体聚合物膜(Non-imprinted photonic crystal polymers, NIPPs)除不加入模板分子外,其余操作过程均与分子印迹聚合物膜相同。
2.2.4 制备条件优化考察了不同单体使用量对成膜效果和性能的影响。分别加入不同摩尔比的模板分子与功能单体(1∶1、1∶2、1∶4、1∶6、1∶8,n/n),混匀后超声分散10 min,然后加入交联剂EGDMA(150 μL)超声5 min,加入引发剂((NH4)2SO4, 10 mg),紫外光引发聚合反应3 h,并考察制备的光子晶体分子印迹膜衍射峰位移的变化。选择甲醇-乙酸(9∶1,V/V)、甲醇-水-乙酸(7∶2∶1,V/V)、0.1 mol/L乙酸溶液分别作为模板分子的洗脱体系,考察不同洗脱体系对模板分子的洗脱效果。
2.2.5 吸附性能测定分别将制备的BPA及DCD MIPPs与NIPPs置于不同浓度的目标物标准品溶液中,考察其吸附动力学,记录最大衍射峰位移随时间的变化曲线。
配制一系列浓度的DCD与BPA标准品溶液,将BPA及DCD MIPPs与NIPPs分别置于样品溶液中孵育,考察吸附行为。采用Specord高精密紫外-可见分光光度计扫描其最大衍射峰,并计算在不同浓度目标物溶液中MIPPs与NIPPs的最大衍射峰位移量变化值。
2.2.6 环境水样分析环境水样取自草地边的河水和湖水,样品经0.45 μm 滤膜过滤后,在4℃保存,备用。检测时,将制备的MIPPs阵列传感器分别置入不同样品中,记录不同MIPPs传感单元上的衍射峰位移变化。
3 结果与讨论
3.1 MIPPs的制备
在获得光子晶体模板之后,将分子印迹预聚合溶液注入光子晶体模板与PMMA之间的缝隙,直至预聚合溶液充满SiO2微球之间的缝隙。功能单体与模板分子(BPA、DCD)通过非共价作用(氢键、范德华力)结合,然后在交联剂作用下,在光子晶体模板上交联成反蛋白石结构的网状聚合物,最后在不同的洗脱体系下洗脱去除模板分子,制备得到对应模板分子的MIPPs。制备的MIPPs可以特异地吸附结合模板分子,导致聚合物空穴结构发生变化,从而产生衍射峰位移,甚至结构颜色的变化。
分别对单体用量、洗脱条件进行了考察。在BPA与DCD用量一定的条件下,当单体用量较少时,构成的聚合物膜结构不稳定,缺乏刚性;而单体用量越高,制备的聚合物膜结构致密,稳定性好,并且制备的MIPPs在置入BPA样品溶液中衍射峰位移明显。但是过高的单体用量会导致构成的MIPPs易黏连在基质玻片的表面,较脆, 易损坏。综合考虑,选择BPA聚合体系中单体用量与模板分子最佳摩尔比为1∶2,DCD聚合体系中单体用量与模板分子的最佳摩尔比为1∶4。此外,不同的体系洗脱,对MIPPs与模板分子的特异结合能力有明显的影响。采用0.1 mol/L乙酸时,对DCD的洗脱效果最好;而采用甲醇-水(9∶1,V/V)混合溶液时,对BPA的洗脱效果最好。
3.2 形貌表征
采用扫描电子显微镜分别对制备的光子晶体模板和MIPPs的形态进行了分析,结果如图1所示。由图1A可知,制备的光子晶体由SiO2微球周期性有序排列而成,呈蛋白石结构,结构均一,排列致密有序。由图1B可见,制备的光子晶体模板由多层SiO2组成,每层微球与微球之间形成有序多孔结构,为分子印迹聚合物的制备提供了充足条件。由图1C可知,制备的MIPPs具有明显反蛋白石多孔结构,经过刻蚀SiO2微球后的孔穴紧密排列,孔穴直径约220 nm,分子印迹聚合物构成支撑整个膜的聚合物交联网状结构。由于均一多孔的存在,制备的MIPPs具有大的比表面积,并且印迹位点均匀分布在孔穴内外,因此对目标物分子的结合具有传质快、吸附量大、特异性好等特点。

图1 (A、B)光子晶体模板与(C)反蛋白石结构 MIPPs的扫描电子显微镜照片Fig.1 Scanning electron microscope images of (A, B) photonic crystal templates and (C) molecular imprinted photonic crystal polymers (MIPPs)
3.3 基于MIPPs膜阵列传感器的构建
将BPA MIPPs(MIPPs@BPA)、BPA非印迹光子晶体聚合物(NIPPs@BPA)、DCD的 MIPPs(MIPPs@DCD)以及DCD非印迹聚合物(NIPPs@DCD)作为传感单元,组装到基质模板,构建阵列传感器(图2)。将制备的阵列传感器置入含有不同浓度的目标分析物样品溶液中,由于传感单元上的分子印迹作用,传感单元上的MIPPs可以特异结合对应的目标分析物,引起衍射峰位移。因此,可以通过传感单元上的MIPPs衍射峰位移量检测目标物。构建的基于MIPPs的传感器阵列不仅保留了传统分子印迹聚合物和光子晶体的优点,还可以同时对BPA和DCD进行检测,提高了检测效率,降低了检测成本,为微量目标物的快速识别分析提供了一种新的检测方法。
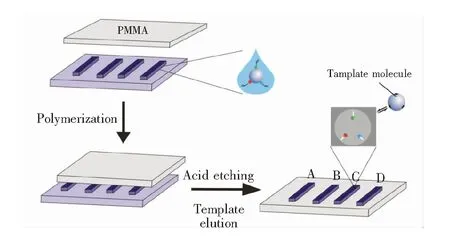
图2 基于BPA、DCD MIPPs的阵列传感器制备示意图:(A)MIPPs@BPA;(B)NIPPs@BPA;(C)MIPPs@DCD;(D)MIPPs@DCDFig.2 Schematic illustration of preparation of a sensor chip based on MIPPs for bisphonel A (BPA) and dicyandiamide (DCD): (A) MIPPs@BPA; (B) NIPPs@BPA; (C) MIPPs@DCD; (D) NIPPs@DCD. PMMA: polymethyl methacrylate
3.4 响应时间
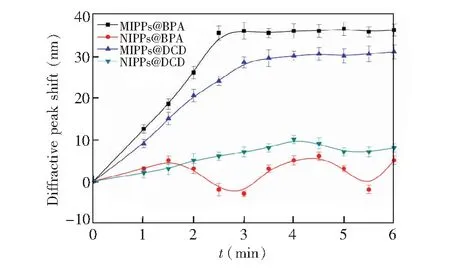
图3 MIPPs和NIPPs对BPA和DCD的响应时间Fig.3 Response time of MIPPs and NIPPs for BPA and DCD
对不同反应时间下MIPPs和NIPPs的衍射峰位移变化进行了测定。由图3可知,制备的BPA和DCD的MIPPs都在很短的时间内发生明显的位移,并且达到稳定,说明构建的MIPPs对目标物响应迅速。与目标溶液分别反应2.5和4.0 min后,BPA与DCD的MIPPs衍射峰位移达到稳定。作为对照的NIPPs也出现位移变化,但是位移量较小。这是由于MIPPs上存在与目标物的大小、形状以及功能基团互补的结合位点,可快速结合大量的目标物分子,从而改变了膜上孔穴的结构,引起明显的衍射峰位移;而NIPPs主要依靠非特异性吸附结合目标物,因此与目标物分子结合较慢,衍射峰位移不明显。实验结果表明,BPA和DCD的MIPPs的响应时间分别为2.5和4.0 min。
3.5 MIPPs对BPA和DCD的测定
分别将BPA和DCD的MIPPs置于不同浓度的样品溶液中,考察衍射峰位移量。由图4可知,随着BPA浓度增大,衍射峰逐渐由539 nm移动红移到578 nm,最大位移量为39 nm(图4A),同时,MIPPs@BPA的颜色也发生变化,由黄绿色逐渐变化为橘红色。而BPA的NIPPs衍射峰位移变化不明显(图4B),表明BPA的MIPPs具有特异结合能力,可以通过计算分析或图像处理软件进行样品溶液中BPA的快速定性与定量检测。DCD MIPPs膜也具有同样的现象,随着样品中DCD浓度增大,MIPPs@DCD的衍射峰由536 nm逐渐位移到567 nm,最大位移量为31 nm(图4C)。由图4可知,NIPPs的衍射峰位移较小,最大位移量小于10 nm,且没有明显规律(图4B和4D)。由图4E和4F可知,制备的MIPPs@BPA的衍射峰位移在BPA浓度范围为0.1~5.0 μg/L时,与BPA浓度具有良好的线性关系(R2=0.9964),检出限为0.051 μg/L (S/N=3),低于BPA国家标准限量值(10 μg/L)[33]; MIPPs@DCD在DCD浓度范围为0.1~10 μg/L时具有良好线性关系(R2=0.9944),检出限为0.038 μg/L (S/N=3)。
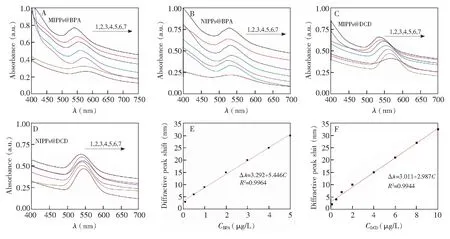
图4 (A)MIPPs@BPA、(B) NIPPs@BPA、(C) MIPPs@DCD和(D) NIPPs@DCD在不同浓度对应目标物溶液中的衍射峰图谱(样品浓度均为0、1、2、4、6、8、10 μg/L,25℃);(E) MIPPs@BPA衍射峰位移量与BPA浓度的线性关系;(F)MIPPs@DCD衍射峰位移量与DCD浓度的线性关系。 Δλ: MIPPs衍射峰位移量Fig.4 Diffraction spectra of (A) MIPPs@BPA, (B) NIPPs@BPA, (C) MIPPs@DCD and (D) NIPPs@DCD in different concentrations (0, 1, 2, 4, 6, 8, 10 μg/L, at 25℃) of corresponding target molecule solutions; (E) Linear relationship between diffraction peak shift of MIPPs and concentration of BPA; (F) Linear relationship between the diffraction peak shift of MIPPs and the concentration of DCD. Δλ: diffraction peak shift
3.6 选择性
考察了BPA和DCD的MIPPs的选择性,结果如图5所示。结果表明,MIPPs @BPA置于BPA样品溶液中后,其衍射峰位移随BPA浓度增加而增大;而将MIPPs@BPA置于DCD溶液中时,其吸附行为和衍射峰位移量与NIPPs@BPA相似,远低于其在BPA溶液中的衍射峰位移变化。这说明由于DCD与BPA在结构和功能基团上具有明显差异,制备的MIPPs@BPA不能选择性捕获DCD分子,对DCD分子的结合能力与非印迹光子晶体聚合物类似,都是通过非特异性结合,因此衍射峰位移量变化较小。而将MIPPs@DCD置于BPA样品溶液中,得到了同样的结果。实验结果表明,制备的DCD和BPA MIPPs能够特异地结合目标物(模板分子),具有选择性高、响应快等特点。

图5 制备的MIPPs阵列传感器分别在不同浓度(0、 1、 2、 4、 6、 8和10 μg/ L,25℃)的(A)BPA和(B)DCD溶液中最大衍射峰位移变化Fig.5 Diffraction peak shift of MIPPs array sensor in different concentrations (0, 1, 2, 4, 6, 8 and 10 μg/L, at 25℃) of (A) BPA and (B) DCD
3.7 实际样品分析
采用制备的MIPPs阵列传感器对环境水样中DCD和BPA进行了检测。由表1可知,将制备的MIPPs阵列传感器置入环境水样中反应4 min后,BPA MIPPs传感单元的衍射峰发生了位移,最大位移量分别为(2.0±0.6) nm和(3.0±1.0) nm;而DCD MIPPs传感单元未能检出衍射峰变化。在环境水样中同时添加BPA和DCD标准品,采用本方法检测,BPA和DCD MIPPs传感单元的衍射峰位移均显著增加,最大位移量分别为(27.0±1.7) nm 和 (18.0±1.0) nm。结果表明,制备的MIPPs阵列传感器可以有效地检测实际样品中BPA和DCD,具有操作简单、快速、选择性好和灵敏度高等优点。
表1 制备的MIPPs传感器对环境水样中BPA和DCD的检测
Table 1 Detection of BPA and DCD in environmental water samples by MIPPs array sensors
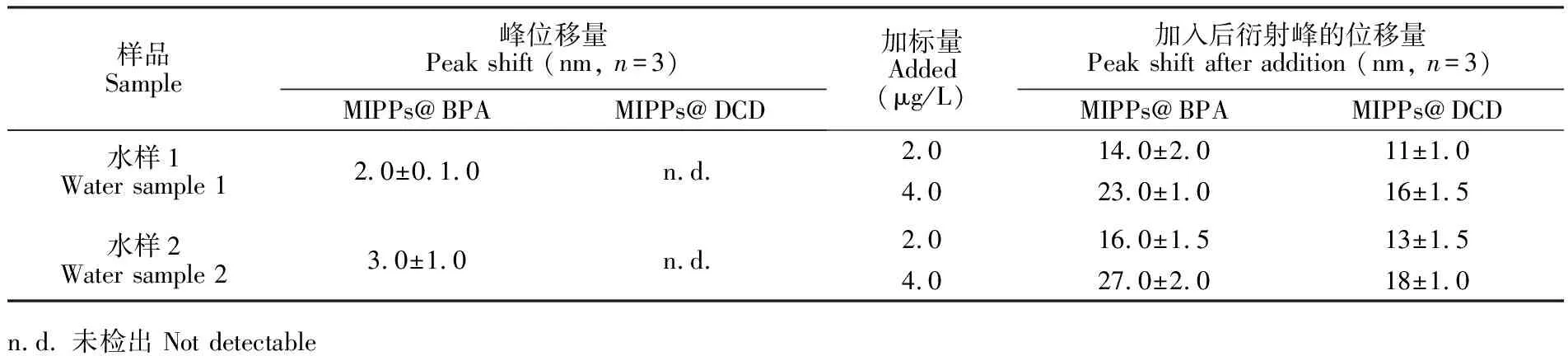
样品Sample峰位移量Peak shift (nm, n=3)MIPPs@BPAMIPPs@DCD加标量Added(μg/L)加入后衍射峰的位移量Peak shift after addition (nm, n=3)MIPPs@BPAMIPPs@DCD水样1Water sample 12.0±0.1.0n.d.水样2Water sample 23.0±1.0n.d.2.014.0±2.011±1.04.023.0±1.016±1.52.016.0±1.513±1.54.027.0±2.018±1.0n.d. 未检出 Not detectable
4 结 论
采用分子印迹技术与光子晶体结合,构建了基于MIPPs的传感器阵列,并用于样品中BPA和DCD的快速识别分析。制备的传感器对目标物在较低浓度时就有明显的衍射峰位移变化,并具有选择特异性。实验表明,构建的传感器阵列具有结构稳定、灵敏度高、响应快、选择性好等优点,可以作为一种新方法用于环境水样、塑料制品及乳制品中BPA和DCD以及其它小分子物质的识别检测。

