凝胶原位探测c-Myc G-四链体的结构多态性
常天俊 武 俐 卞文秀 邴 涛 赵同谦 上官棣华*
1(河南理工大学资源环境学院, 焦作 454000)2(中国科学院化学研究所, 北京分子科学国家实验室, 活体分析化学院重点实验室, 北京 100190)
1 引 言
G-四链体(G-quadruplex, G4)是由富鸟嘌呤(G)的核酸通过Hoogsteen氢键形成的高级结构[1]。G4 DNA具有高度的结构多态性,包括一条DNA链形成的分子内平行、反平行或混合平行/反平行G4,两条或四条DNA链(每条链不能单独形成G4)聚集形成的分子间平行或反平行单体G4等多种拓扑构型[2]。其中,由一条DNA序列形成的分子内平行G4一般较稳定,近年来研究发现,这种序列的多个分子也可聚集在一起形成G4聚集体。Gabelica等[2]的研究表明,具有短Loop的平行G4可形成由四链体单体堆积成的多聚体。原癌基因c-kit启动子区的一段序列(c-kit2)既可形成分子内平行G4,也可同时形成由两条链交叉缠绕的分子间平行G4[3]。在本研究组前期工作中,发现不同末端序列可导致平行G4组装成多种分子内和分子间结构,“Blunt end”的平行G4 (即3'和5'末端碱基为参与四链体形成的G)易形成由四链体单体堆积的结构,而两末端有其它碱基时则可抑制G4单体的堆积,但同时形成了少量新的分子间结构[4]。平行G4的不同聚集形式具有多种功能,如具有抗HIV病毒和抗癌活性的序列d(GGGT)4, 活性结构为单个平行G4堆积的二聚体[5]; 分子内平行G4具有普遍的细胞结合活性,而分子间平行G4的细胞结合能力较差[6]; 分子内平行G4结合Hemin形成的过氧化物酶活性远高于分子间平行的G4[7]。 具有广谱抗癌活性的G4序列AS1411在K+溶液中可形成包括分子内平行G4在内的8种构型, 但目前尚不清楚起关键作用的结构成分[8]。平行G4结构的多态性,尤其是同一序列在溶液中同时形成分子内和分子间的结构,影响其结构-活性研究,然而研究者对分子内平行G4形成的包括聚集结构在内的多态性关注较少。探测这些结构成分,发现起关键作用的结构及形成规律,将为G4的可控自组装及生物活性研究提供支持。
目前,已有可直接或间接测定G4构型的方法,如核磁共振(Nuclear magnetic resonance spectrum, NMR)[9]或X-射线衍射(X-ray diffraction, XRD)[10]可在原子水平测定G4解析结构; 质谱(Mass spectrometry)可直接测定G4的分子数以及与配体的结合状态[11]; 圆二色光谱(Circular dichroism, CD)是分析G4二级结构最常用的技术之一,在G4结构、离子依赖性以及配体诱导的结构变化等领域广泛应用[12]; 此外,G4折叠和解折叠的紫外-可见吸收光谱不同,通过测定两个状态的差异光谱,可以分析其折叠状态及变化[13]; 形成G4的核酸在295 nm处的紫外吸收增加,通过测定该处的光吸收值随温度的变化曲线(UV-melting),可用于分析G4的折叠状态及其热力学[14]。这些方法能很好地测定溶液中的单一G4结构,但对于溶液中多种构型共存则不易分辨具体成分[2,4]。凝胶电泳在检测从未折叠状态到折叠成分子内或分子间G4变化等方面广泛应用[15]。为了研究多种结构共存的G4,Kuryavyi等[3]用非变性凝胶电泳分离不同的构型,再用NMR解析其在溶液中的结构。然而,这些DNA片段在重新溶解过程中结构可能转化。若能在分离的同时原位分析DNA构型,将有助于克服上述问题。特异性结合G4并产生“荧光打开(Fluorescence ON)”信号的小分子探针近年来得到快速发展[16~19],已成为探测G4在体外,甚至活细胞内折叠的重要技术[20,21]。硫磺素T (Thioflavin T, ThT)是常用于检测淀粉样蛋白的苯并噻唑类荧光分子,自Mohanty等[22]发现其能特异性结合人端粒G4并产生强荧光信号以来,已在基于G4的生化分析与生物传感研究中广泛应用[23~28]。ThT除对混合平行/反平行的G4有高亲和力外[29],还能识别RNA G4[30]及i-motif DNA[31],为在凝胶中对不同G4进行原位染色提供了可能。
c-Myc G4是原癌基因c-Myc启动子区的一段富G序列,能形成典型的分子内平行G4结构[32],具有抑制多种肿瘤细胞增殖的活性[6],与Hemin结合具有高DNAzyme活性[33]。与许多平行G4相似,末端碱基也影响其形成多种分子间结构[4],这些分子间结构的具体类型、形成规律以及是否具有生物活性并不清楚。为进一步阐明c-Myc的结构多样性,本研究以荧光分子ThT作为G4探针,采用荧光光谱、CD光谱等方法比较ThT与典型分子内和分子间G4,以及含不同A/T末端碱基的c-Myc的相互作用; 在此基础上,用ThT对非变性凝胶电泳分离的G4直接染色,再用全染色剂Stains-all对所有DNA条带进行显色,比较同一DNA条带经两种染色的光密度值,分析判断DNA条带的拓扑构型,并探讨末端碱基对c-Myc G4自组装结构的影响。
2 实验部分
2.1 仪器与试剂
UV-2550紫外-可见分光光度计、S-1700精密控温装置(日本Shimadzu公司); F-7000荧光仪(日本Hitachi公司); J-815圆二色光谱仪(日本JASCO公司); DYCZ-24DN型双垂直电泳仪(北京六一公司); AlphaImagerTM凝胶成像系统(美国Alpha Innotech公司)。
DNA由生工生物(上海)有限公司合成与纯化(序列见表1); ThT (分析纯,北京百灵威化学科技有限公司); Stains-all(纯度97%,美国ACROS 公司),ThT与Stains-all的分子式见图1; 其它试剂均为分析纯,购自国药(上海)化学试剂公司。实验用水为超纯水 (18.2 MΩ cm,美国Millipore超纯水系统制备)。
表1 所用寡核苷酸序列
Table 1 Oligonucleotides used in this study
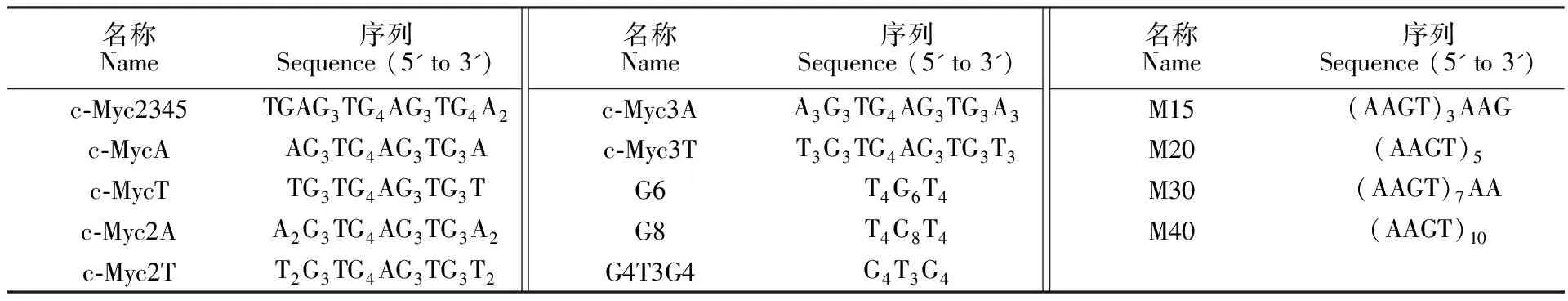
名称Name序列Sequence (5' to 3')c-Myc2345TGAG3TG4AG3TG4A2c-MycAAG3TG4AG3TG3Ac-MycTTG3TG4AG3TG3Tc-Myc2AA2G3TG4AG3TG3A2c-Myc2TT2G3TG4AG3TG3T2名称Name序列Sequence (5' to 3')c-Myc3AA3G3TG4AG3TG3A3c-Myc3TT3G3TG4AG3TG3T3G6T4G6T4G8T4G8T4G4T3G4G4T3G4名称Name序列Sequence (5' to 3')M15(AAGT)3AAGM20(AAGT)5M30(AAGT)7AAM40(AAGT)10
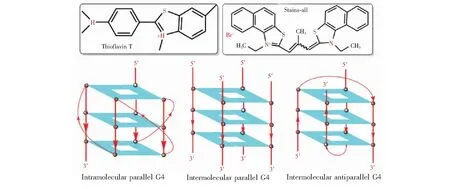
图1 ThT和Stains-all分子式以及分子内与分子间平行、提篮式分子间反平行G4结构示意图Fig.1 Schematic of thioflavin T (ThT), Stains-all, intramolecular parallel G-quadruplex (G4), intermolecular parallel G4 and intermolecular antiparallel G4
2.2 DNA样品溶液制备
DNA溶解于Tris-HCl缓冲液 (25 mmol/L, pH=7.6) 中。用紫外-可见分光光度计测定DNA样品在260 nm的吸光度值,根据相应序列的摩尔吸光系数计算得到DNA的浓度。为了形成稳定的G4结构,在适当浓度的DNA溶液中加入终浓度为20 mmol/L的 KCl或NaCl,95℃变性10 min,缓慢冷却至室温,备用。
2.3 荧光光谱的测量
将DNA样品(1 μmol/L)与ThT在室温孵育5 min后,测量溶液的荧光光谱或荧光强度。 荧光光谱测量采用400 μL、1 cm光程的石英四通比色皿,激发波长为425 nm,扫描并收集发射波长在440~650 nm范围的荧光光谱或490 nm的荧光强度数据。所得数据为3次重复测量的平均值。
2.4 CD光谱测量
5 μmol/L DNA样品(含20 mmol/L KCl或NaCl)经变性/复性处理后,于25℃测试CD光谱。在1 cm光程的石英比色皿中,加入400 μL样品,以200 nm/s的速度扫描3次,收集220~320 nm的CD信号。为了测量ThT对DNA构型的影响,不同浓度的ThT与DNA样品在室温孵育5 min后测定CD光谱。 CD光谱数据为扫描3次的平均值,经OriginPro 8.0软件平滑处理,并预先扣除缓冲液背景吸收。
2.5 凝胶电泳与染色分析
采用非变性聚丙烯酰胺凝胶电泳(Native-PAGE)分析DNA(20 μmol/L,含20 mmol/L KCl或NaCl),使用7 cm × 10 cm的20%聚丙烯酰胺凝胶(丙烯酰胺-甲叉双丙烯酰胺,19∶1,m/m)。 4℃下以9 V/cm电泳4~5 h。电泳缓冲液为1×TBE (89 mmol/L Tris,2 mmol/L EDTA,89 mmol/L硼酸,pH=8.3)。为了维持G4结构,凝胶和电泳缓冲液中分别加入20 mmol/L的相应离子。
在室温下, 用ThT (6 μmol/L)对凝胶染色15 min,在紫外光照射下, 与G4 DNA结合的ThT分子荧光被激发,通过凝胶成像系统观测被染色的G4 DNA。将上述凝胶用超纯水洗涤后,再用全染色剂Stains-all进行染色; 在日光光照下,未与DNA结合的染料分子褪成无色,结合在DNA上的分子仍为蓝色[34],利用凝胶成像仪记录所有DNA条带被染色的图像。ThT或Stains-all染色条带的光密度值(OD)用ImageJ 软件(ImageJ 1.48V, Wayne Rasband, National Institutes of Health, 美国)进行定量分析。
3 结果与讨论
3.1 荧光法分析ThT与c-Myc序列的相互作用
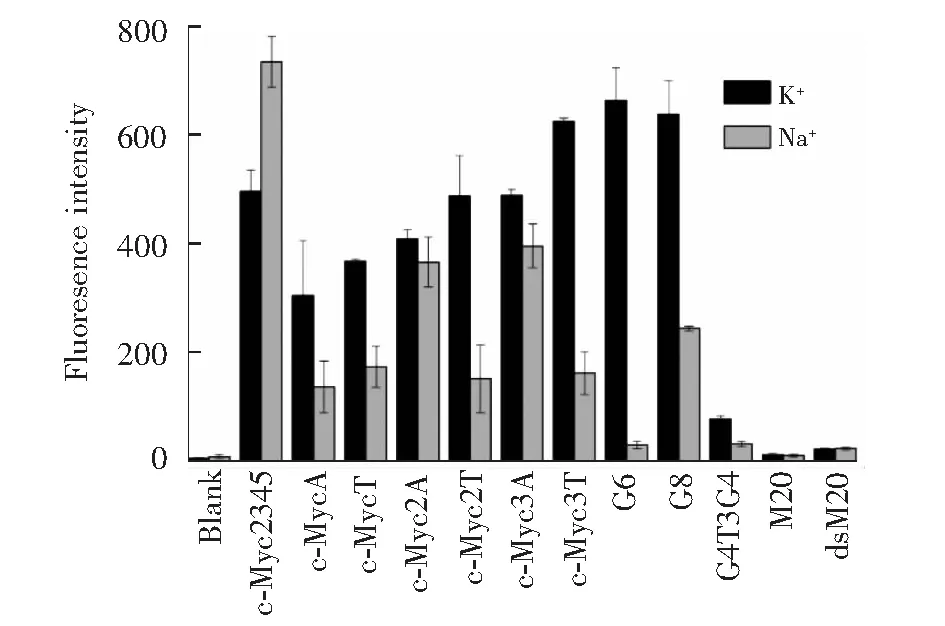
图2 不同DNA序列存在下的ThT的荧光强度Fig.2 Fluorescence intensity of ThT in the presence of various DNAsλex=425 nm; λem=490 nm
为了实现在分离的同时可视化探测G4多种构型,进而研究末端碱基在G4自组装中的作用,首先考察了溶液状态下ThT对含不同末端碱基的c-Myc G4的识别。考虑到在G4末端增加C或G碱基可能导致形成双链或更复杂的G4类型,本研究仅在c-Myc G4的核心序列d(G3TG4AG3TG3)末端加上不同数目的A或T(序列见表1)。为了分析多种可能的结构形式,选择以下序列为对照: 可形成分子内平行G4的序列c-Myc2345[1],可形成四分子间平行G4的序列G6、G8[7],可形成提篮式双分子间反平行G4的序列G4T3G4[1](G4不同结构示意图见图1); 非G4的对照单链序列M20和双链dsM20(序列见表1,dsM20为M20与互补链配对所形成)。首先测试了在K+或Na+溶液中不同DNA激活ThT荧光的效果(图2)。 ThT在水溶液中荧光很弱,非G4单链和双链增强ThT的荧光约为背景值2倍; 在K+溶液中,含有不同末端碱基的c-Myc衍生序列(c-MycA、c-MycT、c-Myc2A、c-Myc2T、c-Myc3A和c-Myc3T)能使ThT荧光增强100~200倍,其中末端A或T碱基数增加有利于荧光增强,且T碱基的增强效果略大于A碱基。与K+相比,在Na+溶液中c-Myc2345对ThT的荧光增强效果更高,与文献[29]报道一致; 但其它衍生序列的荧光增强效应都减弱, c-Myc2A和c-Myc3A对ThT荧光增强的效果高于其它序列。此外,可形成分子间结构的G6和G8在K+中对ThT荧光增强高达200倍以上,但在Na+溶液中,其增强效果发生了显著降低; 双分子间反平行G4(G4T3G4)在两种离子中激活ThT荧光的能力都很差,仅略高于非G4的单链或双链序列。
3.2 CD光谱表征c-Myc序列的结构
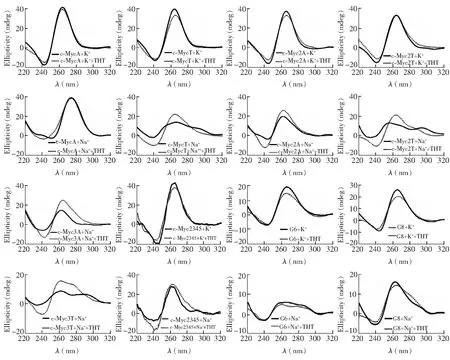
图3 DNA在与ThT作用前后的CD光谱及CD光谱变化,DNA与ThT浓度均为5 μmol/LFig.3 Circular dichroism (CD) spectra of 5 μmol/L DNAs in the absence or presence of 5 μmol/L ThT
CD光谱可表征典型G4二级结构及构象变化,反平行G4在295 nm 处显示正峰,在260 nm 处为负峰; 平行G4在260 nm 附近显示正峰,在240 nm 处显示负峰[1]。为了进一步研究ThT的荧光增强与G4的关系,本研究测量了G4 DNA的CD光谱及其与相同浓度的ThT作用后的CD光谱变化(图3)。K+溶液中,所有序列的CD光谱在260 nm为正峰,240 nm为负峰,表明此条件下形成平行G4; 加入ThT后各序列CD光谱变化很小(图3),表明与ThT作用后并未影响这些序列已形成的结构。Na+溶液中,CD光谱显示,含不同末端碱基的c-Myc序列形成了多种结构: c-MycA的CD正峰在280 nm附近,负峰在250 nm处,主要为非G4结构; c-Myc2A与c-Myc3A在260 nm处为正峰,240 nm附近为负峰,主要为平行G4结构; c-MycT、c-Myc2T与c-Myc3T除了295 nm正的肩峰外,还在255~280 nm有宽的正峰,提示为非G4、平行和反平行G4等多种结构共存。加入同样浓度的ThT后,c-Myc2A、c-Myc3A、c-MycT、c-Myc2T、c-Myc3T及c-Myc2345在Na+溶液中260 nm附近的吸收增加并形成正峰,而且c-MycT、c-Myc2T和c-Myc3T在290 nm的肩峰降低,说明ThT能促进这些序列形成平行G4; c-MycA的CD光谱变化不大。另外,CD光谱显示,G6在K+溶液中存在260 nm的正峰,表明能形成平行的分子间G4,但Na+溶液中260 nm的正峰消失,表明未形成G4; G8在两种离子条件下都存在平行G4的特征CD信号,且在K+中信号更强,表明在K+中形成G4的能力更强; 加入ThT对两个序列的CD光谱影响较小。
3.3 组合染色分析c-Myc G4多态性及末端碱基对其自组装的影响
上述结果已表明,末端序列对c-Myc与ThT的识别有较大影响,与文献[35]报道现象类似; 此外,分子间与分子内平行的G4结构均可增强ThT的荧光,但分子间平行结构更强。本研究组的前期工作中,发现含有不同末端碱基的c-Myc除了能形成分子内平行G4外,还能形成部分分子间聚集结构[4]。因此,需考察末端序列不同的c-Myc与ThT的不同识别能力是由末端序列与ThT的作用引起,还是末端序列引起c-Myc形成了不同的分子间聚集结构所引起。由于CD光谱不能分辨同一个序列在溶液中存在的多种结构,例如由同一个序列形成的分子间与分子内平行结构,为了进一步探讨不同末端碱基是否导致c-Myc序列产生不同拓扑结构,进而引起不同的ThT荧光增强效果,本研究在凝胶中分离上述序列所形成的结构,并用ThT直接染色凝胶中的DNA条带。
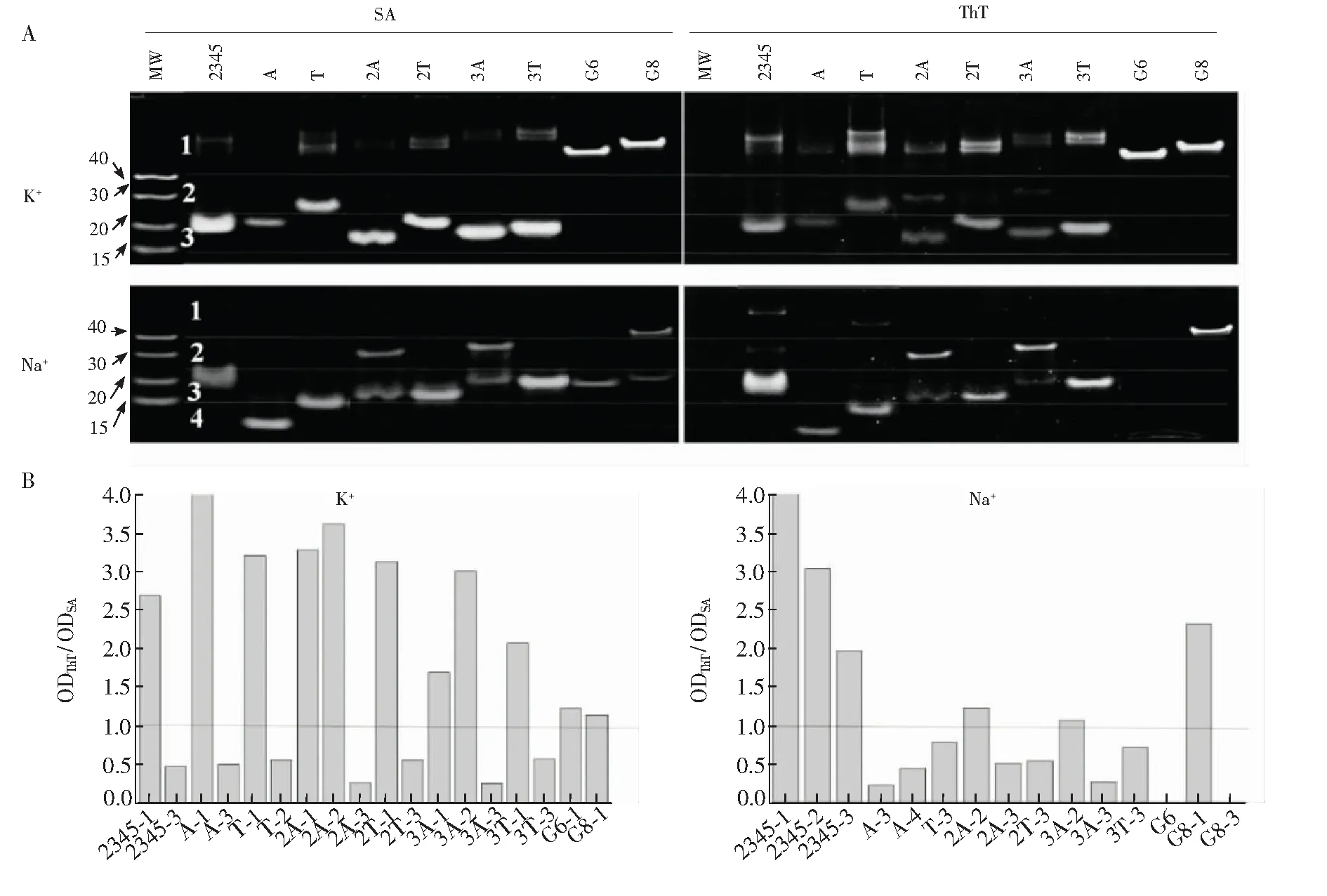
图4 组合染色分析DNA在K+或Na+溶液中的多态性结构(A) ThT和Stains-all对同一凝胶分别染色的图像; (B)同一电泳条带分别经ThT与Stains-all染色的灰度比值,DNA分子量Marker为40、30、20和15碱基长的单链非G4 DNAFig.4 Double-staining of DNA structures by ThT and Stains-all in 20 mmol/L KCl (left) or NaCl (right)(A) Images of gels stained in turn by ThT and Stains-all. (B) TheOD ratio of the DNA bands stained by ThT and SA. Molecular weight (MW) ladder was ssDNA mixtures with 40, 30, 20 and 15 bases, respectively. “c-Myc2345”, “c-MycA”, “c-MycT”, “c-Myc2A”, “c-Myc2T”, “c-Myc3A” and “c-Myc3T” are abbreviated to “2345”, “A”, “T”, “2A”, “2T”, “3A” and “3T”(已替换)
为了观测所有DNA片段,用非特异性染色剂Stains-all对ThT染色后的凝胶进行显色(图4)。Stains-all染色可清楚显示出不被ThT染色的分子量Marker(MW,序列见表1,分别用M40、M30、M20和M15命名),根据其片段大小将迁移速率不同的条带进行分区: 发现c-Myc系列衍生序列在K+溶液中以分子内结构为主,但都能形成部分分子间结构(> 40 bases); 而在Na+溶液中,c-Myc2A和c-Myc3A形成了另一种分子间结构(~ 30 bases),其它衍生序列主要是分子内结构(图4A)。从ThT染色结果可知,以上序列形成的分子间或分子内结构都能被荧光特异性染色,而在Na+溶液中,G6和 G8中的单链成分(凝胶中第3区域的片段,分子量在15~25碱基之间)都不能被荧光染色。Stains-all是一种阳离子羰花青染料,可通过静电作用与所有DNA非特异性结合,以末端堆积结合G4的ThT不干扰Stains-all对DNA的进一步染色,因此可用Stains-all染色的DNA条带光密度值评估该条带的含量。考虑到 G4 DNA对ThT的荧光增强除了与其结构特征有关,也与G4的含量有关,为了比较G4的不同结构类型与ThT的结合差别,以Stains-all染色条带的光密度值表示DNA的含量,以该条带分别经ThT与Stains-all染色的光密度比值对荧光增强进行归一化处理。从图4B可见,所有分子间平行G4结构(包括G6和G8在K+中)或分子间聚集体的光密度比值都大于1,分子内平行G4结构类型的光密度比值约0.5,不能被ThT染色的非G4条带光密度比值为0。这些数据表明,单位浓度G4的分子间结构对ThT荧光的增强能力最强,分子内结构次之,非G4不能增强ThT的荧光。由于18碱基的c-MycA在Na+溶液中不能形成G4(图3),但其在凝胶中的片段所在位置小于15个碱基,也小于同为18个碱基的c-MycT(图4A); 其光密度比值较低(~ 0.2)(图4B),介于非G4的单链序列(Marker)与分子内G4之间。进一步测试了不同浓度的ThT在Na+溶液中与c-MycA作用的CD光谱,结果表明,高浓度ThT可诱导其形成G4,而非G4的单链受影响很小(图5),提示ThT诱导c-MycA形成了部分G4,进而引发自身荧光,使得凝胶中其光密度比值介于非G4和分子内G4之间。
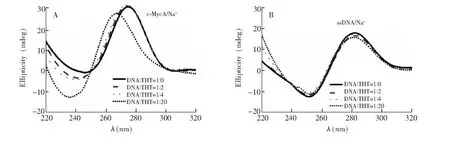
图5 Na+溶液中c-MycA及对照单链DNA(M20)与不同浓度比例的ThT作用的CD光谱及变化 Fig.5 CD spectra of 5 μmol/L c-MycA or ssDNA (M20) in the presence of various concentrations of ThT in Na+ solution
以上结果表明,在K+溶液中, 末端碱基数增加对ThT荧光的影响也增强,末端碱基数相同的序列中T碱基表现出更强的荧光增强能力(图2); 在Na+溶液中,末端为2个以上A的c-Myc2A和c-Myc3A对ThT荧光增加影响更大(图2); 这些对ThT荧光增强影响大的序列具有相对较多的分子间结构成分(图4),且都能形成平行G4(图3)。上述结果提示末端碱基引起c-Myc形成不同的分子间G4聚集体可能是其结合ThT产生不同荧光增强的主要原因,而且这种影响存在离子和序列选择性,即在K+溶液中,增加末端碱基的数目有利于形成分子间聚集体,其中T碱基的作用更强; 而在Na+溶液中,两个或以上的A碱基可引起c-Myc形成分子数较小的分子间结构,T碱基则不能。这表明在涉及末端碱基影响的G4分子识别研究中,若缺少对DNA构型多态性的分析,这种差异可能会被认为仅由末端碱基与配体的相互作用所致。
本研究中,荧光光谱(图2)与凝胶电泳分析(图4)结果均显示ThT对分子间平行G4或分子间平行G4聚集体具有高选择性,已有的研究也指出ThT对反平行或混合平行/反平行G4的选择性优于分子内平行G4结构[22,29]。近期研究发现,RNA aptamer“Corn”形成的二聚体可强烈激活ThT的荧光,与仅有一个G4结构的Aptamer“Spinach”比较,ThT与“Corn”二聚体结合位点两侧的G4能更好束缚光激荧光团,使G4二聚体具有更强的ThT荧光激活能力[36]。本研究组之前的研究发现,反平行G4或未折叠成G4结构的G4形成序列与小分子BMSP(2,9-bis[4-(4-methylpi-perazin-1-yl)styryl]-1,10-phenanthroline)的结合可强烈激活其荧光,且远高于稳定的分子内平行G4结合BMSP产生的荧光[37]。通常, 同等构型下分子间G4的稳定性弱于分子内G4结构,反平行或混合平行/反平行G4结构的稳定性弱于分子内平行结构。上述研究结果说明,G4最稳定的构像不一定是最佳的配体结合结构。
相对于分子内平行G4结构,平行G4结构形成的分子间聚集体受关注较少,也缺乏简单有效的研究方法。本研究初步建立了原位多重染色与G4探针、CD光谱结合的方法,并用图像分析工具进行分析,可实现多种构型的同时分离与分析,并能用于G4自组装规律的研究。然而,本研究在拓扑结构的基础上对分子间G4聚集进行分析,虽可区分分子间与分子内结构,但不能准确测定聚集的分子数以及聚集状态。此外,ThT虽然可结合不同G4产生强的荧光,但ThT对一些非G4结构的识别[38]可能限制其进一步应用; 开发特异识别不同G4聚集体的新型荧光探针[39,40],将有助于系统深入探讨G4自组装的规律。
4 结 论
平行G4结构是很多核酸药物以及核酸适配体的活性结构,然而, 平行G4结构受溶液条件和序列等因素的影响可形成不同形式的分子间聚集体,不利于其结构与功能研究。本工作研究了具有重要生物活性且能形成平行G4结构的c-Myc序列,以ThT为荧光探针,结合DNA非选择性染料Stains-all和光密度定量分析工具,在凝胶中直接分析了其结构多态性及末端碱基对自组装的影响。本研究策略可较好地实现c-Myc G4多种构型的同时分离与探测,有助于理解多种构型共存的G4自组装及其构效关系。本研究表明,ThT除对多种平行G4有一定识别能力外,对分子间和分子内平行G4之间也有一定的选择性,在G4多态性结构的分析中有良好的应用前景。此外,本方法采用对DNA具有不同识别能力的商业化染料组合,通过凝胶电泳直接染色分析G4结构多态性,价格低廉,操作简便,实用性强。

