Sin-QuEChERS结合超高效液相色谱-高分辨质谱法快速筛查绿茶中农药及代谢物残留
黄合田 谢 双 涂祥婷 杨鸿波* 郭 峰孙晓红 段亚玲 李占彬
1(贵州医科大学公共卫生学院,环境污染与疾病监控教育部重点实验室,贵阳 550025)2(国家地质实验测试中心,自然资源部生态地球化学重点实验室,北京 100037)3(贵州省分析测试研究院,贵阳 550016)
1 引 言
茶叶因具有防癌、抗氧化、减脂等保健功效,以及独特的口感,被誉为世界三大饮料之一[1]。为控制病虫害及杂草的影响,长期使用农药, 但会导致成品茶中农药残留。许多国家和组织规定了茶叶中农药残留的最大残留限量值(MRLs),如欧盟、日本的相关标准分别限定了茶叶中453种和276种农药的MRLs,多为0.01 mg/kg,甚至是不得检出,其中未具体规定农药的MRLs均设定为0.01 mg/kg[2,3]。我国国家标准GB 2763-2019[4]也规定了茶叶中65种农药的MRLs,但在农药数量和限量水平等方面仍存在一定差距。目前,不断有茶叶中检出氨基甲酸酯类、有机磷类和烟碱类等农药的报道。如Huang等[5]在30个茶叶样品中检出21种农药,其中,啶虫脒、噻嗪酮等检出率大于40%,并且呋喃丹、乙酰甲胺磷的检出浓度和检出率也较高。Wang等[6]检出茶叶中残留的15种农药,其中,吡虫啉的检出浓度最高(1.09 mg/kg)。建立可靠、快速、低成本的茶叶中多种农药残留的同时测定分析方法,可有效提高监管效率,也是实现精准监管的基本保障。
目前,茶叶中农药残留的分析方法主要有免疫分析法[7]、拉曼光谱法[8]、气相色谱法、气相色谱-质谱法(GC-MS/MS)[9~12]和液相色谱-质谱法(LC-MS/MS)[13~15]等,其中,GC-MS/MS和LC-MS/MS技术应用最广。现有方法通常是采用标准品进行靶向分析,但分析目标物数量有限。液相色谱-高分辨质谱技术以其高分辨率、高灵敏度、抗基质干扰能力强等独特优势,可在无标准品的情况下,结合数据库,以一级精确分子量、保留时间、同位素丰度比和二级特征离子为筛查条件,对环境、生物与食品等复杂样品中潜在或未知有机污染物实现快速筛查、识别与确证。如Dzuman等[16]利用高分辨质谱技术结合农药数据库,在16 min内完成茶叶中323种残留农药的快速筛查。伍颖仪等[17]以13种农药作为质控化合物,建立了非靶向快速筛查茶饮料中未知农药残留的方法。G'omez-Ramos等[18]基于高分辨质谱,建立了绿茶中139种农药残留的快速筛查和确证的分析方法。
茶叶中含有有机酸、生物碱和色素等物质,使得茶叶前处理存在净化效率低、基质效应大、步骤繁琐等困难。Saito-Shida等[15]采用液相色谱-高分辨率质谱分析了茶叶中146种农药残留,样品需要经过反复提取,再经浓缩和氮气吹干,然后检测,操作繁琐。农药种类多,性质差异大,根据不同目标物极性差异,有针对性地优化匹配前处理技术,最大限度地挖掘茶叶中目标化合物的信息,减少基质效应,是实现高效分析的关键。目前,常用的前处理方法有QuEChERS法[16,19]和固相萃取法[12,20],新的前处理技术,如高通量平面固相萃取[21]、乙腈-水双水相结合分散固相萃取法[22]、漂浮固化分散液液微萃取法[23]等也被用于提高富集净化效率。基于QuEChERS改进并优化的Sin-QuEChERS方法,采用反向分散固相萃取的基本原理,以填充多壁碳纳米管(MWCNTs)和乙二胺-N-丙基硅烷(PSA)等净化材料的Sin-QuEChERS小柱净化提取液,采用此方法已实现茶叶[24]、豇豆[25]和韭菜[26]等复杂基质样品中的色素和脂类等物质的单步净化,结合高分辨质谱可以获取更多有效信息,但相关报道较少。
本研究选取茶叶中检出率高、应用范围广、国家标准GB 2763-2019[4]规定中包括的氨基甲酸酯类、有机磷类和烟碱类共38种农药及代谢物为质控化合物,采用Sin-QuEChERS结合超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(UHPLC-Q-Orbitrap MS)分析技术,通过优化色谱和质谱参数、乙腈酸度、加水量和净化体积等条件,建立了茶叶中多农残非靶向快速筛查的分析方法,并用于37个绿茶样品中多农残的非靶向分析和残留水平分析。本方法具有简单、快速、准确和灵敏度高等优点,适用于茶叶中多农药残留的快速筛查和定量分析,具有较强的实用价值。
2 实验部分
2.1 仪器与试剂
QExactive 四极杆-静电场轨道阱高分辨质谱系统及Dionex UltiMate 3000快速高效液相色谱系统(美国Thermo-Fisher公司); 涡旋振荡器(上海青浦沪西仪器厂); 电子天平(梅特勒-托利多国际贸易(上海)有限公司); TG16W高速离心机(长沙平凡仪器仪表有限公司); Milli-Q超纯水器( Advantage-10/Elix,美国Millipore公司); Sin-QuEChERS Nano茶叶净化柱(2 g MgSO4,80 mg PSA,65 mg L-MWCNTS, 北京绿绵科技有限公司); Thermo Accucore aQ液相色谱柱(150 mm×2.1 mm, 2.6 μm, 美国Thermo公司)。
甲醇与乙腈(色谱纯,德国默克公司); 甲酸(色谱纯,科密欧试剂公司); 甲酸铵(色谱纯,美国Fisher公司); 盐包(6 g MgSO4, 1.5 g无水醋酸钠, 北京绿绵科技有限公司)。
标准品:13种氨基甲酸酯类农药混合标准、14种有机磷类农药混合标准、11种烟碱类农药混合标准,溶于乙腈中,浓度均为100 mg/L,购自德国Dr.Ehrenstorfer公司。
2.2 标准溶液的配制
混合标准工作液:利用乙腈为稀释液,将38种农药及代谢物100 mg/L的标准溶液配制成1 mg/L的混合标准溶液,并逐级稀释配制成1、2、5、10、20、50、100和200 μg/L混合标准工作液,现配现用。
基质标准工作液:将空白样品按照2.3节样品前处理方法提取基质溶液,配制7.5×10-3、1.5×10-2、3.75×10-2、7.5×10-2、0.15、0.375、0.75和1.5 mg/kg基质标准工作液,用于绘制定量分析的工作曲线,临用现配。
2.3 样品前处理
茶叶样品经组织匀浆机粉碎后,在-18℃下冷冻保存,称取2 g匀质样品(精确到0.01 g)至50 mL具塞离心管内,加入5 mL超纯水,振荡混匀,静置20 min,加入15 mL 0.1%甲酸-乙腈溶液,振荡混匀,加入盐包,剧烈振荡,涡旋振荡3 min,4000 r/min离心5 min,将Sin-QuEChERS Nano净化柱垂直塞入离心管内,缓慢下压净化柱顶部,使得离心管内的上层有机提取液自下而上穿过净化柱内的阻水滤片和柱填料,最终进入到 Sin-QuEChERS 储液槽内,混匀净化液后,用移液枪从净化柱储液槽内取1 mL净化上清液,过0.22 μm有机滤膜至进样瓶,供UHPLC-Q-Orbitrap MS分析。
2.4 仪器分析条件
2.4.1 色谱条件色谱柱: Thermo Accucore aQ(150 mm×2.1 mm,2.6 μm),柱温: 30℃; 流动相A: 0.1%(V/V)甲酸-水(含5 mmol/L甲酸铵),流动相B: 甲醇; 梯度洗脱程序: 0~1 min,10% B; 1~3 min, 10%~75% B; 3~4 min,75%~100% B; 4~10 min,100% B; 10~11 min,100%~10% B; 11~16 min,10% B。进样量: 5 μL,流速: 0.3 mL/min。
2.4.2 质谱条件离子源: 加热的电喷雾离子源(HESI); 质量分析器: Orbitrap; 离子源温度: 350℃; 离子传输金属毛细管温度: 325℃; 喷雾电压: 3.5 kV; 透镜电压: 60 V; 鞘气流速: 40 arb,辅助气: 10 arb; 扫描模式: Full MS-ddMS2; 采集范围:m/z100~900; 一级全扫描分辨率为70000 FWHM; C-trap最大容量(ACG target): 1×106; C-trap最大注入时间200 ms; 数据依赖二级子离子全扫描(dd-MS2)分辨率: 17500 FWHM; C-trap最大容量(ACG target)5×105; C-trap最大注入时间60 ms; 归一化碰撞能量(NCEs): 40 eV; 动态排除: 5 s.各农药的质谱信息见电子版文后支持信息表S1。
3 结果与讨论
3.1 质谱条件的选择
在设定的扫描范围(m/z100~900)内,通过全扫描提取的母离子精确分子量所得的色谱峰面积进行定量分析,通过保留时间和数据依赖子离子扫描(ddMS2)所得的二级质谱离子进行定性分析。相同精确分子量的乙硫甲威和灭虫威,通过不同的保留时间和特征碎片离子m/z107.04927和121.06472区分。质量精度是评价准确定性和定量的重要因素,实测精确分子量与理论分子量之间的相对偏差越小,表示高分辨率质谱的灵敏度越高[27,28]。如表1所示,各农药的相对质荷比偏差小于3.8×10-6,可利用此方法得到的精确分子量, 对目标物进行定性和定量分析。
3.2 色谱条件的优化
为获得较好的分离效果和灵敏度,考察了不同色谱柱和流动相对目标物的影响。比较了AcclaimTMPolarAdvantage Ⅱ C18(PA2)(100 mm×2.1 mm,3 μm)和Thermo Accucore aQ(150 mm×2.1 mm,2.6 μm)分析柱。结果表明,两根色谱柱上物质均有保留,但C18柱分离时,百治磷峰前伸,毒虫畏的顺反异构体不能完全分离; Accucore aQ色谱柱分离较好,峰形尖锐,且各物质的响应值均高于107。考察了水相中加入甲酸、甲酸铵对目标物离子化效率和灵敏度的影响,结果表明, 0.1%(V/V)甲酸-5 mmol/L甲酸铵溶液对目标物的分析灵敏度最好。其次,以甲醇和乙腈为有机相,但乙腈条件下对氧磷等物质的响应降低10倍。因此,选用0.1%(V/V)甲酸-5 mmol/L 甲酸铵溶液和甲醇为流动相。采用梯度洗脱程序,16 min内, 各物质能较好分离。图1为基质标准溶液中部分农药的离子流图。
3.3 前处理条件的优化
本方法涵盖的农药种类较多且极性范围较广(lgKow=-0.74~6.37),因此在提取和净化时需要充分考虑各化合物的极性。由于氨基甲酸酯类农药对pH值较敏感,酸性条件下较稳定,碱性条件下易分解,所以分别考察乙腈和含0.1%甲酸-乙腈溶液对各化合物回收率的影响。 如图2A所示,加入适量酸后,35种物质的回收率均在70%~120%之间。因此,本方法选择0.1%甲酸-乙腈溶液作为提取溶剂。
QuEChERS方法提取时,加入适量水利于有机溶剂与样品充分接触, 提高提取效率[29],以获得较好的回收率,但加入水量过多, 也会导致水溶性色素等基质的溶出。 本实验采用Sin-QuEChERS方法是基于QuEChERS方法基础上开发的单步净化方法。比较了加入0、5和10 mL水对目标物回收率的影响, 如图2B所示,加入5 mL水的实验组的提取效率高于其余两组,且不加水组回收率>120%的农药有14种。 综合考虑,本方法选择提取时加入5 mL超纯水。
净化体积是影响净化效率的重要因素,也进一步影响测定结果的准确性。考察了Sin-QuEChERS Nano柱净化不同体积(1和3 mL)的提取液对38种农药及代谢物的提取回收率影响。如图2C所示,净化体积为1 mL时,38种农药及代谢物的回收率在70%~120%范围内的数目最多(30种),占总数的79%。比较净化后的提取液颜色发现,随着净化体积增大,净化液颜色逐渐加深,同时,部分农药(如茚虫威等)的回收率降至50%以下。为保证茶多酚、生物碱和色素等基质净化效果,以及各组分的回收率均高于65%,最终选择净化体积为1 mL。
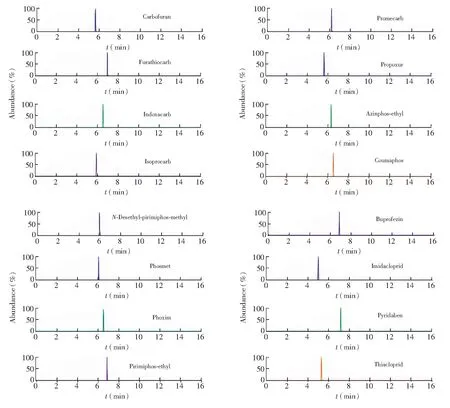
图1 基质标准溶液中农药的提取离子流图Fig.1 Extracted ion current chromatograms of pesticides in matrix matched calibrated solution
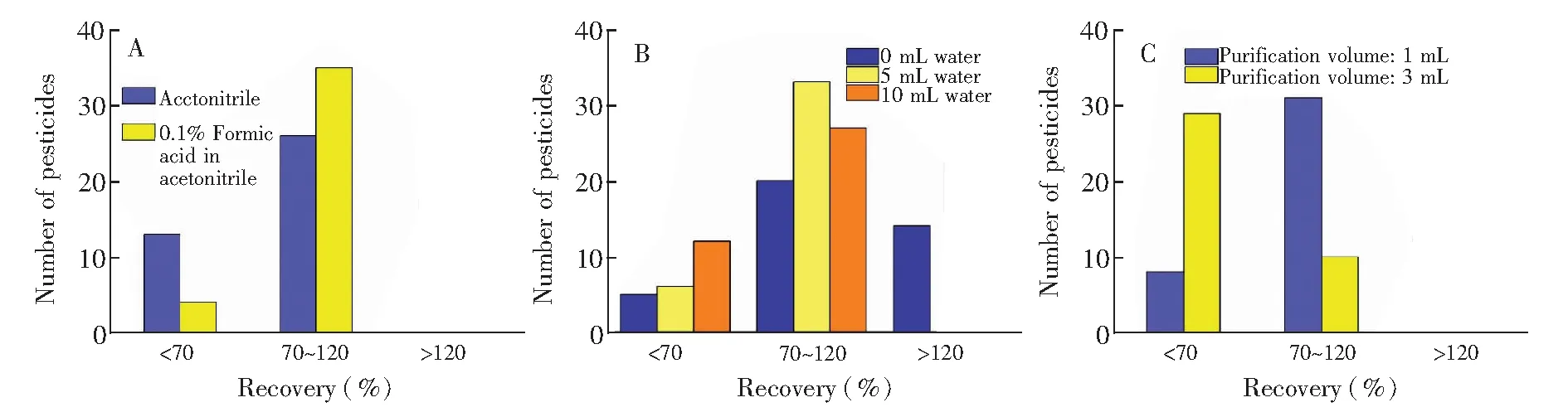
图2 溶剂种类(A)、 加入水的体积(B)和净化体积(C)对茶叶中38种农药及代谢物回收率的影响Fig.2 Recovery of 38 kinds of pesticides and metabolites in tea sample with (A) different extraction solvents (n=3), (B) different volume of water (n=3) and (C) different purification volume (n=3)
3.4 基质效应
基质效应(Matrix effect,ME)是与目标物共同洗脱并干扰质谱仪电离过程的基质物质引起的,抑制或增强目标物的检测信号[30], 可影响仪器的灵敏度和分析结果的准确性。采用2.2节基质匹配和纯溶剂标准曲线,并采用公式(1)计算ME:
ME(%)=[(S1/S2)-1]×100%
(1)
其中,S1为基质匹配标准曲线斜率;S2为纯溶剂标准曲线斜率。
通常, |ME|≤10%时,基质效应可忽略不计; |ME|在10%~20%之间时,存在较弱的基质效应; |ME|>20%时,存在强基质效应。
实验结果表明,23种化合物的|ME|为10%~20%, 10种物质的|ME|≤10%, 87%以上农药受基质效应的影响很小。 吡丙醚等5种物质的具有较强的基质效应, |ME|>20%。因此,为校正基质效应的影响,在定量分析中使用基质匹配标准曲线。本实验的ME评价结果与其它使用Sin-QuEChERS Nano净化柱提取辣椒及其调味品[31]、枸杞[32]中农药残留的结果具有一致性,样品中的基质物质净化效果较好。
3.5 方法评价与质量控制
采用空白茶叶基质液配制系列基质匹配标准工作溶液,以各组分的峰面积(y)对质量浓度(x)绘制标准曲线。各农药组分在合适的线性范围内线性关系良好,相关系数R2>0.99。在空白茶叶样品中添加目标物的标准溶液,以3倍信噪比(S/N=3)对应的浓度为方法检出限(LOD),10倍信噪比(S/N=10)对应的浓度为定量限(LOQ); 按照本方法添加标准溶液,并进行添加回收率测定。3个添加水平0.01、 0.02和0.05 mg/kg,每个水平重复5次。除乙硫甲威和蝇毒磷外,其余物质的回收率为68%~115%,相对标准偏差(RSD)为0.4%~18.9%, 定量限为0.005~0.020 mg/kg。 说明本方法可用于茶叶中多种农药残留和代谢物的检测分析,符合有关标准和法规的要求。方法的分析性能和加标回收实验结果见电子版文后支持信息表S2。
3.6 实际样品分析
茶园采摘的丹桂、金牡丹品种的37种秋季绿茶样品, 采用本方法对其潜在残留农药进行快速筛查分析,以一级精确分子量、同位素丰度比和二级特征碎片离子为筛查条件。若同时满足一级精确分子量偏差<1×10-5、 同位素丰度比>90、至少1个特征碎片离子与数据库二级谱图相匹配等条件, 即为通过快速筛查。结果表明,实际样品中共检出10种残留农药,如克百威、哒螨灵等,均满足限定筛查条件。图3为阳性样品中提取的吡虫啉色谱图和质谱图。
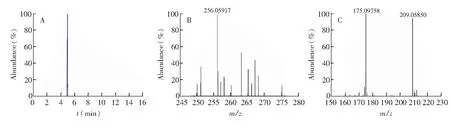
图3 阳性样品中吡虫啉的色谱图(A)、一级质谱图(B)和二级质谱图(C)Fig.3 Chromatogram (A), mass spectrum (B) and secondary mass spectrum (C) of imidacloprid in positive samples
利用标准品对快速筛查通过的残留农药进行进一步确证和定量分析,结果如表1所示,主要检出6种氨基甲酸酯类和4种烟碱类农药,其中甲萘威、异丙威、灭蚜磷、联苯肼酯、虫酰肼5种农药虽检出,但浓度均低于定量限。检出浓度较高的农药为速灭威、哒螨灵和吡虫啉,残留浓度分别为0.07、2.21和0.24 mg/kg。以上检出农药中,甲萘威、克百威、哒螨灵和吡虫啉在国标GB 2763-2019中规定的MRL分别为5、0.05、5和0.5 mg/kg,其余未规定MRL值; 按照国标要求,均未超标。欧盟规定的MRLs为: 速灭威0.01 mg/kg, 哒螨灵和吡虫啉为0.05 mg/kg; 分别有8个、2个和3个样品超出欧盟标准限值。定量分析结果表明,本实验建立的非靶向快速筛查方法可高通量、快速筛查绿茶中潜在的残留农药。
表1 茶叶中农药的分析结果
Table 1 Analytical results of pesticide in tea samples
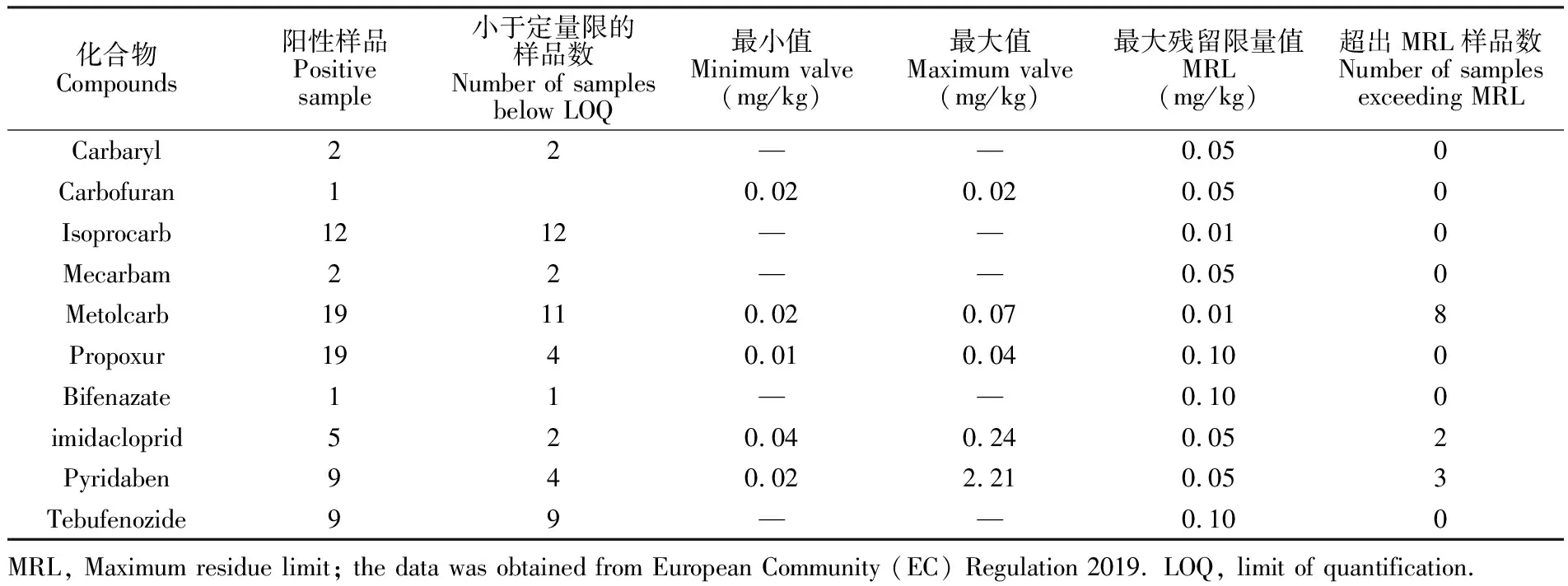
化合物Compounds阳性样品Positivesample小于定量限的样品数Number of samplesbelow LOQ最小值Minimum valve(mg/kg)最大值Maximum valve(mg/kg)最大残留限量值MRL(mg/kg)超出MRL样品数Number of samplesexceeding MRLCarbaryl22——0.050Carbofuran10.020.020.050Isoprocarb1212——0.010Mecarbam 22——0.050Metolcarb19110.020.070.018Propoxur1940.010.040.100Bifenazate11——0.100imidacloprid520.040.240.052Pyridaben940.022.210.053Tebufenozide99——0.100MRL, Maximum residue limit; the data was obtained from European Community (EC) Regulation 2019. LOQ, limit of quantification.
4 结 论
建立了Sin-QuEChERS结合UHPLC-Q-Orbitrap MS法非靶向快速筛查绿茶中多种农药残留检测方法。样品经Sin-QuEChERS Nano净化柱单步净化去除茶多酚、茶碱等干扰物质,简化了前处理步骤,并有效提高了净化效率。应用本方法可在16 min内完成茶叶中多农残的快速非靶向筛查以及残留水平的定量分析。以母离子的精确分子量、同位素丰度比、特征碎片离子为筛查条件与商业化数据库匹配,非靶向快速筛查并结合标准品定量分析其残留水平。本方法具有前处理简单、净化效率高、高通量、分析准确等优点, 且非靶向分析可以有效减少茶叶中多农药残留检测中标准品用量,为茶叶中潜在农药残留快速筛查和分析提供了技术支持。

