吉林省玉米种植区土壤真菌群落多样性变化及其驱动因子
王媛媛, 王继岩, 焉 莉, 高 强, 韩 旭
(1.吉林省商品粮基地土壤资源可持续利用重点实验室 吉林农业大学 资源与环境学院,吉林 长春130118; 2.生态环境部环境规划院总量控制与排放交易研究中心 北京 100000)
土壤是植物赖以生存的基础,土壤微生物对外界的感知能力极为敏感,不仅是评价土壤肥力的主要指标,也是土壤生态系统的重要组成。土壤微生物群落反映的土壤质量和生态系统变化是判定土壤的性质和生态功能的重要指标[1]。真菌是土壤中的主要分解者之一,对外界变化更为敏感、直观,可以通过调节土壤中营养元素的周转,影响养分资源的分配和化学组成[2]。同时,土壤真菌与土壤生态环境具有复杂的相互作用,其群落结构组成和多样性因不同管理措施、地理环境、植被类型、土壤肥力、pH值、温度、降水等综合因子的改变而发生相应的变化[3]。Thormann等[4]研究发现,土壤真菌群落受土地利用方式和管理模式等因素的影响,且真菌降解土壤有机质的能力要远远超过细菌的降解能力;Shen等[5]研究表明,土壤电导率和pH值在一定程度上影响土壤的真菌群落组成。真菌与自然环境以及田间管理等人为因素存在代谢、交流、转化等相互作用[6]。Illumina MiSeq高通量测序技术相对于微生物稀释平板菌落计数法、Biolog,PLFA分析法等,具有局限性小、准确率高、灵敏度好及单次分析样品量大等优点[7],是近年来分析土壤真菌和细菌等微生物群落结构组成和相对丰度的重要工具。
目前,对于土壤微生物群落结构和功能的研究引起了越来越多专家学者的关注,杨泽良[8]对玉米地根际土壤微生物群落结构研究发现玉米真菌与土壤养分没有显著相关性,与pH值呈负相关。程跃扬[9]研究土地利用方式对土壤真菌群落结构的影响发现碱解氮是影响真菌结构与功能类群的主要因素。在土壤微生物中,真菌在有机质分解、土壤肥力演变、土壤结构形成等方面发挥重要作用,其群落结构及多样性与土壤生态系统健康密切相关[10]。目前大多数研究主要针对小范围的相同气候条件下土壤微生物的影响因子分析,但对于空间区域性条件下不同气候因子和土壤养分对土壤微生物群落结构的差异性及相关性的影响鲜为报道。为此,本研究依据吉林省地形地貌、气候条件及玉米种植区特点,将吉林省划分为东部湿润山区、中部半湿润平原区和西部半干旱平原区3个种植区[11-12],以吉林省玉米种植区土壤为研究对象,分析种植区土壤理化性质及酶活性特征,探讨环境因子及土壤养分对吉林省土壤微生物真菌群落结构的影响,寻找影响吉林省玉米种植区土壤真菌群落结构的主要驱动因子,为吉林省土壤质量恢复提供一定的理论依据。
1 材料与方法
1.1 研究区域
吉林省土地面积约1.87×107hm2,属温带大陆性季风气候,四季分明,年平均降水量为400~600 mm,日照时数为2 259~3 016 h。本研究将吉林省玉米种植带分为东部湿润山区、中部半湿润平原区和西部半干旱平原区3个种植区。东部湿润山区的年均温度在2.9~5.5 ℃,年降雨量均值为735.08 mm,有效积温均值为2 569.25 ℃,无霜期均值为132 d;中部半湿润平原区的年均温度在4.3~6.4 ℃,年降雨量均值为605.41 mm,有效积温均值为2 826.41 ℃,无霜期均值为142 d;西部半干旱平原区的年均温度在4.3~5.8 ℃,年降雨量均值为442.43 mm,有效积温均值为2 949.76 ℃,无霜期均值为143 d。
1.2 土壤样品采集
本研究采样点主要位于东部湿润山区的通化市、白山市和延边市;中部半湿润平原区的四平市、长春市、辽源市和吉林市;西部半干旱平原区的白城市和松原市。采样时间是2018年的6—7月,采用五点采样法,采样深度0—20 cm,共采集了3个种植区的72份土壤样品,每份样品3次重复,以保证试验的准确度。采集后的土壤样品一部分过筛2 mm,风干保存,用于测定土壤理化性质和酶活性;另一部分置于-80 ℃冰箱进行高通量测序。
1.3 测定项目与方法
(1) 土壤理化性质测定指标:测定方法参考《土壤农化分析》[13],pH值—电位法(水土比2.5∶1)、有机质—重铬酸钾(外加热法)、碱解氮—碱解扩散法、速效磷—钼锑抗比色法(碳酸氢钠浸提)、速效钾—火焰光度法(乙酸铵浸提)。
(2) 土壤酶活性测定指标:脲酶活性—苯酚钠—次氯酸钠比色法[14]、蔗糖酶活性-3,5-二硝基水杨酸比色法[15]、磷酸酶活性—磷酸苯二钠比色法[15]。
(3) 土壤真菌高通量测序分析:保存于-80 ℃冰箱中的土壤样品首先参照Fast DNA SPIN试剂盒(MP Biomedicals,美国)说明提取土壤总DNA,然后采用真菌特异引物(ITS1/ITS2)对样品进行扩增,真菌ITS片段采用正向引物ITS1(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和反向引物ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)扩增,采用Illumina Miseq平台对PCR扩增产物进行高通量测序。
1.4 数据分析
使用Canoco4.5软件进行CCA分析,采用Excel制表并作图分析真菌门、纲、属相对丰度,利用SPSS 19.0做单因素方差及差异性分析。
2 结果与分析
2.1 土壤化学性质
通过吉林省不同玉米种植区土壤化学性质(图1)分析可知,不同种植区土壤化学性质差异性显著。吉林省玉米种植区土壤pH均值为6.58,且呈现自东向西逐渐增加的趋势;有机质均值为13.11 g/kg,碱解氮均值为111.93 mg/kg,速效磷均值为35.42 mg/kg,速效钾均值为128.08 mg/kg,其含量均呈现自东向西逐渐降低的趋势。各种植区主要土壤类型有所不同,东部湿润山区的有机质及速效养分含量较高,土壤类型以暗棕壤和白浆土为主;中部半湿润平原区有机质含量相对较高,以黑土为主;西部半干旱平原区肥力相对较低,以黑钙土为主。
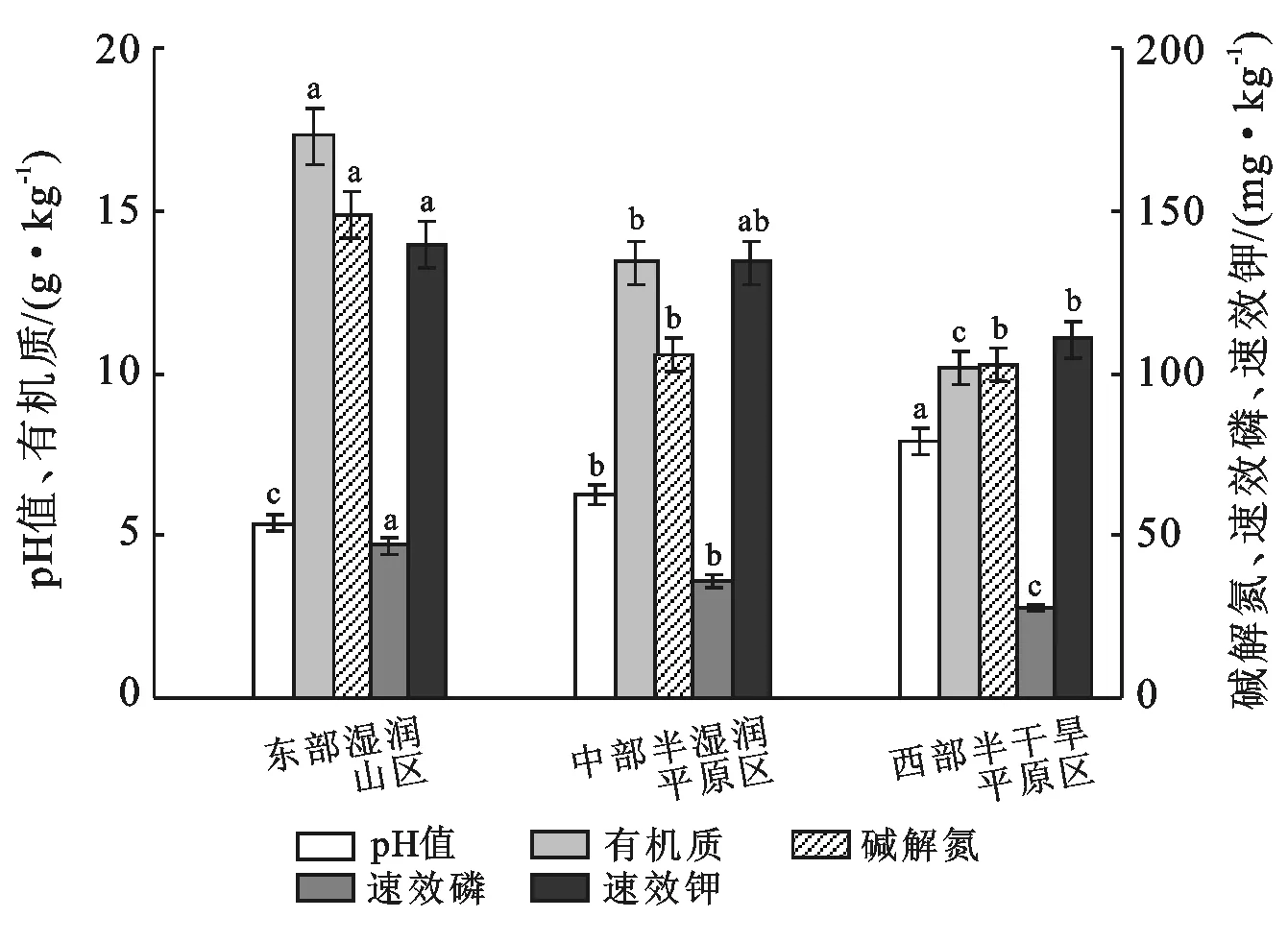
注:不同小写字母表示在5%水平上差异显著。下同。
2.2 土壤酶活性
从图2可知,吉林省玉米种植区土壤的脲酶活性为36.6 mg/(g·d),东部湿润山区和西部半干旱平原区的脲酶活性显著高于中部半湿润平原区;蔗糖酶活性均值为120.7 mg/(g·d),呈现自东向西逐渐减少的趋势。磷酸酶活性与土壤pH值有一定相关,东部湿润山区的pH值偏酸性,酸性磷酸酶含量最高;西部半干旱平原区pH值偏碱性,碱性磷酸酶活性显著高于其他两种植区。

图2 吉林省不同玉米种植区土壤酶活性
2.3 土壤真菌群落Alpha多样性指数
由表1可知,通过Chao1指数和ACE指数可知,东部湿润山区的土壤真菌丰富度显著小于西部半干旱平原区和中部半湿润平原区。根据吉林省各种植区的Chao1和ACE变异系数可看出,西部半干旱平原区的变异系数最小,说明西部半干旱平原区的样本相对中部和东部种植区来说更为均匀。Shannon和Simpson指数的侧重点有所差异,前者侧重于物种丰富度,后者则侧重于物种均匀度;3个玉米种植区土壤真菌群落Simpson指数的平均数都为0.95,变异系数均小于5%;Shannon指数平均数在5.94~6.16之间且变异系数均较低,说明吉林省3个种植区的真菌多样性差异不显著。
2.4 土壤真菌群落结构组成
在门水平分类上(图3),土壤真菌丰度较高的前9个门种类分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、结核菌门(Zygomycota)、壶菌门(Chytridiomycota)、隐真菌门(Rozellomycota)、虫门(Cercozoa)、纤毛门(Ciliophora)、球囊菌门(Glomeromycota)、新丽鞭毛菌门(Neocallimastigomycota)。从真菌门水平相对丰度图中可知,子囊菌门(69.34%~77.98%)和担子菌门(14.83%~23.88%)为吉林省3个玉米种植区土壤真菌的优势菌门,西部半干旱平原区的子囊菌门显著高于中部半湿润平原区,而担子菌门与之相反;3个种植区的结核菌门也存在显著差异,呈自东向西逐渐降低的趋势。

表1 吉林省不同玉米种植区土壤真菌群落Alpha多样性指数

图3 真菌门水平相对丰度
纲水平分类上选取丰度排名前20的物种,其中粪壳菌纲(Sordariomycetes)的相对丰度最高,为主要优势菌纲;其次为银耳纲(Tremellomycetes)、散囊菌纲(Eurotiomycetes)、伞菌纲(Agaricomycetes)和座囊菌纲(Dothideomycetes),其丰度均大于5%。粪壳菌纲和座囊菌纲呈现自东向西逐渐增加的趋势,散囊菌纲呈现自东向西逐渐降低的趋势,而银耳纲和伞菌纲表现为中部半湿润平原区最高。
属水平上真菌丰度较高的有酵母菌属(Guehomyces,3.06%~8.83%)、青霉菌属(Penicillium,1.50%~5.40%)和被孢霉属(Mortierella,1.82%~5.66%),其中酵母菌属为主要的优势菌属。中部半湿润平原区相对丰度较高的菌属有酵母菌属、青霉菌属、腐殖霉属、被孢霉属和香笔属,其属所占比例均大于2%。东部半湿润山区相对丰度较高的菌属有酵母菌属、腐殖霉属、被孢霉属、假裸囊菌属、曲霉属、木霉属和粗糙孔菌属。而西部半干旱平原区相对丰度较高的菌属为酵母菌属、青霉菌属、金担子菌属、茎点霉属和支顶孢属。3个种植区排名前20的菌属一致,说明3个种植区的真菌群落结构较为相似,但不同种植区的优势菌属含量有细微差异。由图4可知,吉林省3个种植区中,中部半湿润平原区的酵母菌属和腐殖霉属含量最高,青霉菌属、茎点霉属和金担子菌属呈现自东向西逐渐增加的趋势,被孢霉属、曲霉属真菌、假裸囊菌属和木霉属呈现自东向西逐渐减少的趋势。

图4 真菌属水平相对丰度
2.5 环境因子对土壤真菌群落组成的影响
为进一步研究吉林省不同玉米种植区土壤真菌群落组成与环境因子的关系,采用典范对应分析方法,对土壤化学性质、酶活性、气候因子(积温、无霜期、年均降雨量和年均温度等)与土壤真菌群落的关系进行研究,寻找影响土壤真菌群落组成的驱动因子。通过图5可知,气候因子中积温、无霜期和年均温度对土壤真菌微生物群落结构影响程度最高,土壤化学性质中pH值对土壤的影响程度最高。年均降雨量(rainfall)、酸性磷酸酶(ACP)、中性磷酸酶(NP)、碱解氮(AN)、速效磷(AP)、速效钾(AK)、脲酶活性(urease activity)和有机质(OM)之间夹角为锐角,pH值、积温(accumulated Tep)、年均温度(Tep)、碱性磷酸酶(ALP)之间,pH值与蔗糖酶(sucrase activity)之间均为锐角,表明这几种环境因子之间呈正相关关系,可能具有一定的协同效应。从吉林省玉米不同种植区的真菌群落分布看,西部半干旱平原区的土壤样品大部分分布在横坐标轴的负方向,东部湿润山区的土壤样品真菌分布主要在CCA横坐标轴的正方向,而中部半湿润平原区的土壤样品真菌分布主要集中在坐标轴附近。西部、东部和中部种植区样本真菌分布有很大部分重合,说明3个地区有很大的相似性;但东部和西部相对距离较远,说明两个种植区中的土壤微生物真菌群落结构又有各自相对独特的特点。

注:Accum Tep代表积温; FFP代表无霜期; Tep代表年均温度; Rainfall代表年均降雨量; ALP代表碱性磷酸酶活性; Sucrase Activity代表蔗糖酶活性; Urease Activity代表脲酶活性; NP代表中性磷酸酶活性; OM代表有机质含量; AN代表碱解氮含量; AK代表速效钾含量; AP代表速效磷含量。
3 讨 论
3.1 积温、无霜期和年均温度对土壤真菌微生物的影响
土壤微生物对不同环境因子的的响应存在差异性,真菌作为微生物区系的主要组成部分,是土壤生态系统健康与否的重要指标[16]。本研究发现积温、无霜期和年均温度是影响该区域土壤真菌群落结构的重要气候因子。3个种植区真菌群落有很大的相似性主要是由于他们有相似的区域气候特征,而差异性的存在可能主要是由于3个生态区不同的地形地貌的形成了各自小气候特征。东部地区隶属长白山脉海拔高,年均温度较低,无霜期较短;而中部地区属于世界黄金玉米带,气候条件非常有利于玉米生长,产量也是全省最高的地区;西部地区积温较高,年均温度与中部地区相似,但由于相对干旱且土壤大多为盐碱地而使得土壤微生物结构与中部也略有不同。有研究证明,温度对光合作用影响最大,温度升高影响了凋落物的数量和质量,增加了碳的有效性,增高C/N比值[17],明显提高土壤真菌的活性和丰富度[18],从而改变了土壤微生物群落的结构和功能。近年来,也有少数研究证明了积温[19]、年均温度[20]、无霜期[21]对作物产量的影响程度,与本研究结果相符。还有研究发现,土壤真菌对土壤温度、湿度、养分含量等因素的变化十分敏感[22],真菌群落结构及多样性也会受到季节变化的影响[23]。土壤真菌多样性与土壤生态环境密不可分,且土壤微生物群落结构主要受地理因素、土壤养分、管理模式以及气候条件等多种因素的影响,不同种植区的环境会导致土壤真菌种类和数量的差异性[24],这一结论与Davide等[25]研究结果一致。
3.2 pH值对土壤真菌的影响
土壤和植物间的相互作用可以直接或间接地影响土壤真菌群落组成和多样性,土壤的化学性质与真菌群落结构和多样性有着密切的联系。本次研究结果发现pH值是影响土壤真菌微生物群落结构的重要化学因素。这与韩世忠等[26]人的研究结果一致。同样,王楠楠等[27]人的研究均证明了土壤pH值对土壤真菌群落结构与组成影响显著。巨天珍等[28]研究认为,真菌更喜欢在偏酸性的土壤中生存。地理因素和人为因素都会在一定程度上导致土壤质量发生变化,例如,施肥可以改变土壤的特性,长期施用氮肥造成土壤pH值下降,有机质含量下降,土壤中真菌群落密度增加[29],长期施用有机肥也会引起土壤微生物组成差异,提高土壤中微生物群落多样性[30],显著降低土壤真菌与细菌的比率,从而改变真菌和细菌的群落结构[31]。也有相关研究认为[32],土壤碱解氮含量也是导致土壤真菌群落变化的重要因素。真菌群落结构必然会受到土壤环境因子的直接或间接的影响,但就本研究而言,土壤pH是导致吉林省不同种植区玉米主产区真菌群落结构和多样性变化的重要化学驱动因素。
4 结 论
积温、无霜期和年均温度是影响吉林省玉米种植区土壤真菌优势类群变化的主要气候驱动因子;pH值是主要化学驱动因子。随着全球气候变暖,气候变化将不可避免,同时由于施肥影响,土壤多呈酸化趋势,随之必将带来土壤微生物环境的变化,进而影响土壤质量和作物生产。因此应多关注吉林省玉米种植区土壤真菌群落变化趋势,以便采取合理的管理措施以改善并恢复土壤质量。

