α-亚麻酸乙酯(75%)急性毒性和遗传毒性研究
吴超权,周 智,韦奇志,方珍文,陈长艳,杨桥樱,秦秀娟
(广西食品药品检验所,广西 南宁 530021)
α-亚麻酸是人体必需的不饱和脂肪酸,需从日常饮食中获取,α-亚麻酸在体内可转变为具有显著生理活性的EPA(二十碳五烯酸)和DHA(二十二碳六烯酸),具有降血脂、降胆固醇、抗血栓形成等作用[1]。欧美和日本等国家已经立法,将α-亚麻酸作为药物或食品添加剂,用来预防心血管疾病、癌症、老年痴呆、视力低下等病症。α-亚麻酸乙酯与α-亚麻酸有同样的生理功能,且α-亚麻酸乙酯的化学稳定性更好,应用于保健食品的开发前景广阔。但其毒理学和安全性评价方面的研究不足,国内鲜有报道。因此,本文对α-亚麻酸乙酯进行急性毒性和遗传毒性研究,为α-亚麻酸乙酯作为保健食品原料进一步开发利用提供可靠的毒理学依据。
1 仪器与材料
1.1 仪器
HH-S恒温水浴(江苏金坛医疗仪器厂);BD240生化培养箱(德国宾德公司);CHA-S气浴恒温振荡器(常州国华);KS130C振荡器(艾卡仪器设备公司);TD5A-WS台式低速离心机(湖南湘仪);50I荧光显微镜(尼康);BX63全自动智能型数字显微镜(奥林巴斯);CX31显微镜(奥林巴斯)。
1.2 试药
α-亚麻酸乙酯(75 %)(河北欣奇典,批号:20150407),置阴凉干燥处储藏,每次开封后充入氮气密封保存;玉米胚芽油[嘉里粮油(防城港),批号:20150105];营养肉汤培养基(广东环凯,批号:0570201);顶层琼脂培养基(Solarbio,批号:20150119);Vogel-Bonner(V-B)培养基E(自配);L-组氨酸(国药集团,批号:20150213);D-生物素(国药集团,批号:20150223);葡萄糖(天津大茂,批号:20150201);Aroclor 1254诱导雄性SD大鼠肝脏微粒体酶S9及辅助因子(冻干型S9混合液,Moltox公司,批号:3726);胎牛血清[Gibco by Life Technological Corporation (USA)];吉姆萨染液(北京索莱宝公司);环磷酰胺(Roche);甲醇(国药集团);1 %伊红染液(Roche);纯化水(自制)。
1.3 菌株
鼠伤寒沙门菌回复突变试验用菌株TA97a,TA98,TA100,TA102(Moltox公司,中国代理商:上海宝录),-80 ℃储藏。
1.4 实验动物
KM小鼠,SPF级,雌雄兼用,由广西食品药品检验所实验动物中心提供,生产许可证号SCXK桂2014-0001,动物饲养于本所屏障环境动物实验室(使用许可证号SYXK 桂2014-0002);温度20~25 ℃,相对湿度58 %~70 %;饲喂小鼠生长繁殖饲料(北京科奥协力饲料有限公司,生产许可证号SCXK京2014-0010)及灭菌生活用水。
2 方法[2]
2.1 急性毒性试验
KM小鼠20只,雌雄各半,体重18.1~20.8 g,按性别分笼群养;禁食不禁水16 h后,按20 ml/kg以样品直接灌胃1次。观察灌胃后14 d内小鼠的全身反应及死亡情况,存活的动物按性别计算增重值及增重率。
2.2 Ames试验
取经鉴定符合要求的鼠伤寒沙门菌组氨酸缺陷型TA97a,TA98,TA100,TA102。试验时以溶媒将样品α-亚麻酸乙酯(75 %)分别配制成50,10,2,0.4,0.08 mg/ml的供试液,供试液无悬浮和沉淀物。试验菌株37 ℃增菌培养10 h,将顶层琼脂培养基2.0 ml分装于试管,每管依次加入试验菌液0.1 ml、样品溶液0.1 ml、S9混合液0.5 ml(需代谢活化时),混匀后迅速倾入底层琼脂平板,使形成5000,1000,200,40,8 μg/皿的供试物剂量,倒置于培养箱中37 ℃孵育48 h。每试样检查皿加或不加S9混合液均做3个平行皿,记录每组回变菌落数,重复1次。同时设溶媒对照、自发对照、阳性诱变剂对照组。数据统计:记录每皿回变菌落数,并求平均值和标准差。结果判定:受试物组回变菌落数增加一倍以上,并有剂量-反应关系,或某一测试点有可重复的阳性结果,即可认为受试物诱变试验阳性。阳性诱变剂使用种类和剂量见表1。
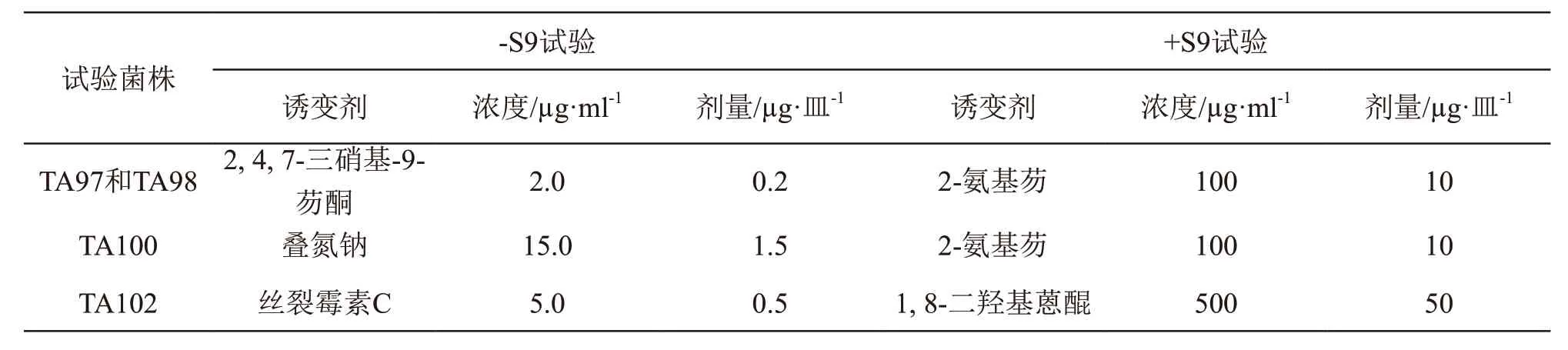
表1 阳性诱变剂对照物及剂量
2.3 小鼠骨髓细胞微核试验
以玉米胚芽油将样品α-亚麻酸乙酯(75 %)分别配制成0.5,0.25,0.125 g/ml,取KM小鼠60只,雌雄各半,体重26~29 g,分笼群养,按体重、性别随机分成6组,分别为α-亚麻酸乙酯10,5,2.5 g/kg 3个剂量组、环磷酰胺40 mg/kg阳性对照组、玉米胚芽油溶媒对照组和纯化水阴性对照组。各组动物分别给予受试物2次,间隔24 h,灌胃量均为20 ml/kg,灌胃前16 h动物禁食不禁水。第2次给药后6 h,颈椎脱臼处死小鼠,随即剖取股骨,用胎牛血清冲洗骨髓腔收集骨髓细胞,冲洗液经离心制成浓度适中的细胞悬液,涂片,甲醇固定7 min,吉姆萨染液染色15 min,超纯水冲洗、晾干;镜下观察嗜多染红细胞和成熟红细胞,每只动物计数1000个嗜多染红细胞,观察含有微核的嗜多染红细胞数,微核率用千分率表示;每只动物计数200个嗜多染红细胞,同时记录成熟红细胞,计算嗜多染红细胞与成熟红细胞(PCE/NCE)比值。采用双侧t检验分析处理数据,结果判定:样品组与溶媒对照组相比,微核率有明显剂量反应关系且差异具有统计学意义时,可确认为阳性结果。若统计学差异有统计学意义,但无剂量反应关系时,则须进行重复试验,结果能重复者可确定为阳性。
2.4 小鼠精子畸形试验
以溶媒将样品α-亚麻酸乙酯(75 %)分别配制成0.5,0.25,0.125 g/ml,取雄性小鼠30只,体重27.4~33.1 g,分笼群养,随机均分为6组,每组5只,分别为α-亚麻酸乙酯10,5,2.5 g/kg 3个剂量组、环磷酰胺40 mg/kg阳性对照组、玉米胚芽油溶媒对照组和纯化水阴性对照组。采用灌胃方式每天给予受试物1次,20 ml/kg,连续5 d。于首次给予受试物后的第35天,颈椎脱臼处死小鼠,随即剖取两侧附睾,放入有适量生理盐水(约2 ml)的平皿中。用眼科剪将附睾纵向剪1~2刀,静止3~5 min,轻轻摇动,用4层擦镜纸过滤,吸滤液涂片。空气中干燥后,用甲醇固定15 min,充分干燥,置1 %伊红染液中染色1 h,用水轻轻冲洗,晾干。在低倍镜下寻找背景清晰、精子重叠较少的部位阅片,用高倍镜顺序检查精子形态。每只动物计数结构完整的精子1000个,观察精子的畸形情况,畸形类型可分为无钩、香蕉形、胖头、无定型、尾折叠、双头、双尾等。采用Wilcoson秩和检验分析处理数据。结果判定:样品组与溶媒对照组比较,精子畸形率为溶媒对照组的倍量或差异有统计学意义,并有剂量反应关系,判定为精子畸形阳性。
3 结果
3.1 急性毒性试验
灌胃后至14 d内小鼠的外观、活动、进食、排泄等均未见明显异常;无死亡现象;小鼠体重增长情况正常,见表2。结果表明,小鼠一次性灌胃给予α-亚麻酸乙酯(75 %),未见明显的急性毒性反应,最大耐受量大于20 ml/kg BW(17.62 g/kg BW)。按急性经口毒性分级标准,样品属于无毒级(LD50>15 000 mg/kg为无毒级)。
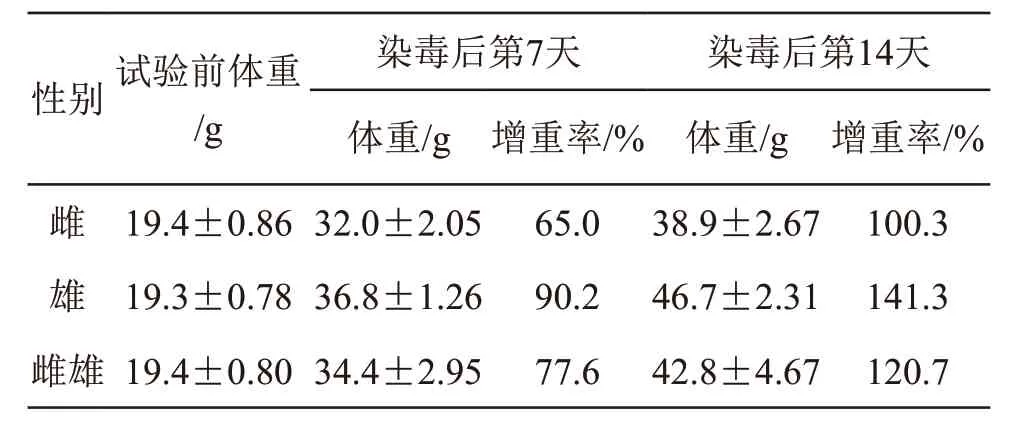
表2 α-亚麻酸乙酯(75 %)小鼠经口急性毒性试验体重增长情况
3.2 Ames试验
结果见表3。样品剂量为5000,1000,200,40,8 μg/皿对上述4个试验菌株加S9或不加S9,回变菌落数与溶媒对照相近,差异无统计学意义(P>0.05),亦无剂量-反应关系,未超出自发回变数的2倍,表明样品在加S9或不加S9的条件下,对4个菌株的诱变结果呈阴性。提示样品对鼠伤寒沙门菌无明显致突变性。
3.3 小鼠骨髓细胞微核试验
结果见表4、表5。与溶媒对照组比较,α-亚麻酸乙酯3个剂量组微核率基本一致(P>0.05);各剂量组的骨髓PCE/NCE比值均在正常范围,均不低于溶媒对照组的20 %,α-亚麻酸乙酯3个剂量组骨髓PCE/NCE比值与溶媒对照组比较,差异无统计学意义(P>0.05);表明样品的小鼠骨髓细胞微核试验结果为阴性,样品对小鼠骨髓PCE/NCE比值无明显影响。按性别分别统计分析,结果相同。

表3 α-亚麻酸乙酯(75 %)Ames试验的菌株回变结果(n=6)
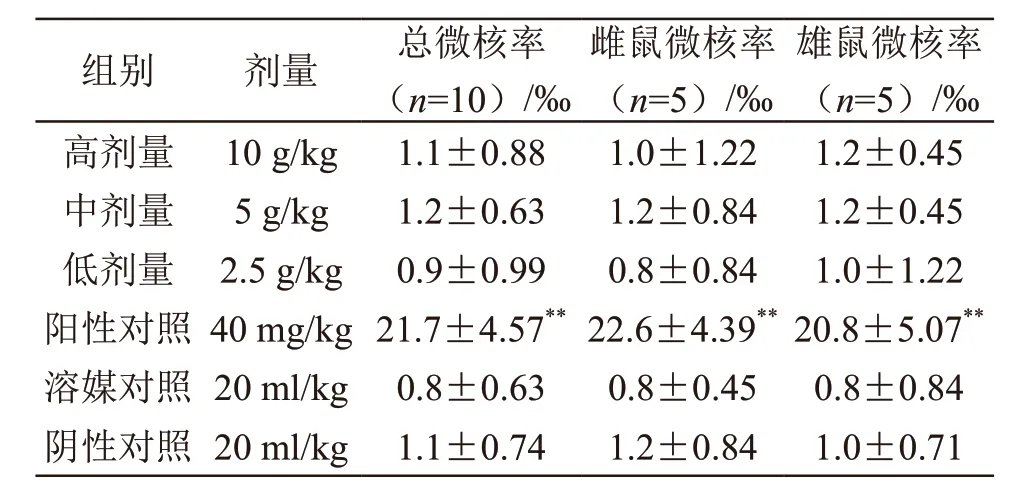
表4 α-亚麻酸乙酯(75 %)对小鼠骨髓嗜多染红细胞微核率的影响

表5 α-亚麻酸乙酯(75 %)对小鼠骨髓PCE/NCE比值的影响
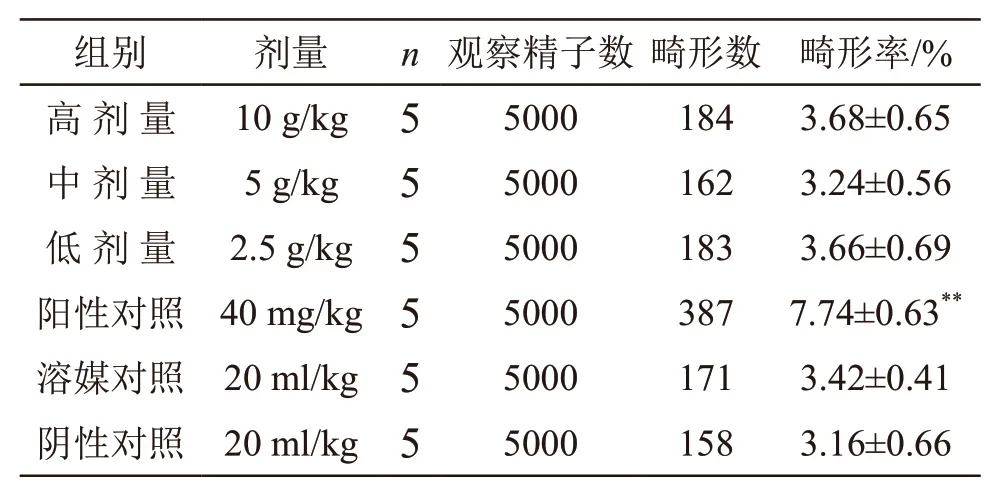
表6 α-亚麻酸乙酯(75 %)小鼠精子畸形试验结果
3.4 小鼠精子畸形试验
结果见表6。由表6可见,α-亚麻酸乙酯3个剂量组的小鼠精子畸形率与溶媒对照组比较,差异无统计学意义(P>0.05),表明样品的小鼠精子畸形试验结果为阴性,提示样品对小鼠精子无明显致畸作用。具体精子畸形类型数量及比值见表7。
4 讨论
近年α-亚麻酸乙酯逐渐引起国际社会的关注,因其具有降血脂、保肝护肝、预防心血管疾病、抗血栓形成、预防老年痴呆、预防肝病、促进小儿大脑发育等功能,具有广阔的开发前景[3-7]。但其安全性评价鲜有报道。
本研究结果提示:α-亚麻酸乙酯(75 %)的急性毒性最大耐受量大于17.62 g/kg BW;各剂量组对4种组氨酸缺陷型鼠伤寒沙门菌株在存在或不存在S9代谢活化系统两种条件下,回变菌落数与溶媒对照组相近,差异无统计学意义,亦无剂量-反应关系,未超出自发回变数的2倍,表明样品在加S9或不加S9的条件下,对4个菌株的诱变结果呈阴性;α-亚麻酸乙酯(75 %)各剂量组的微核率与溶媒对照组比较,差异无统计学意义,表明其小鼠骨髓细胞微核试验结果为阴性;α-亚麻酸乙酯(75 %)各剂量组的精子畸形率与溶媒对照组比较,差异均无统计学意义,表明其小鼠精子畸形试验结果为阴性。本研究表明α-亚麻酸乙酯(75 %)属于无毒级,鼠伤寒沙门菌回复突变、骨髓细胞微核、小鼠精子畸变试验3项试验结果均为阴性,未见遗传毒性作用。

表7 α-亚麻酸乙酯(75 %)小鼠精子畸形试验畸形类型及比值

