红花尔基樟子松优良抗旱菌树组合的筛选
赵 敏 郝文颖 宁心哲 郝龙飞 闫海霞 牟亚男 白淑兰*
(1.内蒙古农业大学林学院,呼和浩特 010019; 2.呼伦贝尔市林业科学研究所;海拉尔 021008; 3.呼和浩特市环境监测中心站,呼和浩特 010030)
为了保证生态系统的良好功能,树木根系和外生菌根真菌(ectomycorrhizal fungi,ECMF)的互惠互利作用是必不可少的[1~2]。外生菌根能改善宿主植物的营养和水分状况,改良土壤结构,提高植物的生长速率和根系功能[3],增强植物的抗逆性[4]。尤其在干旱退化生态系统中表现更为突出,ECMF在长期的进化过程中形成了对干旱胁迫的耐受性,并作用于植物,增强植物对干旱环境的生态适应性和可塑性[5],从而提高植物的抗旱能力,使植物更好地存活[6]。
红花尔基林区属于寒温带大陆性干旱气候,该区森林茂密、物种丰富,形成了特殊的沙地樟子松(Pinussylvestrisvar.mongolica)群落及生态系统,是我国北方重要的生态屏障[7],这里被誉为樟子松的故乡,也是国家定点的三北防护林种子基地之一。但近几年来该区降雨量骤减,出现了樟子松大面积死亡现象。2016年本研究团队在出菇盛期对红花尔基樟子松林内ECMF资源进行调查时并没有采到一株ECMF。所以,我们分析在极度干旱的环境中,ECMF资源也在不断枯竭。众所周知,樟子松是典型的菌根依赖性树种[8],那么如何提高樟子松在日益干旱环境中的生存能力是生产实践中亟待解决的问题。因此,本研究在实验室条件下通过对樟子松幼苗接种5种ECMF,并分别测定其在非干旱胁迫和干旱胁迫条件下各项生理生化指标,试图筛选出樟子松优良抗旱菌树组合,最终为樟子松菌根化苗木的定向培育以及樟子松逆境造林提供理论依据。
1 材料与方法
1.1 试验材料
研究供试樟子松种子采自于红花尔基健壮的樟子松林中(47°36′~48°35′N,118°58′~120°32′E)。供试菌种均采自于红花尔基樟子松林地内,选择5个优势菌株通过子实体组织分离获得菌种,菌种保存于4℃冰箱中(表1)。

表1 供试菌种名录
1.2 试验方法
1.2.1 幼苗培育
挑选饱满成熟的樟子松种子,在温水中浸泡12 h,再用2%高锰酸钾消毒30 min,用蒸馏水冲洗4~5次后放入已经灭菌的铺有两层湿吸水纸的培养皿中,置于25℃恒温培养箱内恒温催芽。育苗基质为经过高温高压(0.1 MPa,121.0℃,40 min)蒸汽灭菌的蛭石、泥炭、林地土及沙土(各基质体积比为1∶1∶1∶1)。育苗盆用3%的H2O2进行消毒,然后放入灭菌基质,选发芽一致、健壮的芽苗播入其中,然后置于光照培养室内培养。
1.2.2 菌剂制备
采用MMN培养基制备固体菌剂。按配方配制适量的营养液[9],再与蛭石混拌均匀,水分含量70%,然后装入玻璃瓶进行高温高压灭菌(0.1 MPa,110℃,40 min)。冷却后放入超净工作台内接入生长健壮的平板菌,最后于25℃恒温培养箱内培养。在培养45 d后各菌种菌丝长满瓶,黄褐口蘑的菌丝呈白色微黄,其他4个菌种菌丝均呈纯白色。
1.2.3 幼苗的接种与培养
试验选用内径15 cm,高12 cm规格的育苗盆,先在育苗盆底放入适量的灭菌基质,然后每盆放入15 g生长良好的菌剂,再将长势均匀的5个月龄樟子松盆栽苗栽入其中,每盆栽3株,尽量使幼苗根部与菌剂密切接触,以利于菌根的形成。然后覆土,使盆与基质总重量合计1 000 g。同时,设一对照处理,即将5种固体菌剂等量混合再经高温高压灭菌,冷却后将15 g接入同样规格的苗木,其他方法同上。即试验共设5个接种处理,1个对照处理,6个处理均设60个重复,然后置于光照培养室内培养(光照强度为16800 lx,光照时间为12 h·d-1,温度为25℃)。在苗木培育阶段,每两周浇一次10% Hogland营养液,每盆浇150 mL。
1.2.4 幼苗的干旱胁迫处理
接种8个月后,每个处理随机抽取5株幼苗进行菌根形态观察和菌根侵染率的统计,菌根形态采用解剖镜进行观察,菌根侵染率利用划线交叉法进行统计。然后结合苗木生长状况进行间苗,最终每盆只保留1株健壮苗木,各处理分别选择长势基本一致的50株对其进行非干旱胁迫和干旱胁迫处理,各25株。非干旱胁迫处理通过称重补水法在处理期间每天补充水分,保持含水量(65±5)%;干旱胁迫处理在培育8个月后开始停止浇水,模拟自然干旱胁迫。当某个处理幼苗的第一枚针叶出现萎蔫时(含水量为19.1%),随机抽取两种水分条件下各处理苗木进行各指标的测定。
1.2.5 苗木生长及生理生化指标的测定
每个处理非干旱胁迫与干旱胁迫分别抽取5株幼苗,用直尺测定苗高,将幼苗冲洗干净后,沿幼苗茎基部剪断,将地上部分和地下部分分别装入容器内,然后置于80℃烘箱内烘至质量恒定,分别测定地上、地下生物量,并计算根茎比。然后每个处理分别抽取10株幼苗采用邻本三酚自氧化法测定针叶超氧化物歧化酶(superoxide dismutase,SOD)活性,愈创木酚法测定针叶过氧化物酶(peroxidase,POD)活性,硫代巴比妥酸法测定针叶丙二醛(malonaldehyde,MDA)含量[10]。
1.2.6 针叶萎蔫时间及临界致死时间的测定
分别选择各处理10株干旱胁迫苗木进行针叶萎蔫时间及临界致死时间的测定。在干旱胁迫过程中,每6 h观察记录一次各处理针叶变化特征,当发现各处理的第一枚针叶出现萎蔫时即确定为萎蔫时间;并且持续观察记录各处理苗木在干旱胁迫条件下完全死亡的时间即确定为临界致死时间。
1.2.7 数据处理及分析
所有数据均采用Excel 2010进行统计;为了评估接种处理、水分处理,以及接种处理和水分处理的相互作用对樟子松幼苗各项指标的影响,利用SPSS 20.0软件对这些数据进行单因素方差分析和双因素方差分析,LSD多重比较检验显著性差异;然后使用OriginPro 8.0软件作图。
2 结果与分析
2.1 不同处理樟子松幼苗菌根侵染率与菌根形态
通过菌根侵染率统计、形态观察及分叉形状统计(表2)发现,5种ECMF均能与樟子松形成菌根,且菌根侵染率由大到小的趋势为:S.b>R.l>S.l>S.s>T.f,且S.b、R.l、S.l、S.s、T.f各处理的侵染率分别为80.0%、74.2%、72.4%、65.0%、37.4%;对照未形成菌根。此外,S.b与樟子松形成的菌根有棒状、二叉状和羽状,其中二叉状约占70%,棒状约占20%,羽状约占10%;R.l与樟子松形成的菌根呈棒状和二叉状,主要为二叉状,约占90%;S.l与樟子松形成的菌根为二叉状和棒状,各约占50%;S.s与樟子松形成的菌根以棒状为主,约占90%,二叉状约占10%;T.f与樟子松形成的菌根基本为棒状。而对照没有形成菌根,幼苗根系细长,粗细均匀,有明显的根冠和根毛。各菌种与樟子松根系形成的菌根形态如图1所示。
表2 各供试菌株对樟子松菌根侵染率及所形成菌根的分叉特征统计
Table 2 Statistics of mycorrhizal infection rate and bifurcation characteristic of mycorrhizal formation ofPinussylvestrisvar.mongolicaby various test strains
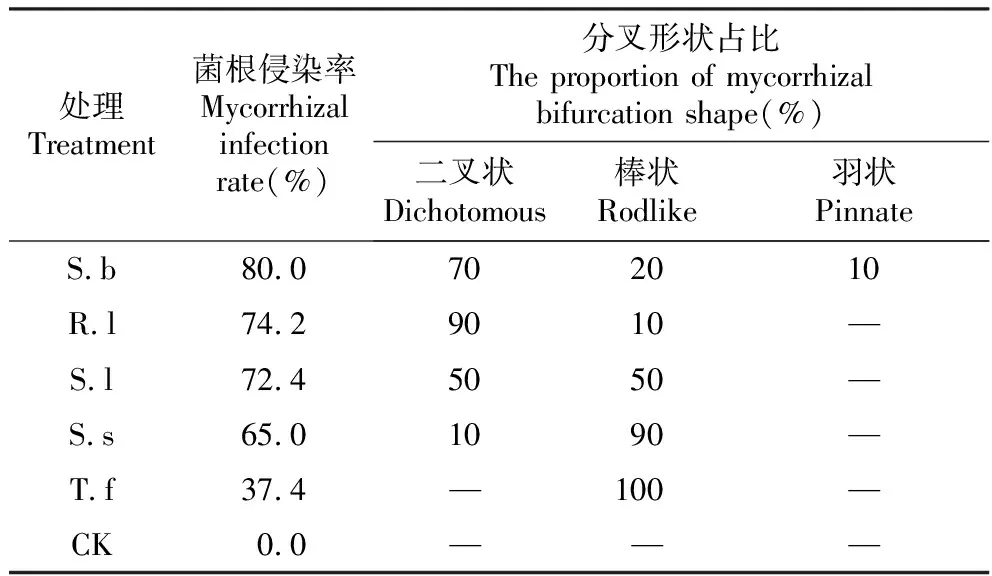
处理Treatment菌根侵染率Mycorrhizal infection rate(%)分叉形状占比The proportion of mycorrhizal bifurcation shape(%)二叉状Dichotomous棒状Rodlike羽状PinnateS.b80.0702010R.l74.29010—S.l72.45050—S.s65.01090—T.f37.4—100—CK0.0———
注:“—”表示未发现这样的菌根形态。
Notes:“—” indicates that no such mycorrhizal morphology was found.

图1 不同处理樟子松幼苗菌根形态Fig.1 Different treatments of mycorrhizal morphology of P.sylvestris var. mongolica
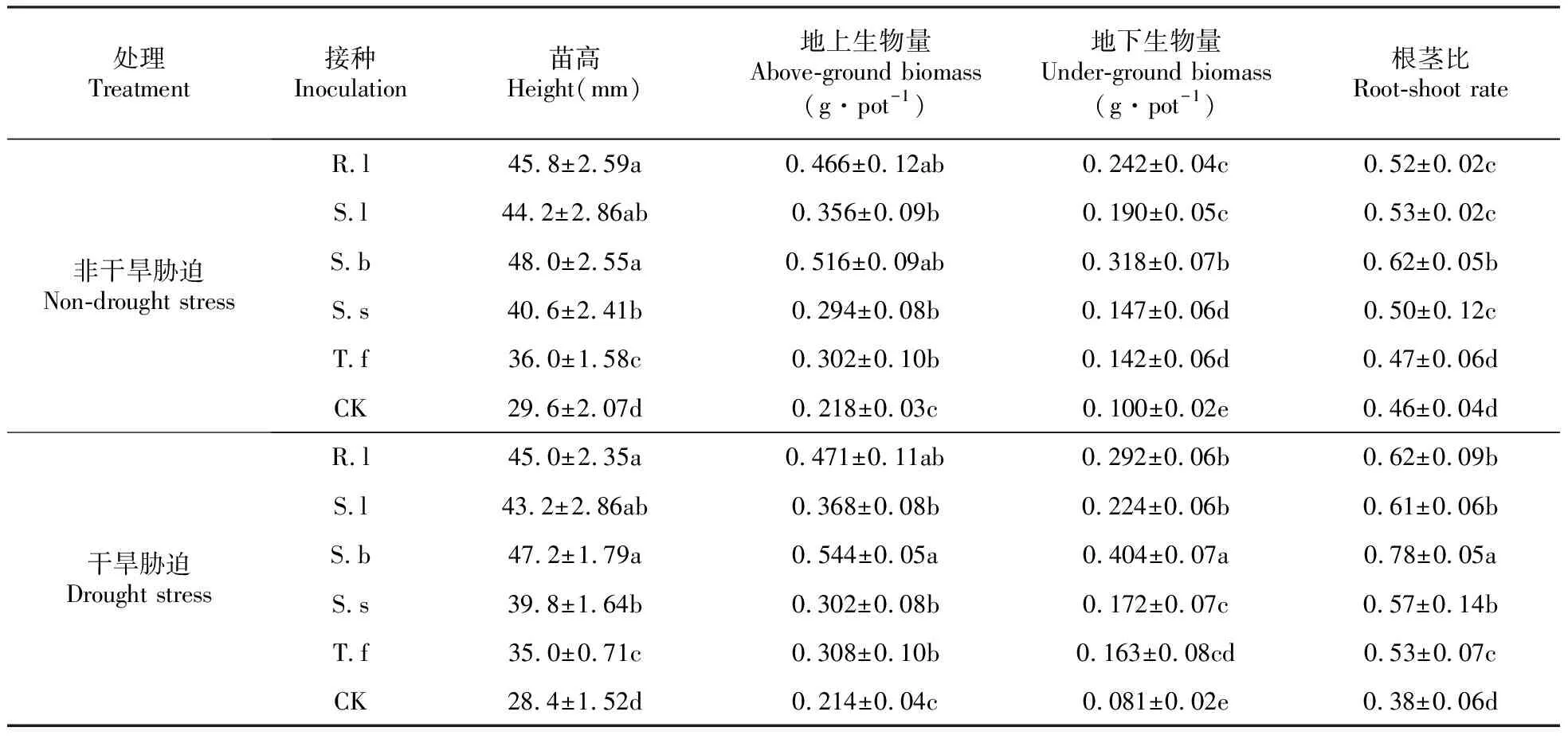
表3 不同水分处理对各处理樟子松幼苗生长的影响
注:表中同一列不同字母表示P<0.05差异显著。
Notes:Different letters in the same column indicate significant differences inP<0.05.
2.2 不同水分条件对各处理幼苗生长的影响
在两种水分条件下,接种处理的苗高、地上生物量与地下生物量均显著高于未接种处理(P<0.05)。在干旱胁迫条件下,R.l处理的地上和地下生物量较未接种处理分别增加120.1%和260.5%,S.l处理分别增加了72%和176.5%,S.b处理分别增加了154.2%和398.8%,S.s处理分别增加了41.1%和112.3%,T.f处理分别增加了43.9%和101.2%。
与非干旱胁迫相比,干旱胁迫条件下,各处理苗高与地上生物量差异不显著;而地下生物量有明显的变化,除T.f处理外,其余各接种处理的地下生物量均显著增加(P<0.05),增加幅度大小顺序为:S.b(27.0%)>R.l(20.7%)>S.l(17.9%)>S.s(17.0%);各接种处理的根茎比均显著增加(P<0.05),增加幅度大小顺序为:S.b(25.8%)>R.l(19.2%)>S.l(15.1%)>S.s(14.0%)>T.f(12.8%),但对照处理的这些生长指标较非干旱胁迫均下降(表3)。说明在干旱胁迫下,外生菌根对苗木地下生物量的积累表现出比非干旱胁迫条件下更明显的优势。根茎比是壮苗的重要标志,干旱胁迫下,菌根化苗木通过提高地下生物量促使形成发达根系来抵御干旱胁迫。因此,S.b对樟子松苗木的促生效果最好。
经双因素方差分析(表4)可知,接种处理对樟子松幼苗地上和地下生物量均产生极显著影响(P<0.001);而水分处理对其地下生物量发挥显著作用(P<0.05),但对其地上生物量并没有显著影响;接种处理和水分处理的交互作用对樟子松幼苗地下生物量产生极显著影响(P<0.001),而地上生物量在两者之间无显著的交互作用。
表4 接种处理与水分处理对樟子松生物量的双因素方差分析结果
Table 4 The results of two-way ANOVA of biomass ofP.sylvestrisvar.mongolicaby inoculation treatment and water treatment
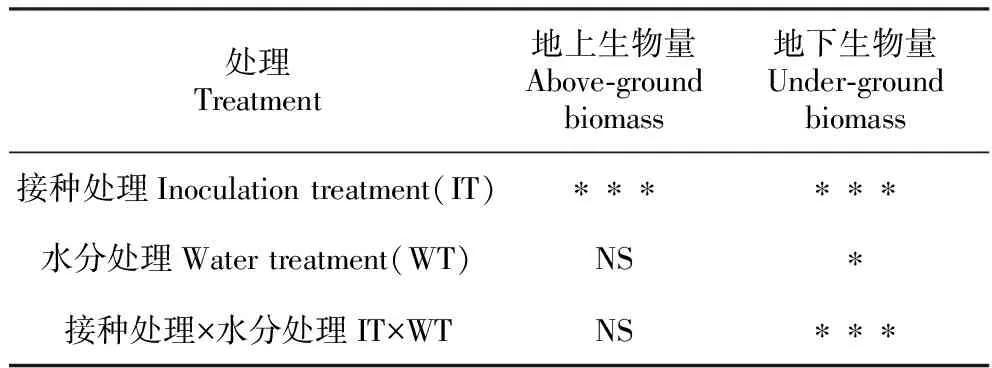
处理Treatment地上生物量Above-ground biomass地下生物量Under-ground biomass接种处理Inoculation treatment(IT)∗∗∗∗∗∗水分处理Water treatment(WT)NS∗接种处理×水分处理IT×WTNS∗∗∗
注:*.P<0.05差异显著;***.表示P<0.001差异极显著;NS.不显著
Note:*.P<0.05 is significant; ***.P<0.001 is extremely significant; NS. Not significant
2.3 不同水分对各处理樟子松幼苗SOD、POD活性和MDA含量的影响
在非干旱胁迫条件下,所有处理SOD活性无显著差异(图2)。在干旱胁迫条件下,所有处理SOD活性均显著升高,且接种处理SOD活性均显著高于未接种处理(P<0.05);同时,S.b处理SOD活性显著高于其他接种处理。与非干旱胁迫相比,干旱胁迫条件下,R.l、S.l、S.b、S.s和T.f处理分别升高了44.5%、42.5%、50.8%、39.7%和38.7%;而未接种处理仅升高了23.7%,升高的幅度显著低于接种处理。
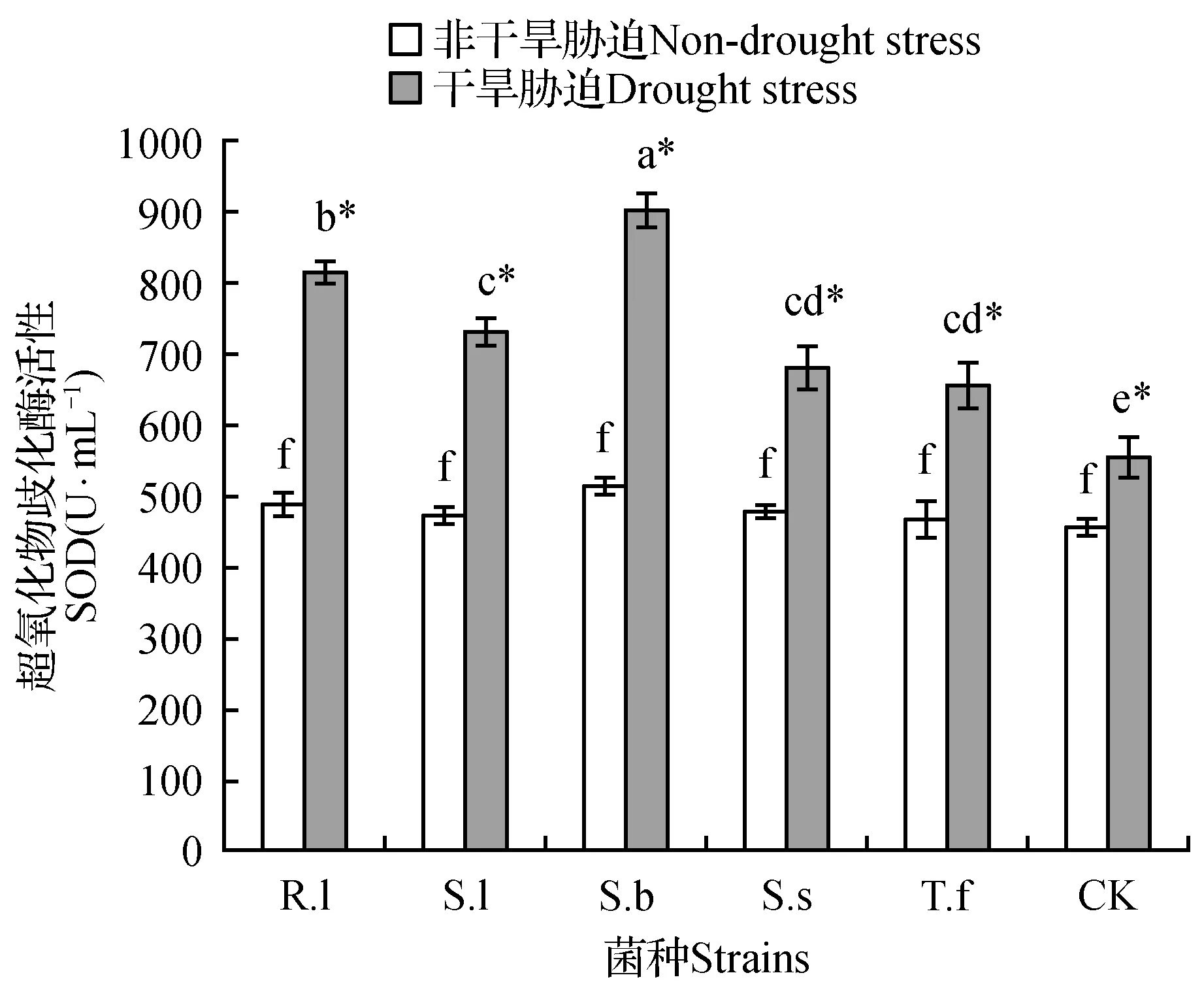
图2 不同水分条件对各处理樟子松幼苗SOD的影响柱状图中不同小写字母表示菌种间的差异显著性(P<0.05);*表示相同接种处理下,非干旱胁迫与干旱胁迫条件的差异显著性(P<0.05) 下同。Fig.2 Effect of different water condition on the activity of SOD enzyme of P.sylvestris var. mongolica in each treatment Different lowercase letters in the histogram indicate significant differences among strains(P<0.05); * indicates the significant difference between non-drought stress and drought stress conditions under the same inoculation treatment(P<0.05).The same as below.
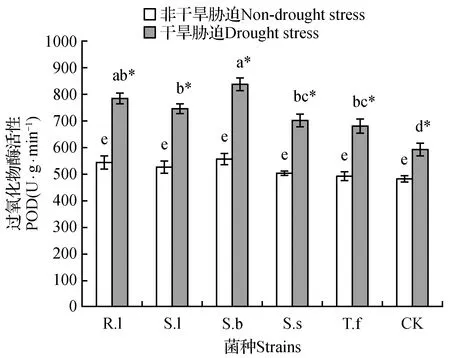
图3 不同水分条件对各处理樟子松幼苗POD活性的影响Fig.3 Effect of different water condition on the activity of POD enzyme of P.sylvestris var. mongolica in each treatment
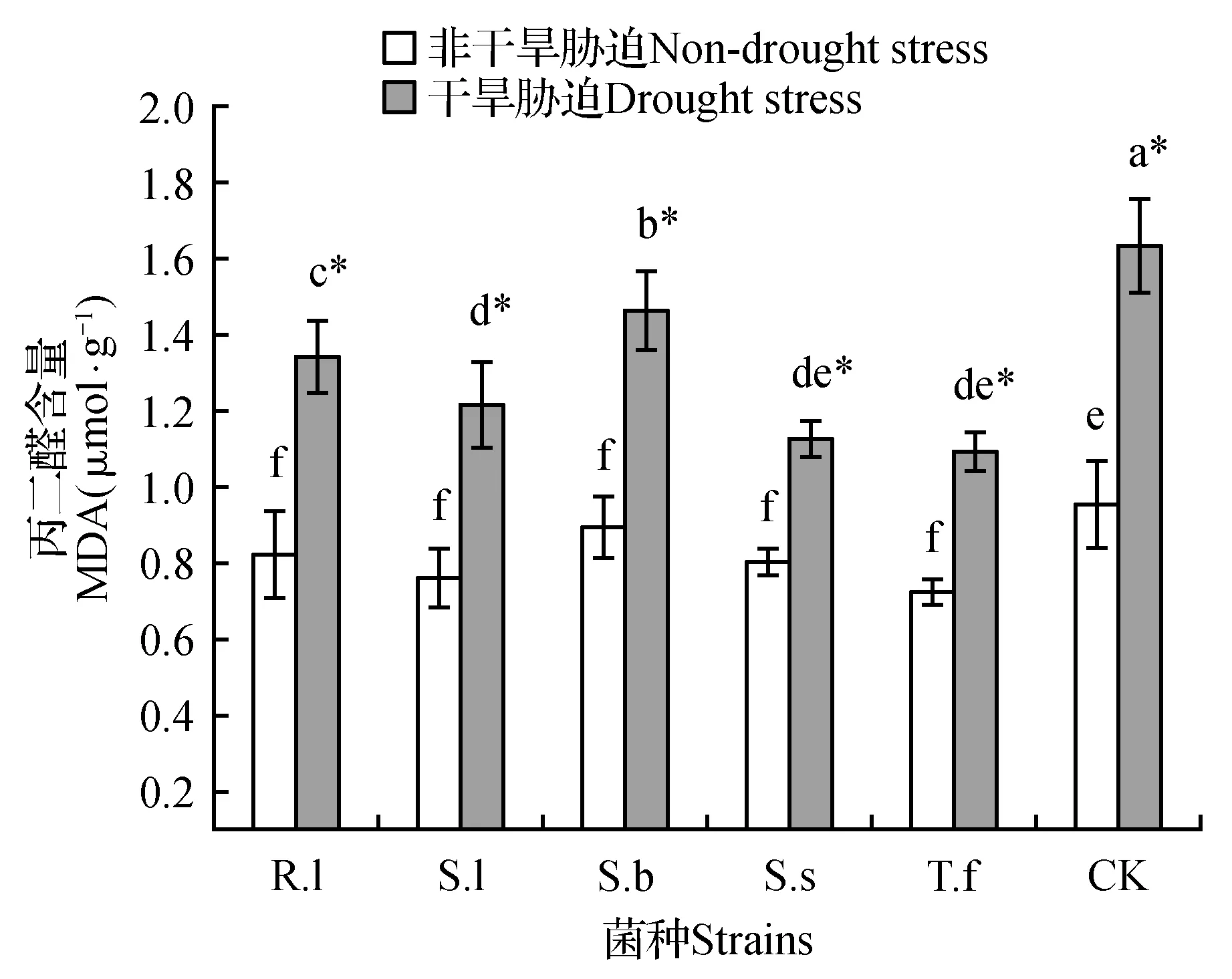
图4 不同水分条件对各处理樟子松幼苗MDA含量的影响Fig.4 Effect of different water condition on MDA content of P.sylvestris var. mongolica in each treatment
在非干旱胁迫条件下,各处理POD活性无显著差异(图3);在干旱胁迫条件下,各处理POD活性均显著升高,未接种处理POD活性显著低于各接种处理(P<0.05)。与非干旱胁迫相比,干旱胁迫条件下,R.l、S.l、S.b、S.s和T.f处理POD活性分别升高了67.1%、54.3%、75.8%、42.1%和40.3%;而未接种处理仅升高了22%,升高的幅度明显低于接种处理。干旱胁迫能引起植物体内活性氧升高,导致细胞膜受到损伤,影响细胞的正常生理功能,而抗氧化酶活性(SOD与POD活性)的升高有利于清除体内多余活性氧,从而降低植物机体的损伤程度,增强植物抗旱性;因此,说明菌根化樟子松幼苗的抗旱能力强于非菌根化苗木。
在非干旱胁迫条件下,接种处理MDA含量之间无显著差异;但未接种处理MDA含量显著高于各接种处理(图4)。在干旱胁迫条件下,各处理MDA含量均显著升高,且各接种处理MDA含量均显著低于未接种处理(P<0.05)。因此,在干旱胁迫条件下,菌根的存在能抑制樟子松体内丙二醛含量的积累。从而说明菌根的形成对植物逆境胁迫抗氧化产物的清除能力显著提高。
经双因素方差分析,接种处理与水分处理分别对樟子松幼苗POD活性、SOD活性与MDA含量产生极显著影响(P<0.001);而接种和水分的相互作用只对幼苗POD活性产生极显著影响(P<0.001);却不会影响幼苗SOD活性与MDA含量(表5)。
2.4 不同处理对樟子松幼苗萎蔫时间和临界致死时间的影响
在干旱胁迫下,与对照相比,所有接种处理的樟子松萎蔫时间和临界致死时间均显著推迟(P<0.05),推迟时间最长的均为S.b处理,分别推迟了96.3和113.8 h;推迟时间最短的均为T.f处理,也分别推迟了13.1和52 h。所以,菌根化苗木均能促使宿主忍耐干旱而延长萎蔫和死亡的时间。因此,在自然环境中,形成菌根能够使植物抵御一定时期的季节性干旱(表6)。
表5 接种处理与水分处理对樟子松抗氧化酶活性的双因素方差分析结果
Table 5 The results of two-way ANOVA of antioxidant enzyme activities ofP.sylvestrisvar.mongolicaby inoculation treatment and water treatment
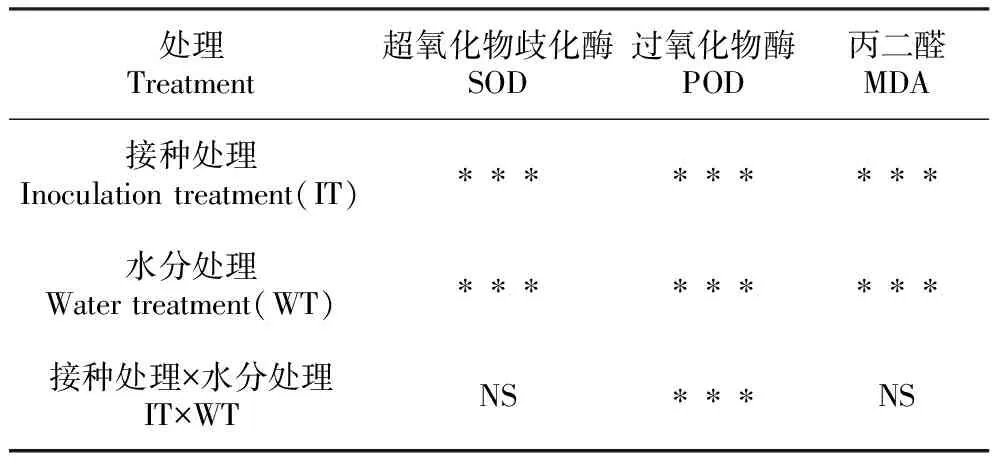
处理Treatment超氧化物歧化酶SOD过氧化物酶POD丙二醛MDA接种处理Inoculation treatment(IT)∗∗∗∗∗∗∗∗∗水分处理Water treatment(WT)∗∗∗∗∗∗∗∗∗接种处理×水分处理IT×WTNS∗∗∗NS
注:***.P<0.001差异极显著;NS.不显著
Note:***.P<0.001 is extremely significant; NS.Not significant
表6 干旱胁迫条件下不同处理对樟子松幼苗萎蔫时间和临界致死时间的影响
Table 6 Effect of different treatments on wilting time and critical dead time ofP.sylvestrisvar.mongolicaunder the condition of drought stress(h)
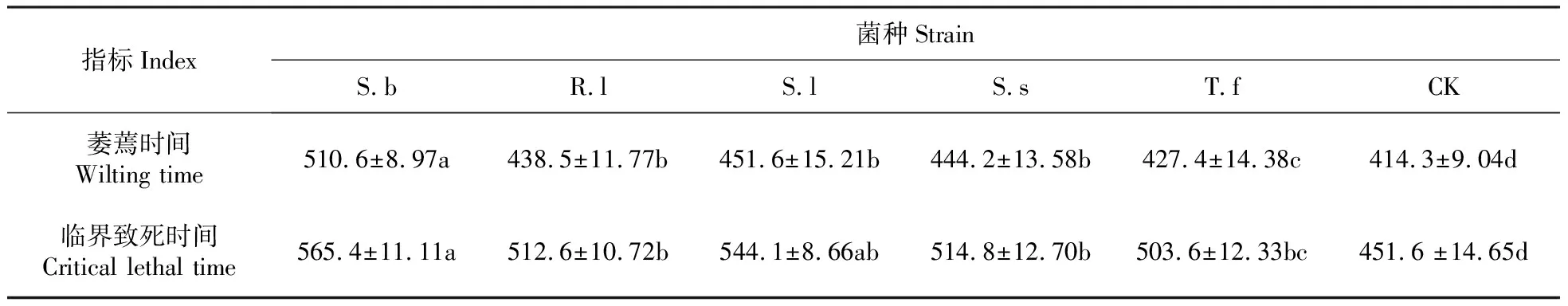
指标Index菌种StrainS.bR.lS.lS.sT.fCK萎蔫时间Wilting time510.6±8.97a438.5±11.77b451.6±15.21b444.2±13.58b427.4±14.38c414.3±9.04d临界致死时间Critical lethal time565.4±11.11a512.6±10.72b544.1±8.66ab514.8±12.70b503.6±12.33bc451.6 ±14.65d
注:同一行不同字母表示P<0.05差异显著。
Note:Different letters in the same line indicate significant difference inP<0.05.
3 讨论
干旱胁迫是限制植物生长与生存的一个重要因素[11],不同植物对干旱胁迫的响应不同。在非生物胁迫条件下,菌根共生效应是评估宿主植物生长状况的重要指标[12]。本研究中,菌根化樟子松幼苗的各项生长指标均显著高于对照,说明ECMF在不同程度上促进了樟子松苗木的生长,这可能是因为ECMF能够促进苗木对养分和水分的吸收[13]。这与Rui等[14]和Zhang等[15]对其他菌树组合的研究结果一致。本研究还发现,S.b处理的菌根侵染率最高,同时,其苗高和地下生物量均显著高于对照。因此,在一定程度上,菌根侵染率对苗木苗高和地下生物量具有积极的作用,这与Yin等[16]的研究结果相符。通过双因素方差分析得知,接种处理对樟子松幼苗地上生物量与地下生物量均产生极显著作用(P<0.001);而水分处理对其地下生物量产生显著作用(P<0.05),但对地上生物量影响不显著。这可能是因为在干旱胁迫下,菌根的存在有利于植物根系对水分吸收,从而增加地下生物量的积累,来增强植物的抗旱能力[17]。根茎比是评价苗木质量的一个重要指标,根茎比越大苗木对环境的适应力越强[18]。本研究发现,干旱胁迫下各接种处理的根茎比均显著高于未接种处理,Moser等[5]对樟子松幼苗的抗旱性研究也得出了这一结论,这可能是由于干旱胁迫下ECMF能诱导碳水化合物更多的流向植物根系,有助于植物根系对水分和养分的吸收,从而提高苗木养分状况和水分利用效率[19]。此外,在干旱胁迫下,各处理之间存在差异,这可能是因为不同菌种具有不同的养分吸收能力,也就是说不同菌种对干旱胁迫的耐受力不同[20]。
在植物遭受干旱胁迫时,其体内活性氧将显著增多,而活性氧的累积会直接引发或者加剧植物细胞膜的氧化损伤[21]。在这种情况下,植物将产生一套保护系统来清除多余的活性氧,以减轻对细胞膜的伤害,这套保护系统主要由酶促清除系统组成[22]。在本研究中,干旱胁迫下接种处理的SOD和POD活性均显著高于未接种处理;同时,各处理的这两种酶活性较非干旱胁迫条件下均显著提高。张中峰等[23]对接种彩色豆马勃(Pisolithustinctorius)的青冈栎(Cyclobalanopsisglauca)幼苗的研究也得出了一致的结果。MDA含量是植物细胞膜过氧化程度的体现,MDA含量越高,说明植物细胞膜过氧化程度高,受到的伤害越严重[24]。本研究发现,干旱胁迫下接种处理苗木的MDA含量显著低于未接种处理,说明苗木形成菌根后能抑制MDA的积累,且未接种处理细胞膜的损伤程度大于菌根化苗木,进而说明非菌根化苗木对干旱胁迫的耐受力较弱,这与Yin等[16]和李静[25]的研究结果一致。通过以上结果我们可以推测,ECMF共生体在干旱胁迫生境中增强了植物中SOD和POD活性,同时抑制了MDA含量的积累,从而增强了菌根化樟子松苗木的抗旱性。本研究结果显示,在干旱胁迫下,所有接种处理的樟子松苗木的萎蔫时间和临界致死时间均较未接种处理显著推迟。王琚钢等[26]对菌根化蒙古扁桃(Prunusmongolica)抗旱性的研究也发现,与CK相比,菌根苗叶片发生萎蔫的时间显著推迟。同时研究证实:S.b处理的这些指标都显著高于其他接种处理。因此,接种粘盖牛肝菌(S.b)的樟子松抗旱性最强,可以认为是一个较为理想的抗旱菌树组合。

