小儿脑性瘫痪TCD与CT诊断比较*
青海省西宁市中医院康复科(青海 西宁 810000)
王 伟 那 熹 马桂芳韩常安
脑性瘫痪(CP)是指在各种因素作用下发育期胎儿或婴儿出现非进行性损伤,引起运动和姿势紊乱,以及智力、感觉、行为异常,严重影响其身体健康和生活质量[1]。及时诊断对指导临床治疗、改善患儿预后有重要意义。头颅CT作为一种具备扫描速度快、分辨率高、无创等特点的检查方式,应用较为广泛[2]。经颅多普勒(TCD)可探查脑血流动力学状态,且具备无创、便捷等优势,对CP诊断亦有一定帮助[3]。对此,本研究观察TCD和CT在CP诊断中的应用情况,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2015年8月至2018年9月我院46例均接受TCD和CT检查的CP患儿临床资料,纳入研究组。纳入标准:符合《儿科学》(第8版)[4]中CP诊断、分型标准者;行TCD、CT检查者;自愿签订知情同意书者。排除标准:合并脑肿瘤等神经系统疾病者;临床资料不全者。将同期接受TCD检查的30例正常儿童纳入对照组。其中研究组男29例,女17例;年龄3个月~6岁,平均(2.25±1.54)岁;痉挛型24例,手足徐动型7例,肌张力低下型8例,混合型5例,未能分类型2例。对照组男18例,女12例;年龄4个月~6岁,平均(2.37±1.61)岁。2组性别、年龄等一般资料差异不显著(P>0.05)。
1.2 检查方法 TCD:使用德力凯EMS-9 TCD血流分析仪,2mHz脉冲多普勒探头;安静状态下小儿取仰卧位,通过颞窗、枕骨大孔窗探测双侧大脑大脑前动脉(ACA)、中动脉(MCA)、后动脉(PCA)及基底动脉(BA)平均血流速度(Vm)、血管阻力指数(resistance index, RI)、血管搏动指数(pulsatility index,PI)。CT:采用GE Lightspeed ultra 16排CT机;安静状态下小儿取仰卧位;常规头颅平扫,扫描参数:120kV,130mAs,层厚、层距10mm,0.5s/圈。哭闹不配合者于检查前约30min以10%水合氯醛0.5mL/kg灌肠。由2名具有副主任医师以上职称的影像科医师进行双盲观察、分析,协商统一结果。
1.3 统计学分析 数据分析用SPSS19.0软件处理,TCD、CT对CP检查异常率等分类资料以n(%)表示,采用χ2检验;Vm、RI、PI等连续性资料以()表示,采用t检验。P<0.05认为有统计学意义。
2 结 果
2.1 TCD、CT对CP检查异常率比较 TCD对CP检查异常率71.74%(33/46)与CT检查异常率67.39%(31/46)差异无统计学意义(χ2=0.205,P>0.05)。
2.2 研究组与对照组小儿脑血流动力学TCD检查结果比较 研究组小儿ACA、MCA、PCA及BA Vm均低于对照组,RI、PI均高于对照组(P<0.05)。见表1-4。
2.3 CP患儿CT检查结果 CT检查异常率67.39%(31/46),其中脑室扩大5例(16.13%),脑发育迟缓13例(41.94%),脑萎缩4例(12.90%),脑软化5例(16.13%),蛛网膜下腔变宽2例(6.45%),其他2例(6.45%)。
2.4 CP患儿CT图像分析 图1 男,2岁,双侧侧脑室前后角周围白质密度对称性减低。图2 男,1岁,脑室扩大,双侧大脑半球脑表面沟增多、加深,相应蛛网膜下腔变宽,双侧侧脑室前后角圆钝。图3 男,1岁,脑萎缩,脑白质变性,脑内见多发斑片状低密度影。图4 男,8个月,脑室系统稍扩大,双侧侧脑室前后角圆钝,室管膜下见斑点状、虚线状钙化影,前后角脑白质见小片状低密度影
3 讨 论
CP发病率在发达国家约为1‰~3.6‰,在我国约为2‰,并不少见[5]。相关研究显示,围生期脑损伤、脑发育异常以及绒毛膜羊膜炎、宫内发育迟缓等产前危险因素均于CP发生密切相关[6]。该疾病以非进行性运动发育异常为特征,可引起肌张力异常、姿势异常、反射异常等一系列表现,呈现较高的致残率[7]。对该疾病尽早明确诊断,及时采取适当的治疗措施,并定期随访掌握疾病情况,是使患儿获得良好预后的关键。
目前,大量研究显示CP患儿脑血流量显著低于正常儿童[8]。脑局部血流量变化与脑血流速度密切相关,脑血流Vm降低表明脑血管充盈度减弱,血流量减少,反之则表明脑血管充盈度高,血流丰富,RI反映血管阻力,PI反映血管的搏动性,主要用来评价大脑血管阻力和顺应性变化[9]。TCD可经颅无创检测脑血流动力学状态,具有其他脑血流量检测技术无法比拟的优势。本研究中,研究组小儿ACA、MCA、PCA及BA的血流平均速度Vm均低于对照组,RI、PI均高于对照组,显示CP患儿存在广泛性脑动脉血流动力学改变,颅内供血呈高阻力低灌注状态,大脑血供相较于正常小儿明显降低。Sands KA等[10]研究也显示,胚胎期至新生儿期窒息、核黄疸等情况均可造成神经组织损伤后对血管调节功能减退以及脑血管发育不良,进而导致颅内供血呈高阻力低灌注状态,引起CP。TCD可根据CP患儿脑血流动力学状态异常情况作出诊断。本研究中,TCD对CP检查异常率71.74%,对CP诊断有一定帮助。
表1 研究组与对照组小儿ACA Vm、RI、PI检查结果比较
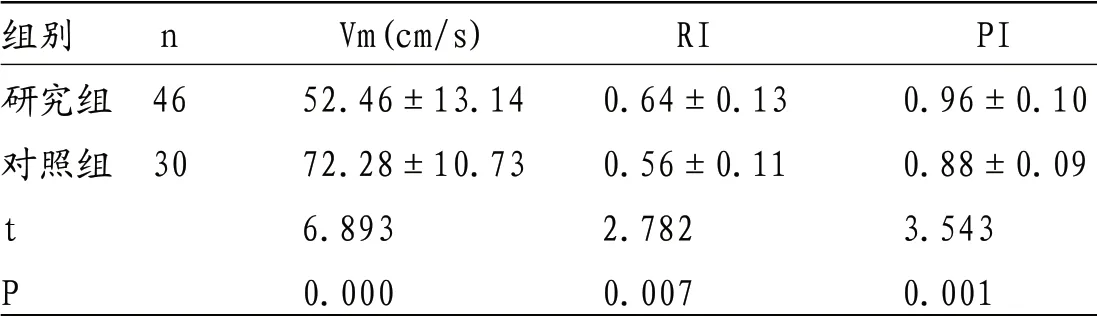
表1 研究组与对照组小儿ACA Vm、RI、PI检查结果比较
组别 n Vm(cm/s) RI PI研究组 46 52.46±13.14 0.64±0.13 0.96±0.10对照组 30 72.28±10.73 0.56±0.11 0.88±0.09 t 6.893 2.782 3.543 P 0.000 0.007 0.001
表2 研究组与对照组小儿MCA Vm、RI、PI检查结果比较

表2 研究组与对照组小儿MCA Vm、RI、PI检查结果比较
组别 n Vm(cm/s) RI PI研究组 46 61.42±8.45 0.61±0.12 0.88±0.15对照组 30 95.54±12.36 0.53±0.10 0.79±0.13 t 14.306 3.028 2.691 P 0.000 0.003 0.009
表3 研究组与对照组小儿PCA Vm、RI、PI检查结果比较
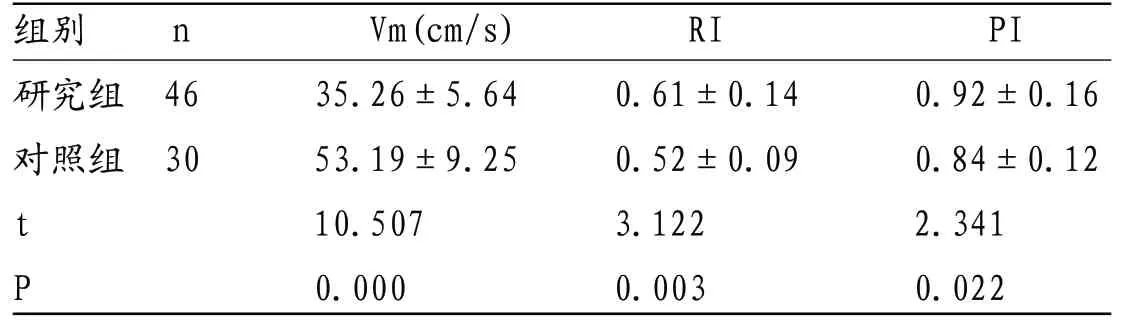
表3 研究组与对照组小儿PCA Vm、RI、PI检查结果比较
组别 n Vm(cm/s) RI PI研究组 46 35.26±5.64 0.61±0.14 0.92±0.16对照组 30 53.19±9.25 0.52±0.09 0.84±0.12 t 10.507 3.122 2.341 P 0.000 0.003 0.022
表4 研究组与对照组小儿BA Vm、RI、PI检查结果比较
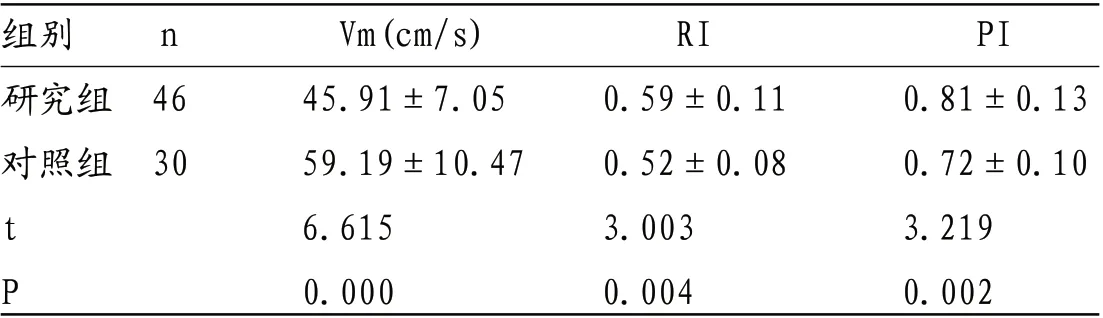
表4 研究组与对照组小儿BA Vm、RI、PI检查结果比较
组别 n Vm(cm/s) RI PI研究组 46 45.91±7.05 0.59±0.11 0.81±0.13对照组 30 59.19±10.47 0.52±0.08 0.72±0.10 t 6.615 3.003 3.219 P 0.000 0.004 0.002
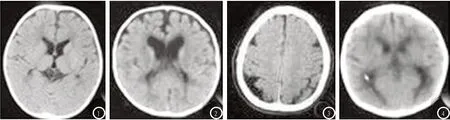
图1 脑白质减少。图2 脑室扩大。图3 脑萎缩。图4 脑室稍扩大
CT扫描速度快、分辨率高、无创,可清晰显示病变部位情况及其与周围组织关系。CP患儿脑室扩大多表现为双侧侧脑室、三脑室对称性轻中度扩大,形态不规则;可合并出现前后纵裂、脑沟、脑裂明显增宽。脑白质范围明显小于同龄正常儿童,且在侧脑室周围尤其是枕角周围,脑白质内可见条带状低密度影,大小不一,形态不规则[11]。对于基底节缺氧性变性,CT可见基底节区低密度灶,对称或不对称存在,呈软化或略低密度改变;也可伴脑白质、灰质受累,呈低密度改变[12]。此外,部分CP患儿由于脑缺血、缺氧严重,局部脑组织大范围坏死、液化将形成孔洞,CT可见低密度液化灶。但CT有时很难发现轻度脑白质变性、脑内缺血灶以及小的钙化斑。本研究中,CT检查异常率67.39%,其中脑室扩大5例(16.13%),脑发育迟缓13例(41.94%),脑萎缩4例(12.90%),脑软化5例(16.13%),蛛网膜下腔变宽2例(6.45%),其他2例(6.45%),显示CT对CP诊断有一定价值。
综上所述,TCD与CT对CP诊断中均有一定价值,各具优势,临床可根据实际情况选择单独或联合使用,为患儿诊治提供帮助。

