脑动脉硬化与高血压脑白质疏松分级的相关性研究
南京中医药大学连云港附属医院(南京医科大学康达学院附属连云港市中医院) (江苏 连云港 222004)
陈新建 许开喜 丰广魁孟 云 马先军 顾宝东
脑白质疏松(leukoaraiosis,LA)是Hachinski等[1]在1987年首次提出多种病因引起的影像学诊断的临床综合征。目前,LA的发病机制尚不明确,其发病机制众多。各种MRI新技术对LA应用研究[2-3]。由于我国人群高血压患病率呈明显上升趋势,目前我国约有2亿患者,每10个成人中有2人患高血压,知晓率、治疗率和控制率较低,分别低于50%、40%和10%[4]。我国正步入老龄化社会,多种因素会引起LA,LA的出现作为脑血管病的前奏,应给予足够的重视。2017年全国脑卒中大会把早期预防提到首位,探讨如何早期控制高血压、防止脑动脉硬化(arteriosclerosis,AS)与高血压引起LA的微血管改变。本研究对高血压LA患者采用磁共振脑血管造影(magnetic resonance angiography,MRA)技术,探讨AS与高血压LA分级相关性。
1 材料与方法
1.1 一般资料 收集在本院2016年月10月~2017年11月因头痛、头晕、记忆力下降、行动迟缓、高血压1-36年不等,对高血压患者行MRI检查,LA的的患者62例和无脑白质异常患者19例,男42例,女39例,年龄36~85岁,中位年龄69.2岁。排除标准:(1)磁共振检查禁忌症;(2)急性、慢性脑梗死;(3)其他原因造成的白质病变(如糖尿病、脑外伤、中毒、脑炎、特异性脑白质病变、多发性硬化、阿尔茨海默病、放射性脑病、一氧化碳中毒等白质变性疾病);(4)脑积水、脑肿瘤、脑血管畸形等。
1.2 方法 扫描使用GE Discovery 750 3.0T MR扫描机器,8通道相控阵头部线圈,患者均行常规头颅MRI、MRA检查。常规MRI扫描参数:T1WI(TR/TE=1750ms/21.8ms),T2WI(TR/TE=3598ms/107.3ms),FLAIR(TR/TE=8400ms/87ms,DWI(TR/TE=6000ms/73.5ms);MRA扫描参数:采用3D-TOF技术行MRA扫描,TR/TE=22ms/2.6ms,反转角15°,视野(FOV)22cm×19.4cm,矩阵256×224。
1.3 图像处理和分析 将MRA采集原始数据传输到GE的Adwantage workstation 4.6工作站上应用MRA处理软件,后处理得到MRA图像。LA的影像诊断标准:头颅T2-FLAIR图像显示双侧脑室周围和/或半卵圆中心区见斑点状、斑片状或弥漫性融合的高信号。LA分级标准采用半定量法,参考Mantyla等[5]的方法:0级,无LA;1级,双侧脑室周围前、中、后部白质见散在斑点局限性病灶;2级,双侧脑室周围前、中、后部白质见局限性、非融合性或部分融合性斑片状病灶;3级,病变融合成片状,累及整个侧脑室周围白质。
1.4 统计学分析 应用SPSS19.0统计学软件。计量资料以(χ-±s)表示。LA分级与动脉硬化分级行Spearman相关分析。P<0.05为异常有统计学意义。
2 结 果
2.1 T2-FLAIR表现 在81例高血压LA患者中,双侧脑室前角、侧脑室旁、后角白质未见改变,为LA的0级(图1);双侧脑室前角、侧脑室旁、后角白质见散在斑点局限性病灶,为LA的1级(图3);双侧脑室前角、侧脑室旁、后角白质见局限性、部分融合性斑片状病灶,为LA的2级(图5);双侧脑室前角、侧脑室旁、后角白质病变融合成片状,累及整个侧脑室周围白质为LA的3级(图7)。
2.2 MRA表现 LA分级与AS关系 81例0-3级LA患者,其中0-3级LA分别为19例、23例、19例和20例(图1-8),81例162侧MRA显示,正常表现脑血管走行正常,管壁清楚,占33.3%(54/162),轻度AS表现脑血管走行僵直、管壁稍毛糙,无狭窄;占25.9%(42/162)中度AS表现脑血管纤细、走行僵直、管腔粗细不均;占21.0%(34/162)重度AS表现脑动脉分支稀少、部分脑动脉中断,二级分支显示不佳占19.8%(32/162)。LA分级与不同程度AS分布经Spearman相关系数检验,两者成正相关,相关性具有明显统计学意义(r=0.551,P<0.001)(表1)。说明AS程度越重,LA等级越高。
3 讨 论
3.1 病因及发病机理 当血压稳定在60-150mmHg时,脑血流量也处于相对稳定状态。随着高血压病进展,交感神经兴奋、肾素-血管紧张素-醛固酮系统接活、血管内膜损伤及血管活性物质释放[6],为了保护脑血液供血,引起周围小血管继发的、保护性收缩,引流需要依靠小动脉搏动所产生的挤压力,使局部脑血流量反应性增加。随着血压升高可加重心血管负担[7],从而导致小血管重建[8],由于长期慢性高血压AS,特别是大脑前、中、后动脉狭窄基础上,广泛的皮质下白质和脑白质的细微穿支动脉的细小动脉管壁增厚、玻璃样变性以及脂质沉着,随之搏动减弱,血管内皮细胞间液的引流需要依靠小动脉搏动所产生的挤压力,受累的血管随着病变进一步发展使血管管壁逐渐变细、痉挛,此时,细胞间液引流障碍,使其供应白质区血液灌注明显下降,动脉局限性缺血。所以,当血流灌注下降时,首先殃及深部脑白质,同时深部脑白质区域的终末血管呈盘绕和螺旋样改变,侧支循环少,代偿储备力差,最易受缺血影响,引起血管慢性损伤,一旦受损则无法建立侧支循环,损害将不可逆,导致LA的发生,进而出现脑室系统扩张和脑萎缩。脑室旁白质完整性破坏是脑小血管患者认知损害的重要影像学标志[9]。
3.2 LA的MRI和MRA表现 时间飞越法(TOF)MRA的成像是基于静止组织和流动血液的信号差别,即血流的流入增强效应进行成像。对流动相对较快的动脉血管效果较好,在头部可大部分取代常规血管造影,特别3.0T高分辨率3D-TOF-MRA也能显示管径较细小的动脉[10]。当MRA显示脑动脉主干或分支不规则狭窄或中断、分支稀少或显示不清时,这是由于3D-TOF-MRA对动脉严重狭窄、流速较低小血管不敏感引起 的[11],MRA不能直接显示穿支动脉。MRA可通过观察除穿支动脉以外的血管变化来了解AS的严重程度,从而间接评估皮质穿支动脉的受累情况。

表1 高血压型LA分级与脑AS程度比较
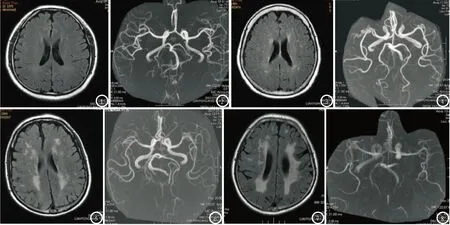
图1-2 LA-0级 患者,男,36岁,高血压6年,经常头痛。图1 轴位T2FLAIR,未见白质病变;图2 MRA 显示双侧血管走行正常,管壁清楚。图3-4 LA-1级 患者,女,67岁,高血压10年伴头晕。图3 轴位T2FLAIR 见双侧侧脑室前角、旁、后角散在斑点局限性病灶;图4 MRA显示双侧大脑中动脉走行僵直、管壁稍毛糙,左侧大脑后动脉P2段管腔不规则轻度狭窄。图5-6 LA-2级 患者,男,72岁,高血压13年,服药血压控制不佳,高血压2级伴头晕。图5 轴位T2FLAIR 见双侧侧脑室前角、旁、后角多发斑片状病灶、部分融合性;图6 MRA 显示双侧大脑中、后动脉、基底动脉纤细、走行僵直、管腔粗细不均,右侧大脑中动脉M1轻度狭窄。图7-8 LA-3级 男,61岁,高血压8年,高血压3级(BP220/130mmHg)伴头晕1周。图7 轴位T2FLAIR 见双侧侧脑室前角、旁、后角呈大片、融合性病灶;图8 MRA 显示部分双侧大脑前、中、后动脉动脉分支稀疏。
本组病例LA的MRI典型表现:(1)双侧脑室前角、旁、后角和/或半卵圆中心区斑点状、斑片状或弥漫性融合的长T1长T2信号。(2)脑室系统扩张和脑萎缩。AS的MRA表现脑血管走行僵直、管壁毛糙,血管纤细,管腔粗细不均,部分脑动脉中断或分支减少,二、三级分支显示不佳。本组LA分级与不同程度AS分布经Spearman相关系数检验,两者成正相关,相关性具有明显统计学意义(P<0.001),说明AS程度越重,LA等级越高。
综上所述,随着磁共振广泛应用,MRA已作为常规检查,我们可通过MRI和MRA获得LA分级及AS程度的详细信息,为临床评估和治疗LA和AS提供依据。

