丝素基双层敷料的制备及其性能
钟红荣, 方 艳, 包 红, 吴婷芳, 张小宁, 徐 水, 朱 勇
(西南大学 生物技术学院, 重庆 400715)
皮肤是人体最大的器官,也是防御外界刺激的第1道屏障[1]。由创伤、擦伤、皮肤溃烂和烧伤等原因引起的皮肤损伤易造成细菌感染、体液流失并引发多种并发症[2],严重威胁到人类的生命与健康。通常采用伤口敷料对其进行保护,以防伤口感染和脱水,并为伤口修复提供湿性愈合环境。
目前的伤口敷料有膜、凝胶、海绵以及纳米纤维等类型。针对有表面渗出液的伤口或全层皮肤损伤修复,海绵型材料多孔的结构有利于提高水蒸气透过率,具有良好的吸附、吸收和止血作用,成为最优的选择[1]。丝素蛋白(SF)拥有生物相容性好、可降解、炎症反应小、透氧性能好、易化学修饰等优点,但由于大量非极性氨基酸的存在限制了其吸湿保湿性能,因此,单一的丝素基敷料远远不能满足创口愈合的需要。葡萄糖(Glu)作为性价比较高的亲水性小分子物质,可用来弥补丝素蛋白的这一缺陷。Baimark等[3]最早在丝素蛋白溶液中添加葡萄糖采用蒸发溶剂法制备了丝素/葡萄糖薄膜。Srivastava等[4]进一步研究表明,丝素/葡萄糖薄膜有利于L929成纤细胞的黏附和增殖。随后基于不同品种蚕丝的丝素蛋白结构与性能的差异化,Srivastava等[5]分别用葡萄糖对琥珀蚕和印度柞蚕的丝素蛋白进行增塑修饰发现,葡萄糖均能提高这2种丝素膜的力学性能和表面粗糙度。Panico等[6]也以丝素为基材,添加葡萄糖制备了共混膜,体外生物降解实验证明该膜稳定性好。
聚氨酯(PU)凭借其优良特性,成为医用敷料领域发展最为迅速的一种高分子合成材料。文献[7-8]分别制备了由3个不同层组成的敷料,其中均以透明的聚氨酯薄膜作为防水透气层,证明了该敷料能提供有利于伤口愈合的微湿环境,因此,以聚氨酯为原料的薄膜不仅允许水蒸气透过,隔绝液态水,使伤者复原期间能淋浴,而且其致密的膜结构也能有效阻止细菌等微生物的侵入和伤害,该薄膜兼具防水透气及阻菌的功能。
基于以上对丝素蛋白、葡萄糖和聚氨酯在医用敷料方面的研究,证明了丝素蛋白作为优良的基材可应用于伤口敷料的开发,但其不能完全满足理想型伤口敷料的需求,如力学性能不足、吸水能力有限等。近年来葡萄糖在敷料方面作为亲水性成分及增塑剂的研究引起关注,因此,本文结合二者的优点,制备了一种新型的双层敷料:底层为采取冷冻干燥法制备的多孔性海绵,适用于渗出液较多的伤口;表层为采取蒸发溶剂法制备的聚氨酯薄膜,既可避免环境微生物入侵伤口,又可克服单一海绵材料水分挥发过快的缺点。双层敷料的设计可为开发理想的临床用伤口敷料提供理论参考。
1 实验部分
1.1 材料与仪器
材料:蚕茧,西南大学生物技术学院纤维材料实验室;葡萄糖粉末、甘油(Gly)、N,N-二甲基甲酰胺(DMF),成都科龙公司;聚氨酯,德国拜尔公司;胎牛血清、高糖DMEM培养基、苯酚,北京索莱宝科技有限公司;医用级聚烯烃热熔胶,东莞市铭远塑胶有限公司。
仪器:Modulyo-d型台式冷冻干燥机,赛默飞世尔科技公司;RXZ-200C型人工气候箱,宁波东南仪器有限公司;HH-8型数显式恒温水浴锅,江苏省金坛市荣华仪器有限公司;CTM2100型微机控制电子万能材料试验机,上海协强仪器制造有限公司;JSM-6510LV 型扫描电子显微镜,日本电子株式会社;Varian 640型傅里叶红外光谱仪,美国Varian公司;MAXima_X XRD-7000型X射线衍射仪,日本岛津公司;HSC-1型差示扫描量热仪,北京恒久科学仪器厂;B13-3型恒温磁力搅拌器,上海司乐仪器有限公司;DHG-9070A型电热鼓风干燥箱,上海一恒科技有限公司。
1.2 试样的制备
1.2.1 丝素/葡萄糖海绵的制备
首先将蚕茧按照常规方法[9]处理制备成质量分数为4%的丝素蛋白溶液,然后向丝素蛋白溶液中加入不同质量分数(0、5%、10%、15%、20%)的葡萄糖粉末,在温度为25 ℃、转速为300 r/min下用搅拌器搅拌10 min,然后加入质量分数为0.5%的甘油溶液继续搅拌40 min,再将均匀的混合液分别转至聚丙烯酰胺培养皿中,于-20 ℃预冷冻6 h,-80 ℃冷冻12 h,在冷冻干燥机上成型。最后对海绵进行不溶化处理,即用质量分数为80%的甲醇处理 30 min,流水冲洗3次,在室温干燥得到丝素/葡萄糖海绵。
1.2.2 聚氨酯薄膜的制备
将一定质量的聚氨酯颗粒溶于DMF溶液中,在温度为80 ℃、转速为400 r/min条件下搅拌3 h,配制成质量分数为8%的聚氨酯溶液。再将聚氨酯溶液均匀涂覆在模具上,在60 ℃干燥箱中蒸发溶剂48 h成膜。为完全除掉薄膜中的溶剂DMF及杂质,将薄膜依次放入甲醇和去离子水中分别浸泡2 h和48 h,取出后将其置于60 ℃的干燥箱中烘至质量恒定,得聚氨酯薄膜。
1.2.3 双层敷料的制备
先将聚烯烃热熔胶(医用级)加热至130 ℃左右熔化,用玻璃棒将液态热熔胶均匀涂覆在海绵周围及中央,再将聚氨酯薄膜与海绵紧贴,并给予一定外力促进二者黏合,最后放入35 ℃烘箱中烘干2 h,得到复合型双层敷料。
1.3 测试方法
1.3.1 吸水率测试
按照常用的测试创面敷料吸水率的方法:将敷料裁剪为2 cm×2 cm,于温度为25 ℃,相对湿度为65%环境中平衡24 h,称取质量m(g);配制模拟伤口渗出液(含142 mmol的NaCl,2.5 mmol 的CaCl2),将敷料置于自身质量40倍的渗出液中,在37 ℃下吸水至饱和,垂悬30 s后测定材料的湿态质量,记为mt(g)。吸水率计算公式为
W=[(mt-m)/m]×100%
1.3.2 溶失率测试
取2 cm×2 cm敷料,于温度为25 ℃,相对湿度为65%环境中平衡24 h,称取质量m1(g),将其置于自身质量100倍的1.3.1节中渗出液的称量瓶中,于37 ℃恒温振荡24 h,取出敷料后于37 ℃及50%湿度的环境中干燥后,再次平衡24 h,称取质量记为m2(g)。溶失率(S)的计算公式为
S=[(m1-m2)/m1]×100%
1.3.3 保水率测试
取2 cm×2 cm敷料,于37 ℃下培养24 h,称取湿态质量m3(g)。将吸水至饱和的敷料转至干燥的称量瓶中,置于温度为37 ℃,相对湿度为35%的培养箱中进行失水实验,每隔1 h(累积时间为24 h)测定其质量,记为m4(g)。则单位质量t时刻的保水率计算公式为
Q=(m4/m3)×100%
1.3.4 透湿率测试
选定适宜的柱状容器装入10 mL蒸馏水,容器口截面积小于敷料面积。将面积为A的敷料覆盖在柱状容器上,杯口用封口膜密封,整个装置处于温度为37 ℃,相对湿度为35%条件下,定时检测整个装置的质量。透湿率(g/(m2·d))计算公式为
T=Δm24/A×t
式中:Δm为前后2次质量差,g;A为样品的透气面积,m2;t为前后2次称量的时间间隔,h。
1.3.5 表面形貌观察
采用离子溅射仪对样品喷金2次,每次50 s,然后置于扫描电子显微镜(SEM)中观察样品的表面形貌,电压为20 kV。
1.3.6 表面官能团测试
将样品研磨成粉末,按一定质量比加入KBr研磨混匀、压片,制成完整的透明薄片,装入红外光谱仪(FT-IR)样品舱测试其表面官能团变化,测试范围为4 000~400 cm-1,分辨率为4 cm-1, 扫描次数为32。
1.3.7 热力学性能测试
采用差示扫描量热仪(DSC)在氮气氛围下,于30~500 ℃范围内测试样品热力学行为,升降温速率均为10 ℃/min。
1.3.8 生物安全性测试
1.3.8.1聚氨酯薄膜的细菌穿透性检测 首先将聚氨酯薄膜裁剪为1 cm×1 cm,用质量分数为75%的酒精浸泡5 min,然后使用磷酸缓冲溶液(PBS)清洗3次以去除酒精,紫外线照射30 min进行消毒处理。对照组为无菌纱布。
然后将消毒后的聚氨酯薄膜及无菌纱布片置于LB琼脂平板上,将菌液稀释,制备成1×109CFU/mL浓度的细菌悬液。吸取20 μL菌悬液接种到膜片表面均匀涂抹,注意菌液不要超出方形膜片及纱布片的范围,于37 ℃恒温培养24 h。
最后用镊子仔细揭开膜片和纱布片,用无菌手术刀将膜片和纱布片下方的琼脂块切开,并转移至加有2 mL PBS溶液的无菌试管内。用PBS反复冲洗琼脂块表面,将细菌从琼脂块上洗脱下来。再将试管内的PBS做一系列的倍比稀释,常规涂板后,37 ℃恒温培养12 h,观察细菌生长情况。
1.3.8.2双层敷料的细胞毒性检测 采用MTT法检测材料浸提液的细胞毒性。首先将细胞悬液(1×105个/mL)按每孔200 μL接种于96孔板,置于CO2培养箱内培养贴壁。完全贴壁后,弃去原培养基,分别加入材料实验组、阴性对照组(含质量分数为10%胎牛血清的DMEM培养液)、阳性对照组(含质量分数为0.64%苯酚的DMEM培养液)各 200 μL 继续相同条件培养,每隔24 h更换一次各组培养基。然后在1、3、5 d取出相应培养板,于倒置显微镜下观察细胞生长情况并拍照记录。最后弃去培养基,向各孔添加20 μL质量分数为0.5%的MTT溶液继续培养4 h,小心吸弃上清液后,向每孔再加入150 μL二甲基亚砜,酶联免疫检测仪震荡 10 min,在490 nm波长下测定每组吸光度(OD)值,每组平行测定6个样品,取平均值。相对增殖率计算公式为
式中:OD1和OD2分别为实验组和阴性对照组样品的光密度平均值。
2 结果与讨论
2.1 双层敷料的吸水性能分析
吸水率的大小取决于材料自身的亲水基团含量及内部结构,是衡量医用敷料好坏的重要指标之一,吸水率越大,敷料就越能快速吸收伤口处分泌的渗出液,保持创面的洁净环境,防止细菌感染,从而有利于伤口的愈合[10]。不同质量分数Glu海绵复合PU膜双层敷料的吸水率如图1所示。可知:当Glu质量分数为5%和10%时,制备的双层敷料能吸收自身体积12.5倍以上的液体量,且在50 min内达到饱和状态,但当Glu质量分数高于15%时,吸水率则下降,这可能是由于高含量的Glu增加了材料的亲水性,自身溶解所致;因此,该双层敷料优异的吸液能力可用于合理管控伤口的渗出液,从而维持伤口愈合的微湿环境。

图1 不同质量分数Glu双层敷料的吸水率Fig.1 Water absorption of bilayer dressing composed of glucose with different mass fraction
2.2 双层敷料的溶失性能分析
丝素基材料的溶失率同其自身的亲水基团含量及分子结构的结晶度相关,通常用其评价生物医学材料的体内外稳定性[11]。双层敷料的溶失率如图2所示。可知,双层敷料的溶失率随着葡萄糖质量分数的增加而增加。当Glu质量分数低于10%时,热水溶失率增加缓慢,其值低于2%;当Glu质量分数超过10%后,双层敷料的热水溶失率急剧上升,其值达到5%,这是由于葡萄糖分子上含有大量的亲水基团,易溶于水,从而增加了双层敷料的溶失率。总体而言,当Glu质量分数低于10%时,双层敷料具有更佳的稳定性。
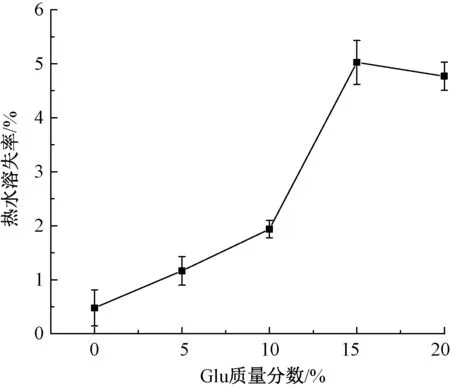
图2 不同Glu质量分数双层敷料的溶失率Fig.2 Dissolubility of bilayer dressing composed of glucose with different mass fraction
2.3 双层敷料的保水性能分析
图3示出双层敷料的保水率测定结果。可以看出,在4 h时,双层敷料可保留自身60%的水分,而且双层敷料的保水率在11 h才达到最低值,为25%。这可能是由于双层敷料的表层PU薄膜致密的结构有效地降低了底层海绵内部水分的挥发,更好地锁住水分,从而延长保水时间,提高保水效率。良好的保水率可为伤口提供湿润环境,不仅有助于生长因子释放以及细胞增殖,还能促进表皮细胞迁移,增强白细胞功能[12]。
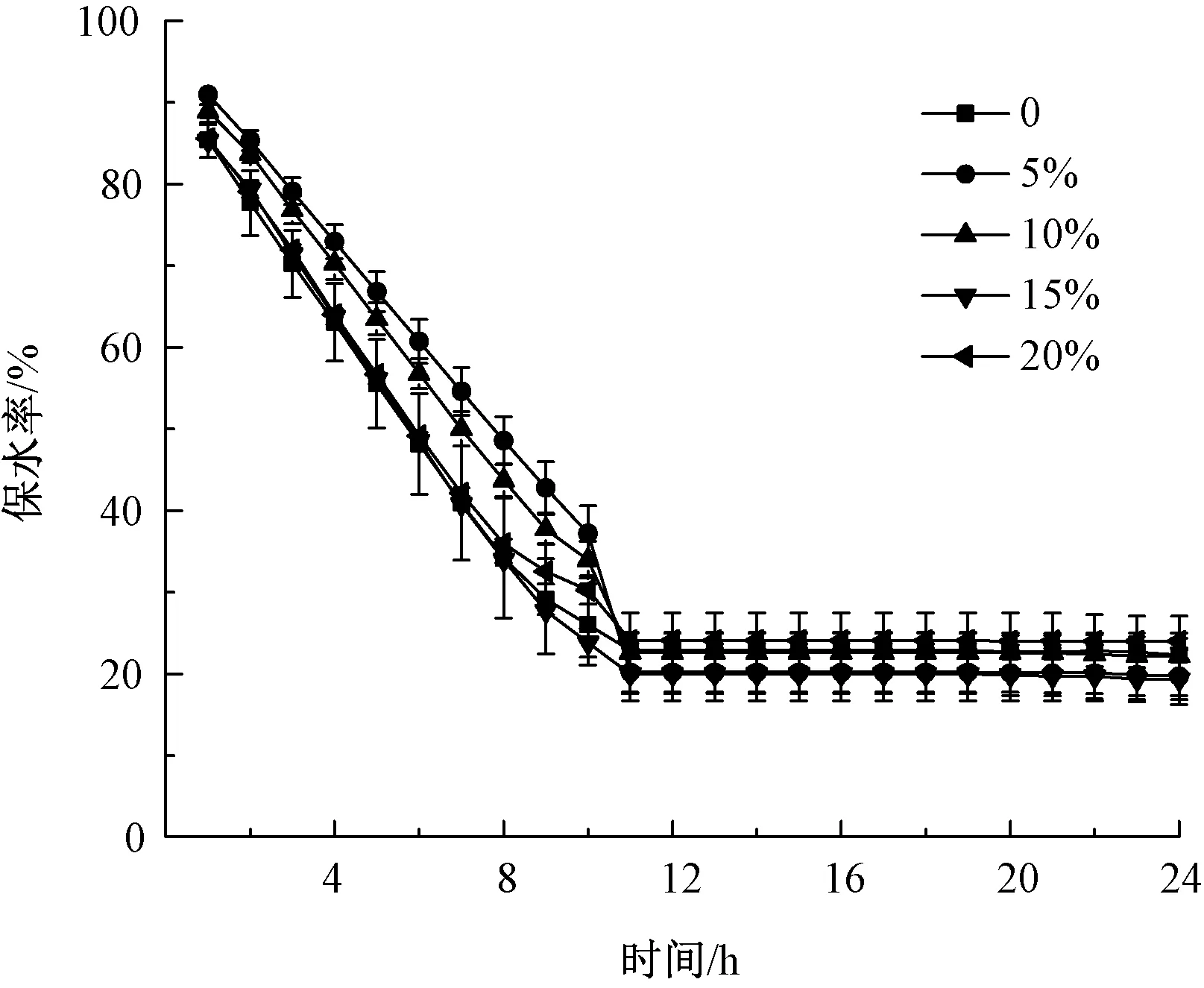
图3 不同质量分数Glu双层敷料的保水率Fig.3 Water retention of bilayer dressing composed of glucose with different mass fraction
2.4 双层敷料的透湿性能分析
为避免伤口渗出液过多在创面处聚集,减少细菌滋生,从而延长敷料的寿命,要求敷料应具有良好的透湿性[13]。双层敷料的透湿率测试结果如图4所示。

图4 不同质量分数Glu双层敷料的透湿率Fig.4 Water vapor transmission ratio of bilayer dressing composed of glucose with different mass fraction
可以看出:当Glu质量分数低于10%时,敷料的透湿率随着Glu质量分数的增加而增加;当Glu质量分数高于10%,敷料的水蒸汽透过率则有所降低。可见在Glu质量分数为10%时,透湿率达到最大值,为(620.01±16.70) g/(m2·d),这可能是由于双层敷料的表层覆盖了PU薄膜,从而使敷料总体水蒸汽透过率较低。
2.5 双层敷料的表面形貌分析
双层敷料的扫描电镜照片如图5所示。可以看出,相对于海绵材料,PU薄膜结构变得更加致密,表面出现大量的褶皱,但无孔洞现象。材料的多孔结构较为明显,当Glu添加质量分数低于10%时,海绵内部孔洞形状较为规则,孔壁厚度均匀,孔径大小约为100~200 μm,而当Glu质量分数增至20%时,海绵内部的孔洞结构减少,伴随着层片状结构堆积,因此,Glu质量分数为10%和15%所制备的海绵,其内部孔洞相互连通,孔壁上也出现了细小触角,可为细胞的黏附、增殖提供空间。

图5 PU薄膜和不同质量分数Glu海绵的扫描电镜照片Fig.5 SEM images of polyurethane membrane and glucose sponge with different mass fraction.(a) PU membrane; (b) 0; (c) 5%; (d) 10%; (e) 15%; (f) 20%
2.6 双层敷料的表面官能团分析
本文采用红外光谱法来分析葡萄糖的二级构象变化[14]。图6示出本文实验所用葡萄糖粉末的红外光谱图。可以看出,葡萄糖具有羰基和羟基2种官能团。在3 409 cm-1和3 313 cm-1处时出现了强且宽的吸收峰,这是葡萄糖分子中羟基的伸缩振动吸收峰。此外,葡萄糖在1 200~ 900 cm-1处也有5个明显的吸收峰,分别为:1 149、1 111、1 078、1 024、996 cm-1,主要为葡萄糖分子中C—C、C—O、O—CH、C—OH和C—CH基团伸缩振动及其变形产生的吸收峰[15-16]。
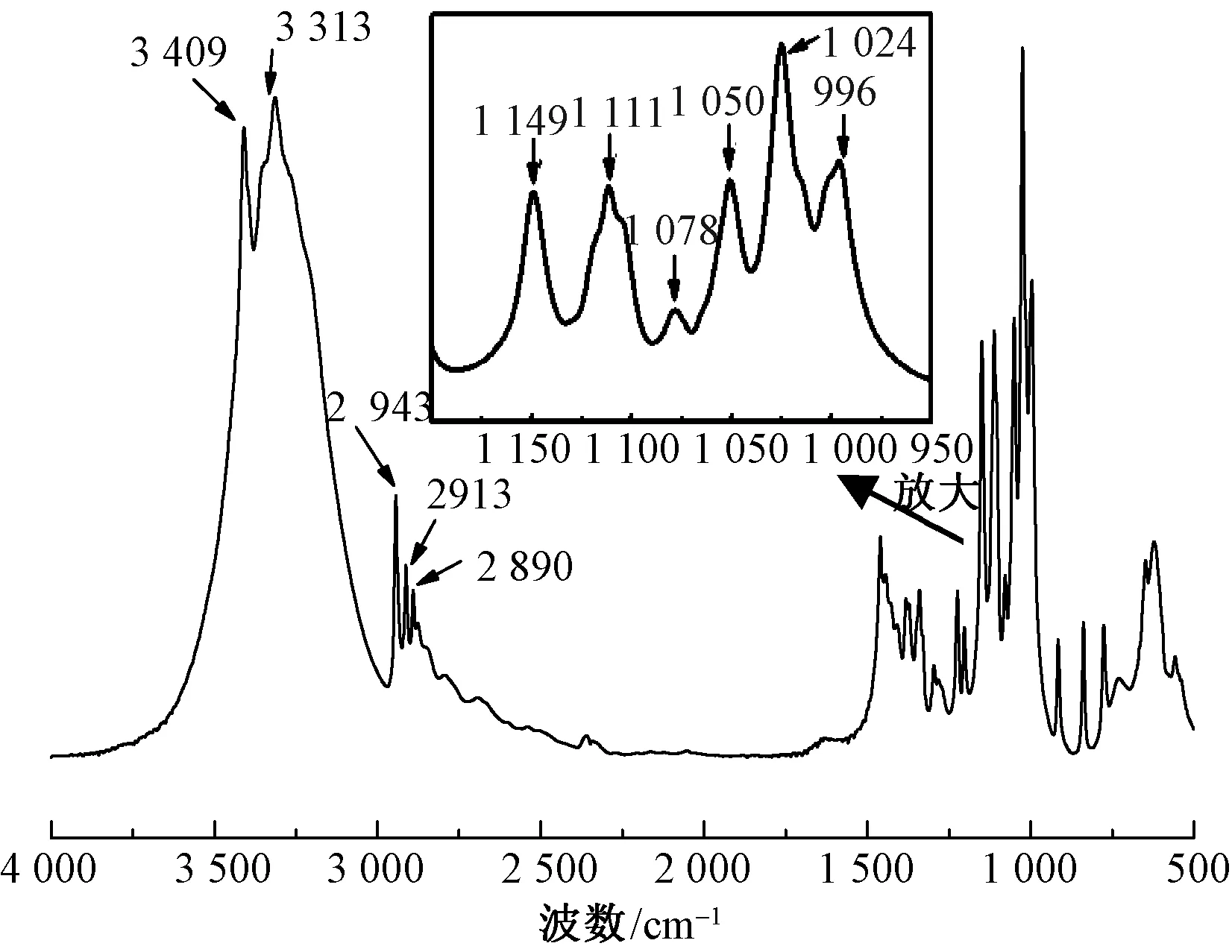
图6 葡萄糖的红外光谱图Fig.6 FT-IR spectra of glucose
图7示出SF和海绵材料的红外光图谱。可以看出,丝素蛋白与不同质量分数的葡萄糖共混后,其吸收峰酰胺I带在1 629 ~ 1 636 cm-1之间,酰胺Ⅱ带在1 521 ~ 1 528 cm-1之间,酰胺Ⅲ带在1 232 ~ 1 233 cm-1之间,酰胺Ⅳ带在668 cm-1处。参照丝素蛋白β-折叠构象对应的红外光谱特征谱带(酰胺I带为1 625 ~ 1 640 cm-1,酰胺Ⅱ带为1 515 ~ 1 525 cm-1,酰胺Ⅲ带为1 222 ~ 1 250 cm-1,酰胺Ⅳ带为700 cm-1),分析得出不同质量分数葡萄糖添加制备的海绵材料二级结构均归属为β-折叠。这表明添加葡萄糖对甲醇处理后的海绵材料的β-折叠二级结构影响不大。
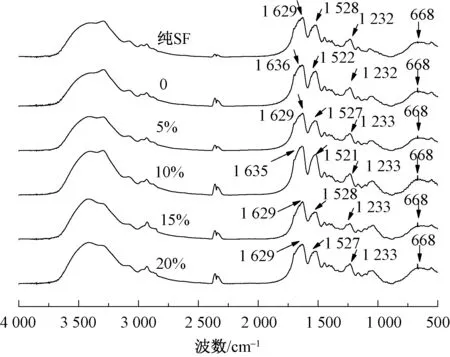
图7 SF和不同质量分数Glu海绵的红外光谱图Fig.7 FT-IR spectra of SF and with different mass fraction Glu
2.7 双层敷料的热力学性能分析
图8示出SF和不同质量分数Glu海绵的DSC曲线。可知,纯SF的DSC曲线于289.4 ℃处出现吸热峰,该现象表明了SF在该温度时发生降解。Glu在163.5和220.7 ℃处出现2个吸热峰,这是其特征峰[17]。相比纯SF海绵,不同质量分数Glu制备海绵的DSC曲线分别在290.3~292.3 ℃ 之间出现了吸热峰,均向高温方向发生了移动,这可能是因为Glu和Gly的存在诱导SF产生更稳定的β-折叠结构,因此,降解温度有所升高。此外,在复合材料的DSC曲线中并未出现纯Glu的特征吸热峰,这说明复合材料组分之间发生了相互作用,相容性好,未出现相分离现象,这与红外结果一致。
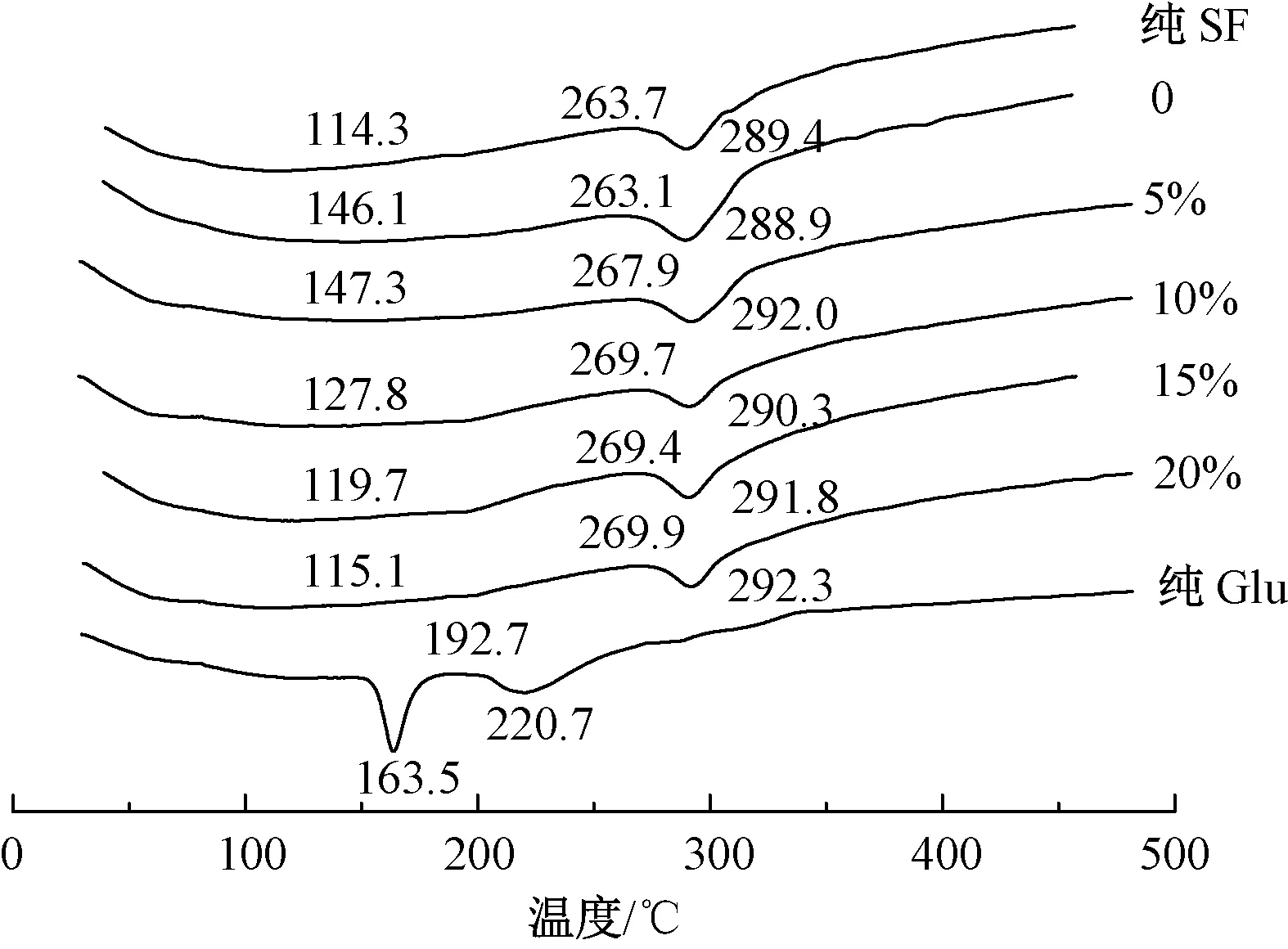
图8 SF和不同质量分数Glu海绵的DSC曲线Fig.8 DSC curve of SF and sponge with different mass fraction Glu
2.8 双层敷料的生物安全性分析
2.8.1 聚氨酯薄膜的细菌穿透性
图9示出聚氨酯薄膜的细菌穿透性检测结果。
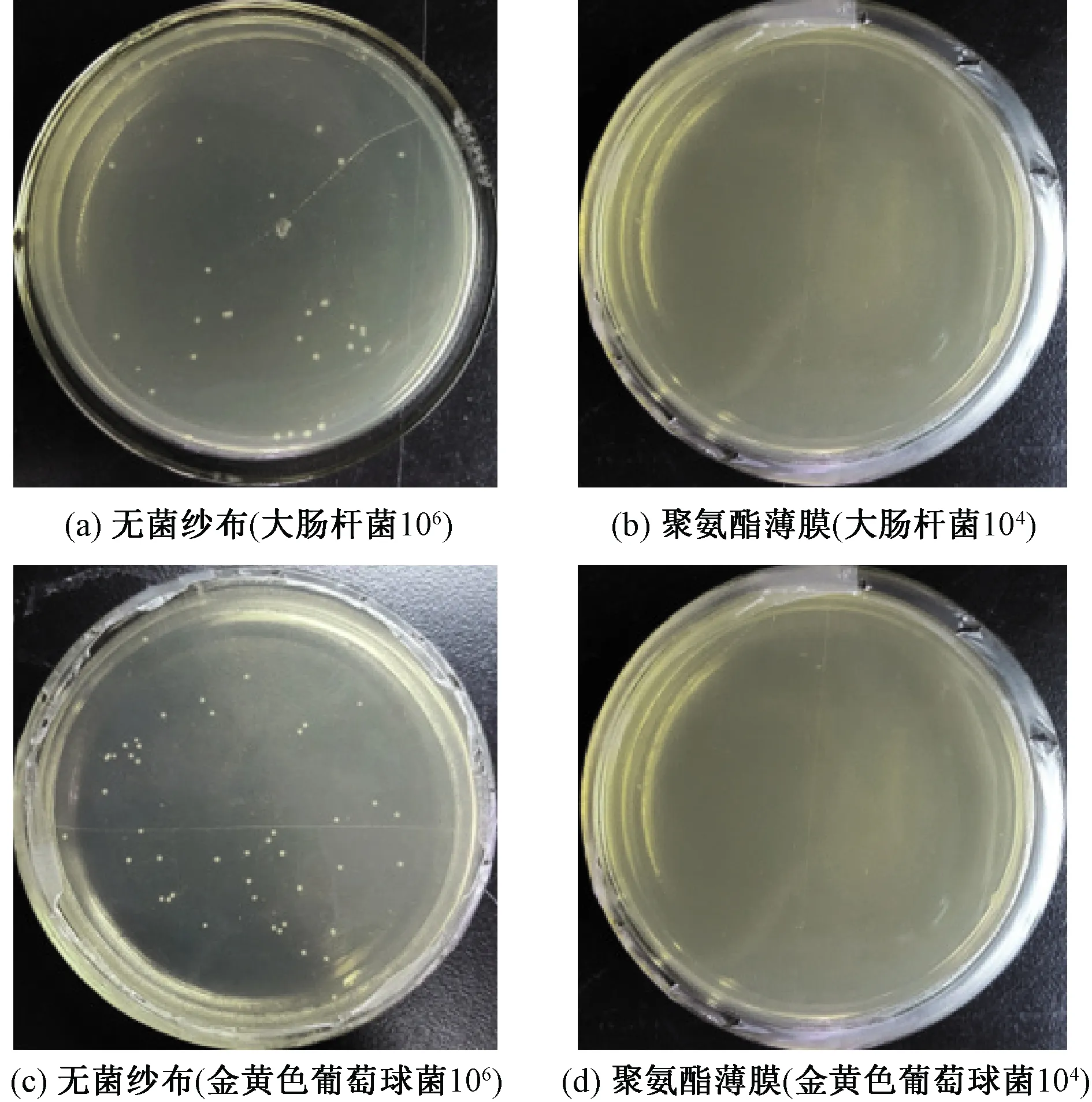
图9 无菌纱布与聚氨酯薄膜的阻菌结果Fig.9 Resistance bacteria results of sterile gauzeand and polyurethane membrane. (a) Sterile gauze (Escherichia coli 106); (b) Polyurethane membrane (Escherichia coli 104); (c) Sterile gauze (Staphyloccocus aureus 106); (d) Polyurethane membrane (Staphyloccocus aureus 104)
从图9可以看出,无菌纱布组洗脱下的菌液,将其稀释至106后培养12 h的菌落计数为:大肠杆菌26个;金黄色葡萄球菌45个。而聚氨酯薄膜洗脱下的菌液,将其稀释至104培养后,固态琼脂板上没有2种细菌的菌落出现。这表明大肠杆菌和金黄色葡萄球菌对无菌纱布均具有穿透性,且大肠杆菌的穿透能力不及金黄色葡萄球菌,可能与这2种细菌自身的直径有关。对于聚氨酯薄膜而言,大肠杆菌与金黄色葡萄球菌均不具有穿透作用,这可能是由于在聚氨酯薄膜形成的过程中,其结构十分致密,无孔洞结构出现,才使得大肠杆菌和金黄色葡萄球菌无法穿过。因此,在日常的伤口护理中,使用无菌纱布不能有效地隔绝外界细菌的侵入,易造成二次感染。然而使用聚氨酯薄膜却可达到阻菌的功效,这证明聚氨酯薄膜能满足双层敷料的阻菌性要求。
2.8.2 双层敷料的细胞毒性
计算各组细胞的相对增殖情况,结果如表1所示。可知,各材料实验组细胞的相对增殖率(RGR)均大于100.48%。根据GB/T 16886.5—2003《体外细胞毒性试验》,经材料处理后培养的细胞,其相对增殖率大于75%则可被认为不具细胞毒性[18],因此,相对增殖率数据显示该双层敷料无细胞毒性,有利于细胞的增殖,满足伤口敷料的基本要求,可作进一步的研究。
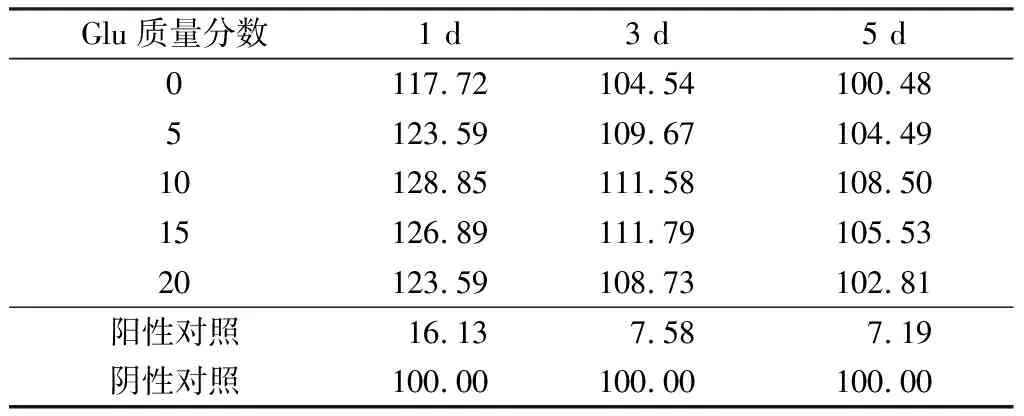
表1 不同配比制备双层敷料接种培养细胞的相对增殖率Tab.1 Relatively growth rates of bilayer dressing with different ratio %
3 结 论
本文以SF/Glu海绵(海绵底层)作为吸收层, PU薄膜(海绵表层)作为保护层,二者通过医用热熔胶黏连制备了一种功能性的双层敷料。首先对该敷料进行了理化性能测试,结果表明,以Glu质量分数为10%制备的双层敷料,其吸水率可达自身质量的12.5倍,保水时间延长至11 h,水蒸气透过率为(620.01±16.70) g/(m2·d)。扫描电镜测试结果表明,当Glu质量分数为10%或15%时,所制备的海绵内部形成了多孔结构,孔径大小约为100~200 μm,这种结构或许可为细胞的黏附、增殖提供空间。红外和差示扫描量热测试结果表明,Glu和SF的相容性好,Glu对SF的结晶度具有加强作用,能使其维持较稳定的β-折叠二级结构。细胞毒性实验和细菌穿透性实验结果表明,双层敷料无细胞毒性,PU薄膜具有良好的阻菌性能。本文实验制备的双层敷料性能较优,可进一步探究在临床皮肤创面愈合的应用。
FZXB

