小檗碱对玻璃化冷冻猪卵母细胞脂滴含量及胚胎发育的影响
张紫薇,于 博,戴佳格,武 丽,王俊丽,刘 兵,高建明
(北京农学院动物科学技术学院,北京102206)
卵母细胞的冷冻保存对于优良、濒危动物保种、人工辅助受孕等都有着积极的影响。目前猪卵母细胞和胚胎的冷冻保存的妊娠率较低且鲜有报道。1989年Hayashi等成功冷冻从桑椹胚到孵化囊胚的猪胚胎,其解冻后移植产下后代[1]。2014年Somfai等对猪GV期卵母细胞冷冻保存方法进行优化,使冷冻存活率大幅提高,并应用固体表面冷冻法(solid-surface vitrification,SSV)玻璃化冷冻获得囊胚,移植给4个受体后成功产下18头活仔猪[2]。有学者利用开放式拉长塑料细管法(Open pulled straw,OPS)和细管法对猪GV期卵母细胞玻璃化冷冻效果的研究中发现,OPS法其解冻后存活率和体外成熟率均显著高于细管法[3]。采用OPS法玻璃化冷冻12 h猪卵母细胞解冻后成熟率显著高于程序化冷冻组[4]。OPS法玻璃化冷冻对于体外培养的绵羊胚胎的冷冻保存比传统冷冻更有效[5]。然而玻璃化冷冻后的猪胚胎会出现一系列的凋亡现象[6]。细胞凋亡是一种主动的细胞死亡过程,由一系列基因控制,激活死亡受体介导的外源性途径或线粒体介导的内在途径。Lin等研究发现囊胚延迟培养会增加细胞凋亡的发生率和促凋亡BAX基因的表达,并降低内细胞团与滋养层细胞比率[7]。在体外成熟液和培养液中添加白藜芦醇,可通过改善冻后猪孤雌激活囊胚的线粒体功能,降低囊胚细胞凋亡水平,从而提高其抗冻能力[8]。在冷冻保存期间哺乳动物囊胚的冷冻损伤会诱导滋养层细胞凋亡,并会影响随后的胚胎发育,甚至可能在胚胎着床前导致死亡。X-连锁凋亡抑制因子(XIAP)是一种抗凋亡基因,冷冻保存后小鼠囊胚中XIAP的基因和蛋白表达显著下调[9]。在牛囊胚玻璃化冷冻解冻后培养过程中添加20 μmol/L半胱天冬酶(Caspase)抑制剂Z-VAD-FMK可以通过降低Caspase 3的水平,能够抑制冷冻诱导的细胞凋亡[10]。
小檗碱(Berberine,Ber)是一种异喹啉生物碱化合物,具有多种药理活性,包括保护心血管、降糖降脂、抗肿瘤和免疫调节特性等作用[11]。本实验室前期在猪卵母细胞成熟液及胚胎培养液中添加小檗碱,促进卵母细胞体外成熟(invitromaturation, IVM)及其囊胚体外发育,改善培养环境中的NO水平,有效降低猪卵母细胞中脂滴的含量[12-16]。猪卵母细胞的脂滴含量远高于其他物种[17]。猪卵母细胞冷冻解冻后的存活率和生存能力均较低。本试验采用OPS玻璃化冷冻方法,观察小檗碱对玻璃化冷冻猪卵母细胞脂滴含量及体外受精(invitrofertilization,IVF)胚胎发育的影响,探讨提高猪卵母细胞玻璃化冷冻保存效果的可能途径,从而为建立更有效的猪卵母细胞玻璃化冷冻保存技术奠定基础。
1 材料与方法
1.1 猪卵巢的采集
健康母猪卵巢来自北京近郊区的屠宰场,将新鲜卵巢置于35 ℃含双抗的生理盐水中,1 h内运回实验室。
1.2 猪卵母细胞体外成熟
将取回的新鲜猪卵巢,按文献[16]获取卵丘-卵母细胞复合体(Cumulus-Oocyte complexes,COCs;GV期)。以mTCM199成熟液为对照组,以添加小檗碱的mTCM199成熟液为Ber组。于39 ℃、5% CO2、95%空气、100%相对湿度的CO2培养箱中IVM培养44 h(其0~22 h添加0.5 μg/mL LH、0.5 μg/mL FSH,而22~44 h不添加LH和FSH)。IVM 44 h后,用0.1%透明质酸酶脱除扩散3倍以上的卵丘细胞,选择排出第一极体的卵母细胞(MII期)备用,并统计第一极体排出率。
1.3 卵母细胞的化学损伤效果
将MII期卵母细胞(冷冻液处理对照组,冷冻液处理+Ber组)在预处理液(含有3 mg/mL BSA,无Ca2+、Mg2+的PBS液中添加10% EG和10% DMSO)中平衡3 min后,移入冷冻液(EDFS 40为FS液添加20% EG和20% DMSO,FS液为基础液添加30%的聚蔗糖和0.5 mol/L蔗糖)25 s,移入37 ℃盛有解冻液(PBS液中添加1.00、0.50、0.25 mol/L的蔗糖溶液)的表面皿中,按蔗糖溶液从高到低浓度梯度分别以1、3、3 min脱出冷冻保护剂,然后将卵母细胞转入mTCM199成熟液中,在39 ℃、5% CO2、100%湿度的CO2培养箱中继续恢复2 h,观察卵母细胞存活率。然后进行体外受精及胚胎体外培养。
1.4 卵母细胞玻璃化冷冻与解冻
OPS的制作参照Vajta等[18]报道的方法并改进。用0.25 mL塑料细管(IMV,L’Aigle, Frence)加热后手工拉制而成,细管末端长约2~4 cm,内径约为0.20 mm,管壁厚约为0.02 mm。所有操作在室温25 ℃±1 ℃,37 ℃恒温载物台上进行。所需溶液预热至37 ℃。将体外成熟前后的卵母细胞按各试验组别进行处理,先在预处理液中平衡3 min,然后移入冷冻液平衡25 s,卵母细胞在冷冻液中平衡后吸入OPS管直接投入液氮中冷冻保存(每支管装入5枚)。从液氮中取出冷冻的OPS管,迅速将含有卵母细胞的部分浸入37 ℃的盛有解冻液的表面皿中并吹出。按1.3脱出冷冻保护剂方法进行,然后将其卵母细胞置入成熟液中,在39 ℃、5% CO2、100%湿度的CO2培养箱中继续恢复2 h,观察卵母细胞存活率。然后进行体外受精及胚胎体外培养。
各试验组别:GV期卵母细胞进行玻璃化冷冻为GV期冷冻组;GV期卵母细胞进行玻璃化冷冻解冻后在成熟液中添加小檗碱为GV期冷冻+Ber组;MII期卵母细胞进行玻璃化冷冻为MII期冷冻组;在成熟液中添加小檗碱进行体外成熟的MII期卵母细胞进行玻璃化冷冻为MII期冷冻+Ber组。
1.5 卵母细胞存活的判定
在体视显微镜下观察,解冻后GV期卵母细胞的卵丘细胞与卵母细胞的连接完整、卵丘细胞无脱落、卵母细胞胞质均匀、透明带无破裂。解冻后MII期卵母细胞大小正常,无形变,卵周隙清晰,卵黄膜完整,折光性好,胞质均匀呈黑灰色;死亡的卵母细胞卵黄膜没有折光性,胞质颜色一般呈浅褐色。
1.6 猪卵母细胞脂滴染色
按照文献[16]采用尼罗红染色试剂盒(上海杰美基因,GMS12196)进行卵母细胞脂滴染色,在激光共聚焦显微镜(FV-1000,OLYMPUS)激发光波长488 nm下,每个卵母细胞分层扫描20~30 次,观察脂滴的荧光分布并连续拍照,获得脂滴在卵母细胞内的分布情况,然后压片,采集图像,应用Graphpad prism7.0统计软件生成柱状图,Image J图像分析对图片进行脂滴个数及荧光面积的统计。
1.7 猪卵母细胞体外受精
从北京近郊种猪场获取新鲜长白猪精液,控温18 ℃左右1 h内运回实验室。按照文献[19]进行精子获能。将各组别排出第一极体的卵周隙明显、卵细胞膜完整的卵母细胞置入50 μL 的mTBM受精液滴中培养30 min。将获能后的精子以1.5×106个/mL加入已放入成熟卵母细胞的mTBM受精液滴中,受精6 h。
1.8 猪体外受精卵体外培养
将各组别体外受精卵用添加0.4% BSA的NCSU-23胚胎培养液清洗3遍,之后分别移入39 ℃、5%CO2、100%湿度的CO2培养箱50 μL添加0.4% BSA的NCSU-23胚胎培养液(平衡4 h)液滴中,每滴15枚左右,进行体外培养。每隔24 h或48 h观察胚胎发育率(分别于培养48、72、96、120、168 h观察其2-细胞率、4-细胞率、8-细胞率、桑椹胚率、囊胚率,间隔48 h换液)。
1.9 囊胚细胞差异染色
将各组别囊胚分别置入0.5%的链霉蛋白酶去除透明带,在含有0.4% BSA的PVA-TL-Hepes液中清洗5 min,在39 ℃不含CO2的培养箱中孵育40 min(50 μL PVA-TL-Hepes小滴中添加5.5 μL兔抗猪全血清并覆盖石蜡油),用10%的胎牛血清结束抗体反应5 min。囊胚在无石蜡油的PVA-TL-Hepes液中清洗5 min,并重复3次,在39 ℃不含CO2的培养箱中孵育90 min(50 μL PVA-TL-Hepes小滴中添加3.5 μL豚鼠血清并覆盖石蜡油),在豚鼠补体中孵育的同时用10 μL的H33342和10 μL的PI染色,之后在含有0.4% BSA的PVA-TL-Hepes液中清洗5 min,将囊胚转移到载玻片上的甘油液滴内,尽量少带液体,用凡士林在载玻片四角点四个柱,盖上盖玻片,再轻轻压盖玻片,细胞计数。
1.10 囊胚细胞凋亡的评价
将各组别囊胚在添加有0.1% PVA的TL-Hepes液中清洗3次,随后在4%的多聚甲醛中固定1 h(室温),之后在0.1% PVA的TL-Hepes液中清洗3次,在0.1%(v/v)TritonX-100的柠檬酸钠溶液中孵育1 h(室温)。DNA碎片(DNA fragmentation)检测应用原位细胞凋亡检测试剂盒(In Situ Cell Death Detection Kit,Roche,Germany),即采用TUNEL检测评价细胞凋亡的程度,被固定的胚胎在TUNEL反应混合液中孵育1 h(暗室,38.5 ℃)并清洗干净后放入10 μg/mL PI中室温避光染色5 min,滴加DABCO后封片,使用激光共聚焦扫描显微镜检测整个胚胎凋亡的细胞核,并计数。
1.11 统计方法
应用SPSS 17.0统计软件的方差分析和SNK多重比较法对数据进行分析和差异显著性比较。结果以平均值±标准差(Mean±SD)表示,不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。试验重复≥3次。
2 结 果
2.1 小檗碱对猪卵母细胞体外成熟效果的影响
由表1可见,Ber组猪卵母细胞的卵丘细胞扩散率显著高于对照组(P<0.05),第一极体排出率极显著高于对照组(P<0.01)。

表1 小檗碱对猪卵母细胞体外成熟的影响Tab.1 Effect of Ber on porcine oocytes in vitro maturation
2.2 小檗碱对猪卵母细胞玻璃化冷冻液处理后化学损伤的影响
由表2可见,冷冻液处理+Ber组的细胞存活率极显著高于冷冻液处理对照组(P<0.01)。Ber组及冷冻液处理+Ber组的2-细胞率、4-细胞率、8-细胞率、桑椹胚率和囊胚率分别极显著高于对照组和冷冻液处理对照组(P<0.01),冷冻液处理+Ber组与对照组无显著差异(P>0.05)。

表2 小檗碱对猪卵母细胞玻璃化冷冻液处理后化学损伤的影响Tab.2 Effects of Ber on chemical damage of porcine oocytes treated with vitrified frozen liquid
注:表中“-”表示成熟卵母细胞未经玻璃化冷冻液处理。
Note:The "-" in the table indicates that mature oocytes are not treated with Vitrified frozen liquid.
2.3 小檗碱对玻璃化冷冻解冻后猪卵母细胞存活率的影响
由表3可见,MII期冷冻+Ber组的细胞存活率极显著高于MII期冷冻组与GV期冷冻组(P<0.01),MII期冷冻组的存活率极显著高于GV期冷冻组(P<0.01)。

表3 小檗碱对玻璃化冷冻解冻后猪卵母细胞存活率的影响Tab.3 Effects of Ber on the survival rate of porcine oocytes after vitrification and thawing
2.4 小檗碱对玻璃化冷冻猪卵母细胞脂滴数量及面积的影响
由表4和图1可见,Ber组和MII期冷冻+Ber组脂滴数量及面积分别极显著低于对照组和MII期冷冻组(P<0.01),对照组和MII期冷冻组分别极显著低于GV组和GV期冷冻组(P<0.01),GV期冷冻组极显著低于GV组(P<0.01),MII期冷冻组显著低于对照组(P<0.05)。

表4 小檗碱对玻璃化冷冻猪卵母细胞脂滴数量的影响Tab.4 Effect of Ber on the lipid droplets number in vitrified frozen porcine oocytes

注:A. 各组卵母细胞的脂滴面积;B. 各组尼罗红染色结果;1.GV组;2.GV期冷冻组;3.对照组;4. Ber组;5.MII期冷冻组;6.MII期冷冻+Ber组。Note: A. Each group of lipid droplets area of porcine oocytes; B. Results of Nile Red staining in each group; 1.GV group, 2. GV vitrification group, 3. Control group, 4. Ber group, 5. MII vitrification group, 6. MII vitrification+Ber group.图1 小檗碱对玻璃化冷冻猪卵母细胞脂滴含量的影响Fig.1 Effect of Ber on the lipid droplets content in vitrified frozen porcine oocytes
2.5 小檗碱对玻璃化冷冻猪卵母细胞体外成熟的影响
由表5可见,GV期冷冻+Ber组卵丘细胞扩散率与第一极体排出率均显著高于GV期冷冻组(P<0.05)。
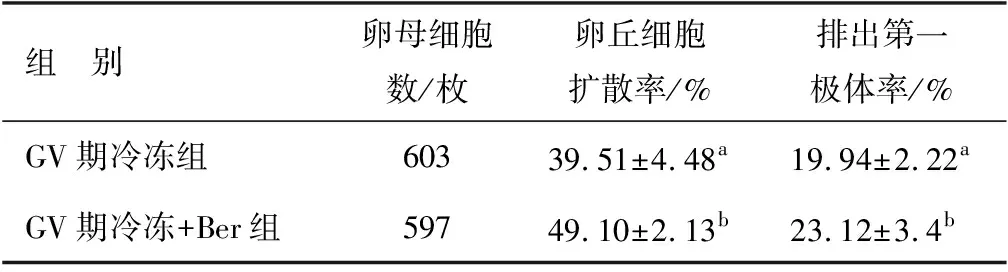
表5 小檗碱对玻璃化冷冻猪卵母细胞体外成熟的影响Tab.5 Effect of Ber on vitrified frozen porcine oocytes in vitro maturation
2.6 小檗碱对玻璃化冷冻猪卵母细胞体外受精胚胎体外发育的影响
由表6可见,在囊胚发育率上,Ber组极显著高于对照组及其他各组(P<0.01),GV期冷冻+Ber组和GV期冷冻组极显著高于MII期冷冻+Ber组和MII期冷冻组(P<0.01),而他们二者间均无显著差异(P>0.05),但GV期冷冻+Ber组和MII期冷冻+Ber组的囊胚发育率均高于GV期冷冻组和MⅡ期冷冻组。
2.7 小檗碱对猪卵母细胞玻璃化冷冻体外受精囊胚细胞数和凋亡的影响
由表7可见,在囊胚内细胞团和细胞总数上,Ber组极显著高于对照组及其他各组(P<0.01);GV期冷冻+Ber组极显著高于GV期冷冻组、MII期冷冻组和MII期冷冻+Ber组(P<0.01),GV期冷冻组、MⅡ期冷冻+Ber组和对照组三者之间无显著差异(P>0.05)。MII期冷冻组极显著低于其他各组(P<0.01)。
由表8可见,在囊胚凋亡细胞数上,各组别之间关系与在囊胚内细胞团和细胞总数上的结果相反。

表6 小檗碱对玻璃化冷冻猪卵母细胞体外受精胚胎体外发育的影响Tab.6 Effect of Ber on vitrified frozen porcine oocytes IVF embryo development

表7 小檗碱对玻璃化冷冻猪卵母细胞体外受精囊胚细胞数的影响Tab.7 Effect of Ber on vitrified frozen porcine oocytes IVF blastocysts cell numbers

表8 小檗碱对玻璃化冷冻猪卵母细胞体外受精囊胚细胞凋亡的影响Tab.8 Effect of Ber on vitrified frozen porcine oocytes IVF blastocysts cell apoptosis
3 讨 论
猪卵母细胞中的脂质主要以脂滴的形式存在,其为卵母细胞的成熟和发育提供能量[20]。本试验中,GV组和GV期冷冻组的脂滴数量和脂滴面积分别极显著高于MII期对照组和MII期冷冻组,GV期冷冻组的细胞存活率极显著低于MII期冷冻组。Wei等利用OPS法玻璃化冷冻解冻牦牛卵母细胞,发现MII期存活率显著高于GV期卵母细胞,且MII期卵母细胞中细胞骨架相关基因(GJA1,CK8和ACTB)高表达[21]。经IVM后牛卵母细胞的脂滴含量下降[22],这与本试验结果一致。由此可见,IVM期间脂滴含量的降低意味着它们在成熟过程中被卵母细胞作为能量源消耗。玻璃化冷冻卵母细胞解冻后的存活率可能与脂滴的含量有关。有研究发现在胚胎培养基中补充胎牛血清,在桑椹胚和囊胚期巨大脂滴(>6 mm)的数量显著增加,其胚胎的低温耐受性差[23],这与本试验结果相吻合,说明玻璃化冷冻卵母细胞解冻后的存活率确实与脂滴的含量密切相关。然而本试验中,GV期冷冻组的囊胚率、内细胞团和细胞总数均极显著高于MII期冷冻组,而囊胚细胞凋亡数极显著减少,推测GV期冷冻组胚胎质量优于MII期冷冻组是由于在冷冻解冻过程中,脂滴在一定条件下转化为能量,对卵母细胞冷冻后的修复具有一定的作用。有关机制还有待今后进一步研究。
有研究表明高浓度的玻璃化冷冻保护剂和高冷却速率可以防止冰晶的形成[24],但被证明会显著降低哺乳动物卵母细胞的发育潜力[25]。Zhu等[26]研究发现小檗碱与白藜芦醇组合对降脂有增强作用。本研究中,在卵母细胞体外成熟液中添加小檗碱,可能通过影响miRNA及脂质代谢相关的基因,降低猪卵母细胞中脂滴的含量,进而促进猪卵母细胞体外成熟[15-16]。本试验小檗碱可以极显著降低新鲜成熟卵母细胞和玻璃化冷冻成熟卵母细胞的脂滴数量和脂滴面积,显著提高新鲜卵母细胞和玻璃化冷冻GV期卵母细胞的成熟率,GV期冷冻+Ber组相对于MII期冷冻+Ber组可以极显著提高囊胚发育率,而且相对于GV期冷冻组和MII期冷冻组,其囊胚发育率有上升趋势,这些可能是小檗碱通过影响脂滴含量实现的。
除了由低温保存引起的损伤外,玻璃化溶液中的化学物质是影响卵母细胞存活率的主要因素之一。冷冻保护剂具有一定的毒性,对细胞有一定的损伤。冷冻保护剂较高的毒性会阻碍卵母细胞的活力[27]。本试验小檗碱可以极显著提高成熟卵母细胞冷冻液处理后体外受精囊胚的发育率和玻璃化冷冻成熟卵母细胞解冻后的存活率。由此推测,小檗碱对冷冻保护液的毒性具有一定的抑制作用。玻璃化冷冻时添加高浓度的冷冻保护剂容易引起化学中毒[28],一旦操作过慢还可能会引起强烈渗透损伤,从而破坏卵母细胞骨架结构,导致纺锤体和染色体结构异常,玻璃化冷冻解冻后卵母细胞的存活率、形态正常率、受精率和发育力等有所下降[29]。玻璃化冷冻降低牛GV期卵母细胞的成熟率[30]。通过向培养基中添加10-9mol/L褪黑激素可以显著增加玻璃化冷冻解冻后小鼠成熟卵母细胞的发育潜力[31]。在体外成熟前补充咖啡因可以提高牛囊胚质量,并表现出较高的抗冻性[32]。通过离心分离细胞中脂滴的极化,脂解和脂质谱的化学修饰,能够提高在富含脂质的卵母细胞/胚胎中冷冻保存的有效性[33]。这与本试验结果相符。
近20年来,小檗碱在细胞凋亡方面的作用不断被发现。小檗碱可抑制心肌梗死后心力衰竭的心肌细胞凋亡,其机制可能是通过影响心肌梗死后心力衰竭心肌组织ERS和CHOP及Caspase-12凋亡信号通路实现,上调Bcl-2/Bax表达,下调Caspase-3表达,从而抑制心脏重塑,保护心脏功能[34];可以通过增强自噬和激活AMPK/mTOR信号通路保护视网膜Müller细胞免受高葡萄糖诱导的细胞凋亡[35]。本试验中,小檗碱极显著提高新鲜和玻璃化冷冻猪卵母细胞体外发育囊胚内细胞团细胞数和细胞总数,降低其囊胚细胞凋亡,说明小檗碱有利于猪卵母细胞玻璃化冷冻解冻后体外发育囊胚质量的提高。
4 结 论
小檗碱通过降低玻璃化冷冻猪卵母细胞脂滴含量,从而提高其冷冻解冻后体外成熟率和体外受精胚胎发育的质量;GV期玻璃化冷冻卵母细胞相对于MII期,在冷冻解冻后其体外受精胚胎发育的质量有更好提高。相关机制还有待今后进一步研究。
农业农村部华北都市农业重点实验室给予的支持,谨致谢忱!

