脑心肌炎病毒VP1基因的克隆与原核表达
阮 峥,王彤彤,常心雨,于 璐,李焕荣*,贾 红
(1. 北京农学院动物科学技术学院,北京102206;2. 中国农业科学院北京畜牧兽医研究所,北京 100193)
脑心肌炎病毒(encephalomyocarditis virus,EMCV)是一种重要的人畜共患病病原,能够引起多种脊椎动物共患的以脑炎、心肌炎及心肌周围炎症为主要特征的传染性疾病[1]。该病毒1945年首次在佛罗里达州从一只患急性致死性心肌炎的黑猩猩体内分离得到[2]。从1945年至今,EMCV在世界许多地区的野生和家养动物中被发现,包括欧洲毒株4、加拿大毒株5、南美毒株6、澳大利亚毒株7、韩国毒株8、意大利毒株9和中国毒株10[3]。
EMCV是一种无囊膜的单股正链RNA病毒,长度为7.8 Kb[4]。基因组含有5'UTR、3'UTR和一个较大的阅读框架(ORF)。ORF编码多种蛋白,其包含非结构蛋白和结构蛋白,分为三个主要前体分子P1,P2和P3,编码11种不同的蛋白质[5]。其中,结构蛋白VP1位于病毒粒子的最表面,该蛋白有很强的抗原性,与病毒的致病性密切相关,能刺激机体产生中和抗体[6]。本试验主要对EMCV BJC3毒株的VP1基因进行克隆及原核表达,为建立犬的EMCV的间接ELISA检测方法和研发亚单位疫苗奠定基础。
1 材料与方法
1.1 病毒、细胞及菌株
EMCV-BJC3毒株由中国农业大学动物医学院预防兽医系实验室惠赠,大肠杆菌DH5α菌株和大肠杆菌BL21(DE3)菌株均购于南京诺唯赞生物科技有限公司。
1.2 生物材料与主要试剂
2×Taq MasterMix、2×Phanta Max Master Mix均购于南京诺唯赞生物科技有限公司;AxyPrep体液病毒DNA/RNA小量试剂盒购自Axygen公司;反转录试剂盒购自北京诺博莱德科技有限公司;胶回收试剂盒、质粒小提试剂盒购自OMEGA公司;pEASY-Blunt Zero克隆载体购自北京全式金生物技术有限公司;限制性内切酶NdeI和HindIII购于Takara公司;预染蛋白质电泳分子量标准、T4 Ligase 连接酶购自赛默飞公司;IPTG溶液、X-Gal溶液和卡那霉素贮存液购自索莱宝公司;His标签的抗体、HRP-山羊抗小鼠IgG购于Proteintech公司;SDS-PAGE凝胶制备试剂盒购于北京康为世纪有限公司;表达载体pET-30a由中国农业科学院北京畜牧兽医研究所提供。
1.3 方法
1.3.1 目的片段的扩增 根据GenBank的EMCV VP1的基因设计引物。设计时在上下游引物中分别引NdeI和HindIII的限制内切酶的识别位点,上游引物:5′-CGCCATATGACCATGGGAGTAGAAAACGCTGAAAAAGGGG-3′;下游引物:5′-CCCAAGCTTTTACTCTAGCATCAAGACTC CAGCTC TC-3′,预期扩增目的片段的大小为867 bp。取250 μL病毒液,按照1.2试剂盒说明提取RNA并反转录成cDNA,常规PCR扩增(退火温度63 ℃,退火20 s,延伸30 s,共35个循环)。
1.3.2 VP1基因的克隆 扩增产物琼脂糖凝胶电泳,DNA回收试剂盒回收纯化的目的片段与pEASY-Blunt Zero克隆载体连接,转化DH5α感受态细胞。随机选取白色菌落,加入含Amp的LB液体培养基中,37 ℃振荡培养8 h,小量提取质粒,进行PCR鉴定并测序以验证其正确性。
1.3.3 VP1基因重组表达质粒的制备 取重组Blunt-VP1质粒和表达载体pET-30a,按照说明书进行NdeI和HindIII双酶切并回收酶切产物,T4 DNA Ligase于22 ℃连接1 h,转化感受态E.coliBL21(DE3)。振荡培养,挑选白色菌落提取质粒,进行NdeI和HindIII双酶切鉴定和PCR鉴定。将阳性重组质粒命名为pET-30a-VP1。
1.3.4 重组蛋白的诱导表达和可溶性分析 取含有重组质粒pET-30a-VP1的宿主菌BL21(DE3)接种于含Kan+的LB液体培养基中,37 ℃ 200 r/min振荡培养至细菌生长对数期(OD600值达到0.6~0.8之间)[7]。加入IPTG诱导,终浓度为0.5 mmol/L IPTG,继续37 ℃ 诱导0、1、2、3、4 h;离心收集菌体,1×PBS重悬菌体,超声波裂解,分别取上清和沉淀并加入5×SDS Loading缓冲液,煮沸,SDS-PAGE电泳分析,以确定表达产物形式。
1.3.5 VP1重组蛋白的纯化 鉴于重组蛋白pET-30a-VP1表达于细菌包涵体中,故采用常规方法[8],用配置好的Ni-琼脂糖凝胶FF纯化(His-Tag)重组蛋白试剂,纯化目的蛋白,收集不同浓度洗液的蛋白流出液制样, SDS-PAGE分析重组蛋白的纯化效果。将纯化后的重组蛋白用PBS缓冲液透析,除去溶液中的咪唑。
1.3.6 重组蛋白的Western blotting检测 对Ni柱纯化好的蛋白进行SDS-PAGE,湿转印至NC膜,5%脱脂乳4 ℃封闭过夜,TBST洗涤3次,1∶3 000稀释的His抗体室温摇床2 h,TBST洗涤3次;1∶4 000稀释的山羊抗鼠IgG作用1 h,TBST洗涤3次,加入底物(DAB)避光显色,直至出现明显条带后蒸馏水终止反应。
2 结果与分析
2.1 VP1目的片段扩增与鉴定
将PCR产物于2%琼脂凝胶中进行电泳检测,可见867 bp的目的片段,与预期的大小相符(图1),并且测序结果与目的基因序列一致。

注:M. DNA Marker;1. VP1基因。Note:M. DNA Marker; 1. VP1 gene.图1 EMCV VP1基因的RT-PCR 扩增Fig.1 RT-PCR amplification of VP1 gene from EMCV
2.2 pET-30a-VP1原核表达载体的构建
构建的重组质粒以NdeI和HindIII双酶切鉴定,大小约为867 bp和5.4 Kb左右的条带,说明已成功构建pET-30a-VP1重组质粒(图2)。

注:M. DNA Marker;1. pET-30a-VP1重组质粒Nde I和Hind III双酶切产物。Note: M. DNA Marker; 1. Double enzyme digestion of pET-30a-VP1 with Nde I and Hind III. 图2 pET-30a-VP1双酶切鉴定Fig.2 Double enzyme digestion of pET-30a-VP1
2.3 重组蛋白的诱导表达和纯化
经SDS-PAGE分析,pET-30a-VP1经IPTG诱导后成功表达,在约31.5 kD可见与预期相符的表达蛋白的条带,诱导4 h后表达量最高(图3)。对诱导表达后的菌液取上清液和沉淀进行可溶性分析。上清中未出现目的条带,沉淀中可见条带,说明VP1重组蛋白主要以包涵体的形式存在。取表达4 h的菌液裂解物上清,经Ni-琼脂糖凝胶FF纯化,通过SDS-PAGE分析,获得较纯的重组蛋白,重组菌的纯化产物中目的蛋白占绝大多数(图4)。
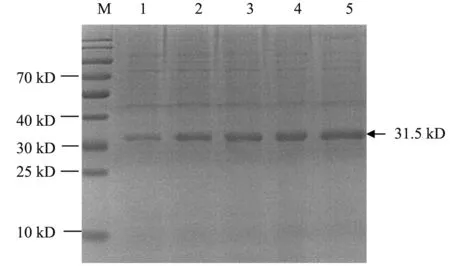
注:M.预染蛋白标准;1. 诱导0 h;2. 诱导1 h; 3. 诱导2 h;4. 诱导3 h;4. 诱导4 h。Note: M. stained protein MW Marker; 1. Induction for 0 hour; 2. Induction for 1 hour; 3. Induction for 2 hours; 4. Induction for 3 hours; 5. Induction for 4 hours.图3 VP1蛋白表达诱导时间的优化Fig.3 Optimization of induction time on VP1 protein expression

注:M.预染蛋白标准;1.重组菌裂解上清;2.重组菌裂解沉淀;3.变性后的上清;4.变性后的沉淀; 5. VP1蛋白纯化产物。Note: M. stained protein MW Marker; 1. Precipitation of sonic vibrated pET-30a-VP1; 2. Supernatant of sonic vibrated pET-30a-VP1; 3. Denaturing supernatant; 4. Denaturing precipitation; 5. Purified VP1 protein.图4 VP1蛋白诱导表达和纯化Fig.4 The induced expression and purification of VP1 protein
2.4 重组蛋白的Western-blot分析
将纯化的重组蛋白进行Western-blot分析,在31.5 kD左右出现单一的条带,条带的大小与纯化的蛋白大小一致。表明带有His标签的重组蛋白在大肠杆菌中得到正确表达,见图5。
3 讨 论
脑心肌炎是一种以脑炎、心肌炎或心肌周围炎为主要临床特征的急性人畜共患性传染病[9],有广泛的宿主。中国在畜牧业中对于脑心肌炎病毒的研究比较多。人类易受EMCV感染,如在菲律宾出现发烧性疾病的17名士兵中发现针对EMCV的中和抗体[10]。有研究发现,超过5%接触动物的职业者EMCV的检测血清为阳性,猎人的比例达到15%[11],体现EMCV还具有公共卫生意义。EMCV在健康中国人的血清流行率约为30.56%[12],可见这种感染相当普遍,且感染后并没有明显的临床症状,但并不能否认该病毒会对公共卫生安全造成一定的威胁。近几年,随着人民生活水平的提高,伴侣动物(尤其是宠物犬)在人类生活中越来越普遍存在,这些动物的健康将潜在影响人类的健康,有必要关注人类和犬类的EMCV感染情况,给予重视。本研究通过原核表达制备可用于犬EMCV血清学检测的抗原,为后续建立犬间接ELISA检测方法提供依据。
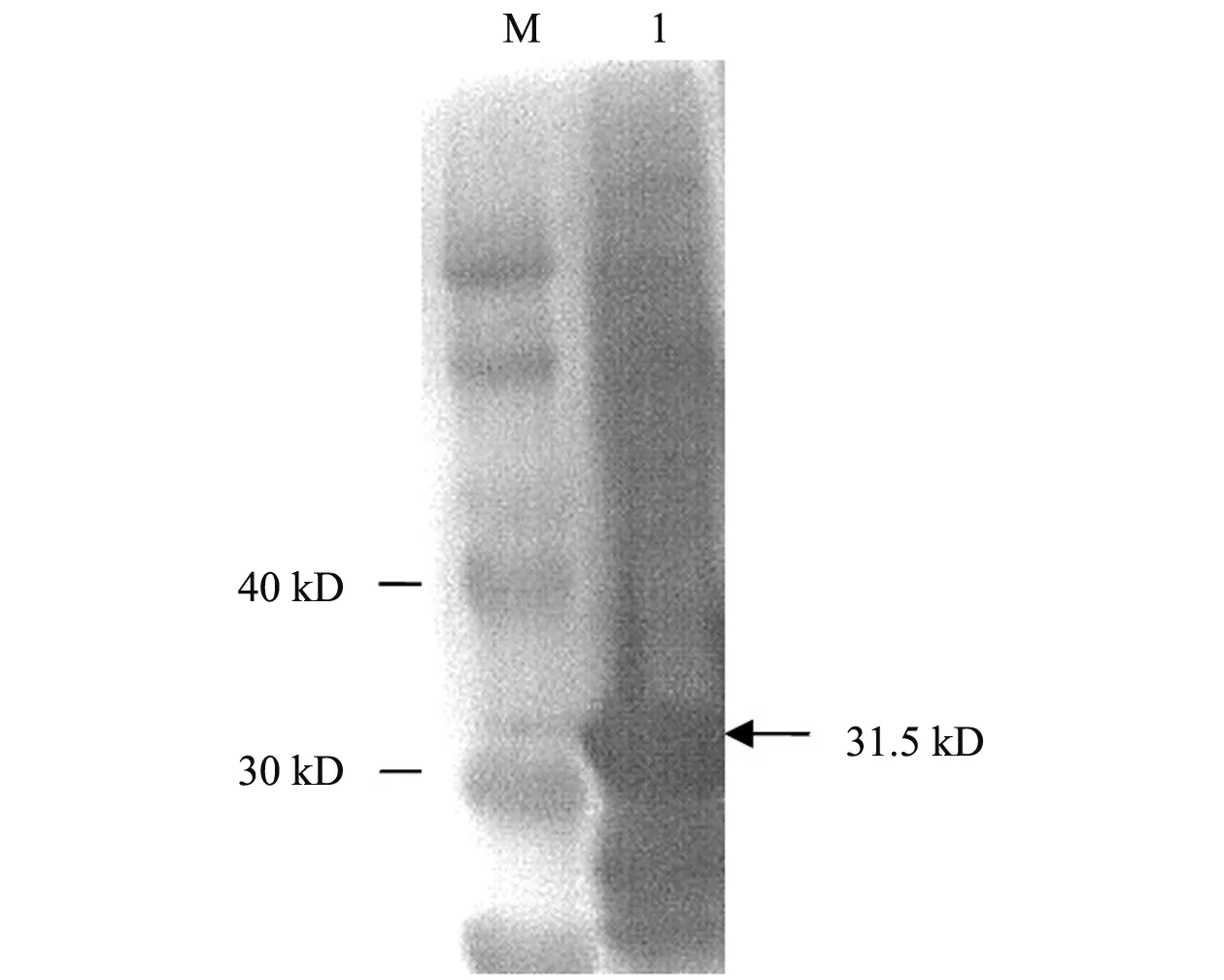
注:M. 预染蛋白标准;1. VP1蛋白纯化产物Note: M. Stained protein MW Marker; 1. Purified VP1 protein.图5 VP1蛋白His标签的Western blot鉴定Fig.5 Identification of VP1 protein His-tag with Western-blot
已有研究证实从中国犬中分离到的EMCV C15菌株与菌株EMCV BJC3具有最高的序列相似性(99.5%)[12]。本试验主要针对EMCV BJC3毒株,利用原核表达载体pET-30a(+)对EMCV VP1蛋白进行表达,借助载体多克隆位点两端携带的His标签对重组VP1蛋白进行纯化。重组菌经IPTG诱导表达显示在37 ℃诱导4 h,IPTG浓度为0.5 mmol/L时表达量最大。同时,本试验对重组蛋白的可溶性分析,发现重组的VP1蛋白以不溶性包涵体的形式表达。值得注意的是,为提高VP1蛋白的纯度,本试验在洗涤蛋白的过程中逐渐将洗涤缓冲液中的咪唑由20 mmol/L提高至80 mmol/L,获得纯度较高的重组VP1蛋白。在Western-blot鉴定下,可见31.5 kD处有明显的蛋白印迹条带,表明VP1蛋白在原核表达系统中可高效表达,重复性的蛋白具有良好的反应原性,说明本试验成功制备了犬EMCV血清学检测用的抗原,为后期建立犬EMCV血清学检测手段和研发亚单位疫苗提供良好的抗原。
4 结 论
成功构建pET-30a-VP1重组质粒。重组VP1蛋白以包涵体的形式通过原核表达系统获得高效表达,并且获得较纯的EMCV VP1蛋白,可用于建立犬的EMCV的间接ELISA检测方法。

