基于SSR标记的树莓资源遗传多样性分析
邓宽平 杨秀伟 杨胜伟 杨选辉 张永刚 陈荣辉 徐德林
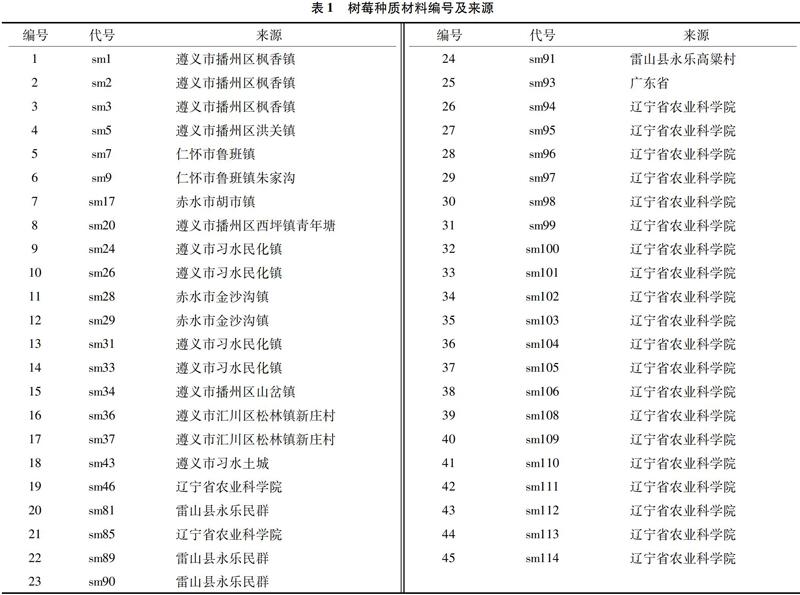

摘要:为探索树莓种内个体之间和不同树莓品种间的遗传特性,应用SSR标记开展树莓的遗传多样性分析。对引进、收集的树莓种质资源进行基因组DNA提取,然后应用PCR扩增和PAGE電泳检测筛选材料间的多态性SSR标记,利用NTsys 2.10 e软件进行遗传多样性分析。结果表明,从75对SSR标记中筛选出22对多态性良好的标记引物,共扩增得到285个条带,引物扩增出的清晰条带数为7~25个,平均每对引物的多态性比率为96.8%。对引物的扩增结果进行聚类分析发现,树莓样品在遗传系数为0.71的水平上共聚类为两大类群,第一类包括21份树莓样品,其中除sm46、sm85、sm102从辽宁省农业科学院引种外,其余树莓样品均来自贵州省,从辽宁省农业科学院引种的22份树莓样品,除上述归为第一类的3份外,其余的与贵州省遵义市习水土城、贵州省雷山县永乐、从广东省引种的树莓样品归为第二大类。45份树莓具有较丰富的遗传多样性,筛选出的SSR可有效应用于贵州省树莓品种的遗传多样性研究。
关键词:树莓;SSR标记;种质资源;遗传多样性;聚类分析
中图分类号:S663.202 文献标志码:A 文章编号:1002-1302(2020)21-0062-06
树莓(Rubus corchorifolius L.),别称悬钩子、托盘、马林等,为蔷薇科(Rosaceae)树莓属(Rubus,别称悬钩子属)的多年生灌木浆果类植物,其果实具有外观鲜艳、口感细腻、风味芳香等特点,除用作生食果品外,还可加工制成果酱、果酒、果汁、果冻、果羹及蜜饯等食品。此外,树莓还是药用植物,果实、茎、根皆可入药,主要功效为醒酒、止渴、止血、解毒、镇痛等。树莓属植物在我国27个省(自治区)均有分布,并以西南地区分布最为集中,其中分布最广泛的省份是贵州省、云南省、四川省、广西壮族自治区、广东省、福建省,其次为湖南省、湖北省及西藏自治区、陕西省、甘肃省等[1-3],且是贵州省山地农业开发的重要经济作物。
我国约在20世纪80年代开始大面积栽培树莓,但品种选育工作尚处于起步阶段,再加上树莓育种过程中,会受到多倍体、无融合生殖、花粉不亲和、种子发芽率低等遗传问题的影响[4-5],树莓育种工作变得漫长而复杂。因此,结合地区经济发展实际,选择根系发达、抗旱能力强的优良树种对改善树莓种植业结构、增加农民受益、带动地方经济发展等具有重大意义。基于树莓的经济和药用价值以及育种过程中所遭遇的亟需解决的问题,从分子水平探讨树莓属内亲缘关系,对种质资源进行遗传分析和种质评价,可进一步了解树莓亲缘关系和遗传差异,为树莓遗传多样性研究、保育策略制定和杂交育种提供理论依据。
简单重复序列(simple sequence repeat,简称SSR)是一类一般由1~6个碱基组成的基元串联重复而成的DNA序列[6]。不同等位基因间的重复数存在丰富的差异,且重复序列两侧多是相对保守的单拷贝序列,可以通过设计特异引物,对基因组总DNA进行PCR扩增[7-8],扩增片段的长度多态性可用作分子标记。SSR标记是以SSR多态性为基础的遗传标记,与其他分子标记相比,具有多态性高、共显性、重复性高、数量丰富和对基因组有很好的覆盖性等特点[9-10],被广泛地用于构建植物遗传图谱[11]、遗传多样性分析[12-13]、基因定位[14]、辅助育种等基础应用研究中[15-16]。利用SSR分子标记技术可为树莓分类提供分子基础,并了解其遗传多样性。
本试验使用SSR分子标记技术对45份树莓样品的遗传多样性进行研究,旨在为树莓的种群鉴别、资源评价与保护的策略制定、功能基因克隆以及杂交育种选育新品种提供理论依据。
1 材料与方法
1.1 材料
试验于2019年7月进行,采集新鲜、饱满、无病虫的树莓嫩叶10~20 g,就地迅速保存于自封袋中,置于冰盒中,带回实验室于4 ℃冰箱内保存,用于DNA的提取。树莓种质材料样品信息见表1。
1.2 研究方法
1.2.1 DNA提取 使用植物基因组DNA提取试剂盒(型号为DP350-02,本试剂盒采用的是可以特异性结合DNA的吸附柱和独特的裂解液缓冲体系,能高效提取多种不同植物组织中的基因组DNA)对45份树莓材料的DNA进行提取,并加入缓冲液保存于-20 ℃冰箱中。
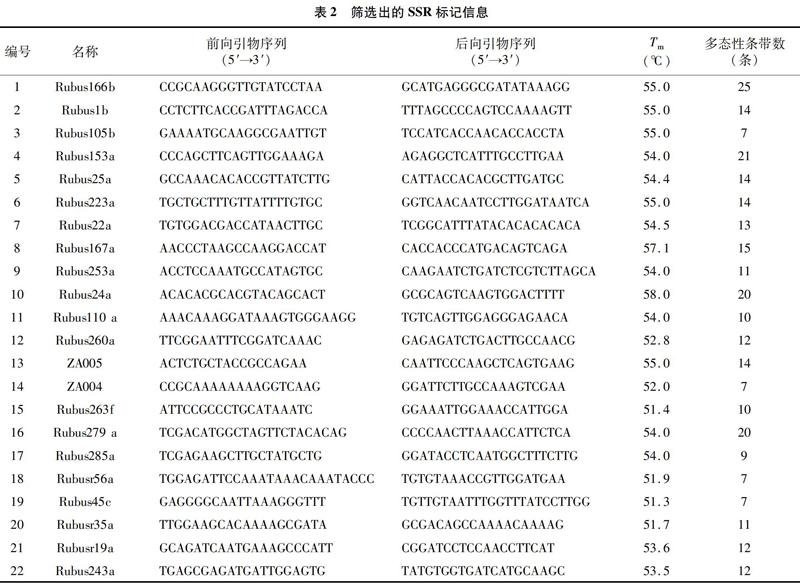
1.2.2 SSR引物筛选 以sm43、sm95、sm96、sm99、sm103号样品DNA为模板,进行引物筛选。先从笔者所在课题组合成的75对树莓特异SSR引物中挑选出38对扩增稳定、条带清晰、多态性明显的SSR引物,然后进行体系优化,从38对引物中筛选出22对重复性高的引物,用于45个树莓样品DNA的PCR扩增及多态性检测。引物信息见表2。
1.2.3 SSR-PCR扩增 用筛选出的22对引物扩增45份DNA样品。树莓SSR-PCR反应体系为 10 μL,其中包括ddH2O 1 μL、DNA模板1.5 μL、Primer-F 和Primer-R各0.75 μL、Mix 6 μL。PCR扩增程序为95 ℃预变性4~5 min;95 ℃变性30 s,55 ℃退火温度30 s,72 ℃延伸40 s,共35个循环;72 ℃延伸5 min,最后4 ℃ 59 min。
1.2.4 电泳、染色 利用8%非变性聚丙烯酰胺凝胶对扩增产物在垂直电泳槽中进行电泳分离,条件为150 V 90 min。电泳后银染显色(染色剂:1 g AgNO3+500 mL H2O,显色剂:2 mL甲醛、7.5 g NaOH,加ddH2O至250 mL,拍照记录显影图片。
1.3 数据分析
根据显影图片,SSR位点按照位点顺序以及等位基因片段大小排列,采用“0,1”统计方法进行试验数据记录[17]。
根据统计结果,利用NTsys 2.10e软件得出样品的遗传相似系数和UPGMA聚类图,进而得出样品之间的遗传关系[18]。
2 结果与分析
2.1 DNA提取结果
使用植物基因组DNA提取试剂盒(型号为DP350-02 )提取 45份树莓鲜嫩叶片样品的基因组 DNA,结果(图1)显示,45份树莓样品基因组DNA的电泳条带清晰、无降解、纯度较高,说明提取的DNA质量可满足后续PCR扩增反应的要求。
2.2 SSR标记的多态性
以sm43、sm95、sm96、sm99、sm103号材料的基因组DNA为模板,对75对引物进行PCR扩增、筛选,其中有38对引物产生理想的PCR产物。部分引物筛选结果见图2。
通过优化体系,从38对引物中筛选出22对扩增条带清晰、重复性高的SSR引物,用于45份树莓样品DNA的PCR扩增及多态性研究。结果表明,筛选出的22对SSR引物对45份树莓样品DNA进行PCR扩增后,共得到285个条带,不同引物扩增出的清晰条带在7~25个范围内,平均每对引物产生12.9个条带,其中多态性条带有276个,多态性比率为96.8%,各引物的多态性比率为85.71%~100.00%。引物Rubus25a对45份材料的检测结果(图3)表明,树莓样品的遗传多样性较为丰富。
2.3 居群遗传结构
根据45份树莓样品DNA的SSR PCR扩增结果得到的相似系数进行聚类分析结果(图4)表明,当阈值为0.71时,45份样品被分为两大类群。
第一大类由编号为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、19、21、22、34等21份树莓样品组成,其中除19、21、34从辽宁省农业科学院引种外,其余树莓样品均来自贵州省,它们可在阈值为 0.745 5 时,进一步分为6个亚类。第1亚类由编号为1、2、3、4、8、9、10、13、15、16、17、19的样品组成;第2亚类仅有由编号为14的样品组成;第3亚类由编号为6、7、11、12的样品组成;第4亚类仅由编号为5的样品组成;第5亚类由编号为21、22的样品组成;第6亚类仅由编号为34的样品组成。
第二大类由编号为18、20、23、24、25、26、27、28、29、30、31、32、33、35、36、37、38、39、40、41、42、43、44、45等24份樹莓样品组成。其中除18、20、23、24为贵州省品种、25引种自广东省外,其余树莓样品均来自辽宁省农业科学院。它们可在阈值为0.734 8时进一步分为5个亚类。第1亚类由编号为18、32、35、36、39的样品组成;第2亚类由编号为20、24、26、27、41、42、43、44、45的样品组成;第3亚类由编号为23、30、33、37、40的样品组成;第4亚类由编号为25、28、29、31的样品组成;第5亚类仅由编号为38的样品组成。通过聚类分析结果可知,不同类型的树莓品种之间遗传相似性较小,不同来源的树莓品种间亲缘关系也比较远。
3 讨论与结论
本研究结果表明,从辽宁省农业科学院引种的样品44和45亲缘关系最近,其遗传相似系数为0.917 6。来自赤水市金沙沟镇的样品12和从辽宁省农业科学院引种的样品32遗传相似系数最小,为0.627 2。研究表明,遗传距离与杂种优势存在相关关系,遗传相似系数越小,其杂种优势越大[19],因此育种时可选取样品12和样品32作为亲本进行杂交,选育优良品种应用于生产。
同时来自不同省份的树莓样品亲缘关系可以很近,如播州区枫香镇的样品1和从辽宁省农业科学院引种的样品19,二者虽生长在不同地区,但二者遗传相似系数为0.799 3,亲缘关系很近,推测样品1和样品19虽然来自不同地区,但存在树莓品种相互引进种植等问题,同一种属的树莓因生长在不同的土壤、养料、温度和水分环境下,其遗传性状发生了变化,具体原因需进一步研究。与此同时,采集自同一省份同一地区的树莓样品亲缘关系也会相距甚远,如遵义市习水民化镇的样品14和遵义市习水土城的样品18亲缘关系较远,遗传相似系数为0.673 8,推测可能是因其种子以及花粉的散布,出现种内或种间的杂交,导致种内甚至种间基因交流。
遗传多样性是植物种质资源研究的重要内容之一,全面地掌握现有种质资源的遗传多样性,可以减少育种工作中亲本选配的盲目性,从而提高育种效率[18-19]。遗传多样性的研究最可靠的是基因水平的研究,其中进行基因测序是最直接、最具说服力的方法,但是对于一个物种或一个种属中的每个样品都进行基因组测序的可行性较低。SSR、扩增片段长度多态性(AFLP)、简单重复序列间扩增(ISSR)等技术的出现使得分子标记技术得到高速发展。
本研究通过SSR技术对树莓进行遗传多样性分析,该方法可直接通过样本DNA鉴别不同地区材料间的差异性,相对于传统形态学鉴定归类方法,用时较短且不受季节、环境限制。此外,还有利于树莓现有优良种质资源的研究,同时可为构建树莓遗传连锁图谱奠定基础。选用SSR分子标记技术对45份树莓品系进行遗传多样性研究,从75对引物中筛选出22对进行PCR扩增,共得到285个条带,不同引物扩增出的清晰条带在7~25个范围内,平均每对引物产生12.9个条带,其中多态性条带276条,多态性比率为96.8%,各引物的多态性比率为85.71%~100.00%。同时本研究初步明晰了贵州省部分树莓品种的亲缘关系,并应用22对SSR引物将贵州省推广种植的45个树莓品种区分开。表明SSR标记技术是一种对于树莓遗传多样性研究较为合适的方法。开发树莓的SSR标记不仅可进一步提高遗传多样性分析的可靠性,而且更容易实现数据的共享,可有力促进树莓优良品种选育进程和产业延伸。今后可根据聚类分析结果鉴定与分析特定优良品种的抗性或农艺性状,培育出适合生产应用推广的高质量树莓品种。
参考文献:
[1]左经会,向 红,王绪英,等. 贵州西部悬钩子属植物资源研究及开发利用[C]//中国植物学会第十六次全国会员代表大会暨85周年学术年会论文摘要汇编,2018.
[2]杨鼎元,张群英,陈 哲,等. 悬钩子属植物的组培快繁技术研究进展[J]. 现代园艺,2019(11):16-18.
[3]桂明珠,胡宝忠. 小浆果栽培生物学[M]. 北京:中国农业出版社,2002:36-38.
[4]郭清明. 优良树莓品种及当地野生树莓的引种比较研究[J]. 低碳世界,2017(34):344-345.
[5]刘 会,彭春钰,武忠亮,等. 植物SSR标记开发及应用研究进展[J]. 科学技术创新,2018(36):18-20.
[6]徐德林,陈红波,马 激,等. 白及SSR-PCR扩增体系的优化[J]. 中成药,2018,40(12):2672-2676.
[7]Li L,Fang Z W,Zhou J F,et al. An accurate and efficient method for large-scale SSR genotyping and applications[J]. Nucleic Acids Research,2017,45(10):e88.
[8]Xu D L,Chen H B,Aci M,et al. De Novo assembly,characterization and development of EST-SSRs from Bletilla striata transcriptomes profiled throughout the whole growing period[J]. PLoS One,2018,13(10):e0205954.
[9]李媛媛,郭修武,代汉萍,等. 树莓SSR体系的建立及优化[J]. 沈阳农业大学学报,2009,40(4):478-480.
[10]Dong H,Shang X D,Zhao X Y,et al. Construction of a genetic linkage map of Lentinula edodes based on SSR,SRAP and TRAP markers[J]. Breeding Science,2019,69(4):585-591.
[11]Adjebeng-Danquah J,Manu-Aduening J,Asante I K,et al. Genetic diversity and population structure analysis of Ghanaian and exotic cassava accessions using simple sequence repeat (SSR) markers[J]. Heliyon,2020,6(1):e03154.
[12]忻 雅,方献平,王淑珍,等. 簡单重复序列标记和序列相关扩增多态性标记在草莓遗传多样性分析中的比较[J]. 浙江大学学报(农业与生命科学版),2019,45(3):278-287.
[13]张怀山,鄢秀芹,鲁 敏,等. 基于EST-SSR标记的贵州野生刺梨居群遗传多样性分析[J]. 中国农业科学,2017,50(6):1098-1108.
[14]吴 晶,项显波,陆开形,等. 水稻超短根突变体ssr1的遗传分析和基因定位[J]. 西北植物学报,2015,35(4):701-706.
[15]单红丽,李文凤,黄应昆,等. 甘蔗抗褐锈病基因定位亲本间多态性SSR标记筛选[J]. 核农学报,2019,33(11):2119-2125.
[16]Dipnarayan S,Rajeev S R,Sukla C,et al. Development of a set of SSR markers for genetic polymorphism detection and interspecific hybrid jute breeding[J]. The Crop Journal,2017,5(5):416-429.
[17]Qi Z,Mu K M,Ni Z X,et al. Analysis of genetic diversity of ancient ginkgo populations using SSR markers[J]. Industrial Crops and Products,2020,145:111942.
[18]苏一钧,王 娇,霍恺森,等. 甘薯引进种SSR遗传多样性分析[J]. 江苏农业学报,2018,34(5):984-997.
[19]张鹤山,陈志宏,田 宏,等. 49份白三叶种质资源遗传多样性的SSR分析[J]. 种子,2019,38(11):1-6.于少帅,赵文霞,姚艳霞,等. 新疆野苹果和栽培苹果特异性SSR标记开发及应用[J]. 江苏农业科学,2020,48(21):68-73,83.

