人骨髓胎儿间充质干细胞在小鼠体内的分化*
朱 慧 吴菲菲 王正梅 张昆龙 杨 依 王亚云△
(1 延安大学医学院解剖学教研室,延安 716000;2 空军军医大学基础医学院基础医学教学实验中心,西安 710032)
杜氏肌营养不良症(Duchenne muscular dystrophy,DMD)是一种致死性X连锁隐性遗传病,患者缺少编码肌营养不良蛋白dystrophin的基因,活产男婴的发病率为1/3 500,目前我国受该疾病困扰的患者有7~8万人[1]。最终平均22岁时因循环或呼吸衰竭死亡[2]。该病的治疗方法一直是医学界的难题。近期研究表明,干细胞具有归巢、促进损伤修复、旁分泌等生物学特性[3],为治疗DMD带来希望。Friedenstein等[4]首次分离到间充质干细胞(mesenchymal stem cell,MSC),确立了MSC的鉴定标准[5]为贴壁生长、成纤维细胞样形态特征,表达CD29、CD44、CD90、CD105而不表达CD34、CD45、MHC-Ⅱ等分子标志物。采用含10%胎牛血清的DMEM培养液可以分离到胎儿间充质干细胞(fetal mesenchymal stem cell,hfMSC),其特性与成体间充质干细胞(adult mesenchymal stem cell,aMSC)明显不同[6]。
X 染色体-连锁肌萎缩小鼠(X chromosomelinked muscular dystrophy deficient mouse,mdx小鼠)是国际公认的DMD 动物模型[7]。有研究证实MSC 可在mdx 小鼠体内产生dystrophin。为了进一步研究hfMSC 的特性,本研究从人胎儿骨髓组织中分离鉴定hfMSC,并以mdx 小鼠为动物模型,观察hfMSC 在mdx 小鼠体内产生dystrophin的可能性。
1 材料和方法
1.1 实验材料及动物
人胎儿骨髓组织的获得及细胞制备都经过相关伦理委员会批准,并获得产妇知情同意。DMD 模型种鼠由英国牛津大学Davies 教授惠赠(动物入境检疫许可证号为AD44010011),小鼠饲养于屏障系统环境动物实验室。
DMEM/f12 培养基、胎牛血清(fetal bovine serum,FBS)和trypsin-EDTA(Invitrogen,USA),流式细胞术抗体(Ebioscience,USA);一抗mouse-anti-human Oct-4、Nanog-3、dystrophin和 二 抗FITC-goat-anti-mouse IgG(Santa Cruz,USA);HRP-conjugated rabbit /mouse antibody(Gene,上海)。
1.2 hfMSC 的分离培养
无菌条件下,以5 mL 无菌注射器经流产胎儿(3~4月龄)两侧胫骨粗隆下方进针穿刺,采集骨髓,PBS 稀释后以1 200 r/min 进行离心,弃去上清液,重复2 次,将下层细胞贴壁培养,扩增分离hfMSC。用含10%新生牛血清的DMEM/F12 培养液重悬骨髓细胞并转移到培养瓶中静置培养。每2~4 d 换液,待细胞生长至80%融合状态时,用trypsin/EDTA 消化传代细胞。将第3 代细胞用于实验研究。
1.3 hfMSC 免疫组织化学染色鉴定
将无菌盖玻片分别置于6 孔板的6 个孔内,再将含10%FBS 的培养液悬浮细胞后滴入无菌盖玻片上,勿使细胞流出盖玻片外,待细胞贴壁后形成爬片,用移液枪从盖玻片边缘吸走培养液,加入4%甲醛固定,10 min 后吸走液体,加入0.5% Triton X-100,孵育10 min。PBS 摇床漂洗,封闭液孵育10 min 后再用PBS 漂洗,其中4 张盖玻片分别加一抗(Oct-4 和Nanog-3),保鲜膜包裹,置于4℃,第2 天PBS 漂洗,用HRP 标记的二抗孵育液30 min。不加一抗染色的细胞爬片为阴性对照,置于显微镜下观察。
1.4 hfMSC 流式细胞术鉴定
用生理盐水悬浮收集的第3代hfMSC,1 500 r/min 离心3 min,重复2次,制成单细胞悬液,浓度为5×105/mL,至少5 mL,将其分装至5个流式管,不加抗体的试管作为空白对照,另外4管分别加CD29-FITC、CD34-FITC、CD90-APC、CD105-PE单克隆抗体充分混匀,避光室温孵育30 min,PBS离心(1 500 r/min,3 min)漂洗以弃除未结合抗体,用PBS重悬至所需体积(每管5 mL左右)进行流式细胞仪检测。
1.5 mdx 小鼠的准备
将待鉴定子代鼠分组打耳号标记,将小鼠置于露尾固定器中,乙醇擦拭后剪断尾尖组织2~5mm,取自然滴下的200~400 μL 血液,滴入对应编号的抗凝管(加入120 μL ACD 抗凝剂的 1.5 mL EP 管)中。按照血液基因组DNA 提取试剂盒说明书要求的步骤提取DNA。TE 液稀释10 μL样品DNA,紫外分光光度计比色测定核酸A260 与蛋白质A280 值进行DNA 质量控制。序列特异性引物聚合酶链式反应(sequence specific primerspolymerase chain reactio,PCR-SSP)方法鉴定出基因型,其中mdx 小鼠用于实验研究。
1.6 动物分组及细胞注射
将mdx 小鼠随机分为移植组和对照组2 组,每组8 只。将已经制备的hfMSC 悬浮于生理盐水中,浓度为1×106/mL(其中一半用DIR 溶液标记,详述见1.2.3),以皮下注射方式,在移植组每只mdx小鼠腹股沟三角注射hfMSC,体积为0.2 mL,注意穿刺不宜过深,回抽无回血后输注,以免传入股动脉或股静脉等附近血管中。对照组mdx 小鼠相应部位注射生理盐水。
1.7 活体成像仪下观察及dystrophin免疫荧光染色检测
上述第3 代hfMSC,取其中1/2,加入0.1% 1,1-dioctadecyl-3,3,3,3-tetramethylindotricarbocyanine iodide(DIR)溶液(溶质为含10% FBS 的DMEM/F12 培养液)培养4 h 后,消化收集,用生理盐水重悬,调整浓度至1×106/mL,随机选取移植组中3 只mdx 小鼠,于其腹股沟三角注射该细胞悬液每只0.2 mL。随机选取对照组mdx 小鼠3 只注射等体积生理盐水。因活体毛皮有自发荧光影响观察,因此注射细胞后1 个月处死小鼠去除皮毛,取后肢于活体成像仪下观察。每只再取一部分腓肠肌组织制作冰冻切片,血清封闭处理后,加入dystrophin 一抗于4℃孵育过夜,加入二抗-FITC 避光孵育1 h,漂洗后镜下观察。
1.8 病理观察及安全性评估
取注射hfMSC 1月后的小鼠每组3 只处死取材,组织块大小不超过0.5 cm×0.5 cm×0.5 cm 为宜。先用0.9%的生理盐水漂洗,包埋,做好标记,然后迅速浸泡于4%多聚甲醛中固定,常规切片后H-E 染色,并显微镜下观察拍照记录。将移植组、生理盐水组的小鼠腓肠肌病理切片(每只小鼠随机选取1 张)在10×20 倍镜下随机挑选6 个视野,分别计数每个视野内的肌纤维总数和核中心位移纤维(centrally nucleated fiber,CNF)的数目,计算CNF 比例。CNF 比例=(核中心移位纤维数/总肌纤维数)×100%。
对注射hfMSC 组小鼠进行解剖,观察小鼠各个器官的形态结构以及是否出现肿瘤等肿块增生或者畸形等发生。
1.9 统计学处理
应用SPSS 20.0 软件进行统计学分析,计量资料以±s表示,组间比较采用独立样本t检验,组内比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 hfMSC 的形态特征和表型
用 含10%FBS的DMEM/F12培养液培养hfMSC,较易分离到贴壁生长的成纤维细胞样细胞。传代后呈对数增殖生长,排列紧密,呈旋涡状(图1A,见封三)。荧光免疫染色观察到贴壁生长的细胞的细胞核表达Nanog-3(图1B,见封三)和Oct-4(图1C,见封三)。流式细胞仪检测细胞表面免疫表型结果显示:CD29、CD90、CD105 高表达(图1E、F、G,见封三),而CD34 低表达(图1H,见封三),即表达MSC 的常见抗原标志,低表达造血干细胞常见抗原标志。
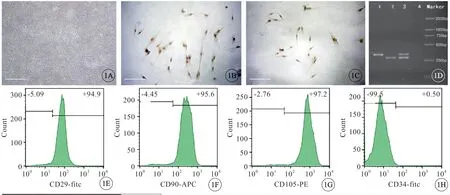
图1 hfMSC 的形态特征和mdx 小鼠的鉴定。A:旋涡状生长的hfMSC,bar=400 μm。B:Nanog-3 在 hfMSC 细胞核中表达,棕色,bar=100 μm。C:Oct-4 在hfMSC 细胞核中表达,棕色,bar=100 μm。D:3 种基因型小鼠的PCR-SSP 电泳图,采集杂合子小鼠全血提取的DNA 进行PCR-SSP 分析。1:mdx 小鼠(340 bp);2:dko 小鼠(285 bp);3:杂合子小鼠(285 bp+340 bp);4:纯水为样本作为空白对照。E-H:hfMSC 免疫表型分析,CD29 阳性表达(E),CD90 阳性表达(F),CD105 阳性表达(G),CD34 阴性表达(H).Fig 1 Characteristics of hfMSC and identification of mdx mice.A:hfMSC growing like vortex,bar=400 μm;B:Nanog-3 was expressed in hfMSC nucleus,brown,bar=100 μm;C:Oct-4 was expressed in hfMSC nucleus,brown,bar=100 μm;D:The PCR-SSP electrophoresis maps of the three genotype mice were used to identify mdx mice.The bands were as follows:1.mdx mice(340 bp);2.dko mice(285 bp);3.Heterozygous mice(285 bp+340 bp);4.Pure water was used as a blank control sample.E-H:Immunophenotypic analysis of hfMSC,CD29 positive expression(E),CD90 positive expression(F),CD105 positive expression(G),CD34 negative expression(H).
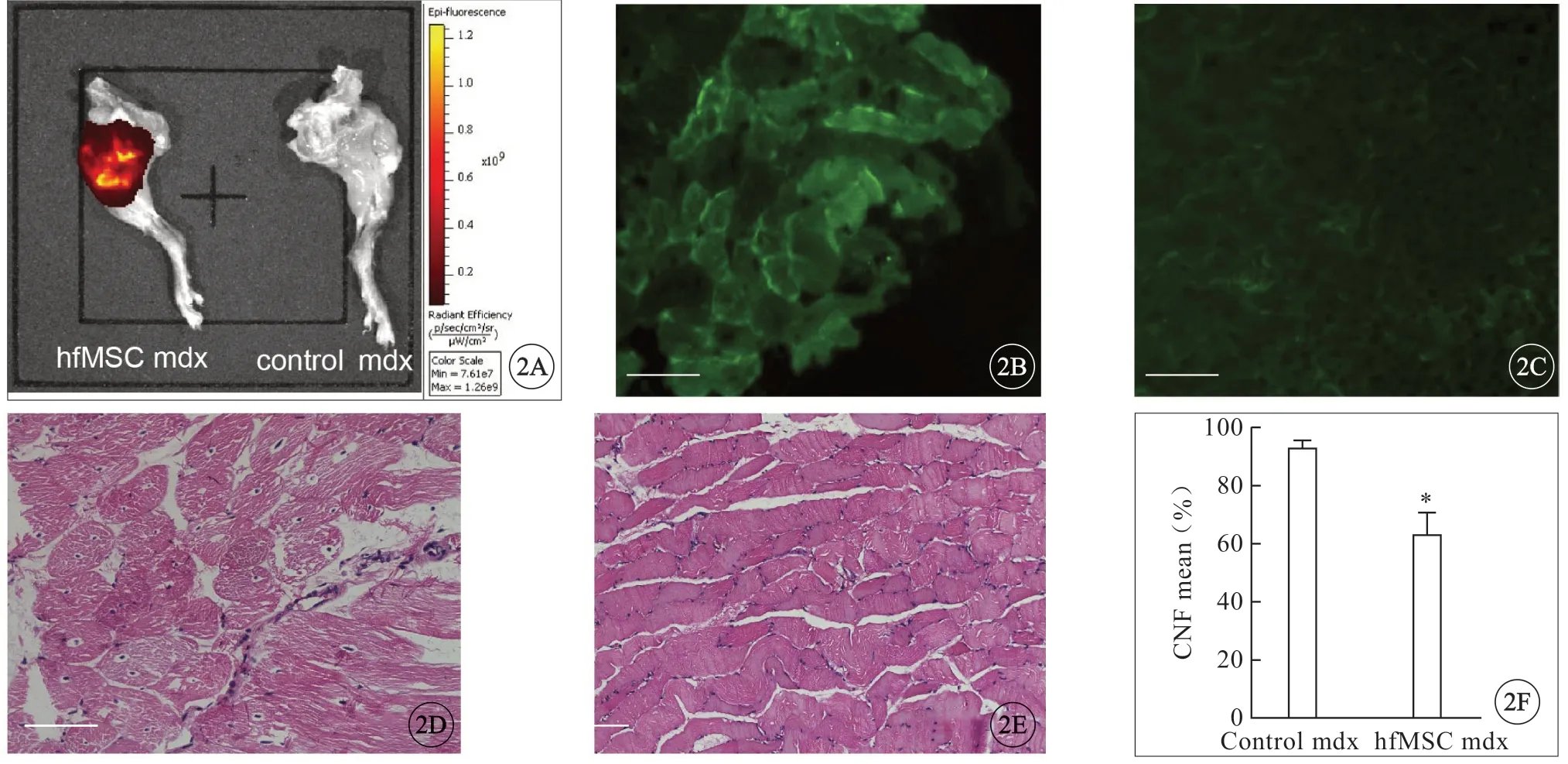
图2 hfMSC 可修复损伤肌组织,并重建dystrophin 的表达。A:离体mdx 小鼠后肢荧光成像,注射hfMSC-DIR 的mdx 小鼠后肢可见荧光(左)。对照mdx 鼠后肢未见荧光信号(右);B:注射hfMSC 的移植组mdx 小鼠肌细胞膜表达dystrophin,绿色荧光,bar=100 μm;C:对照mdx 小鼠肌组织无表达,bar=100 μm;D:对照组mdx 小鼠肌细胞核中心位移较多,肌纤维变圆,结缔组织在其间增生,bar=100 μm;E:移植hfMSC 组mdx 小鼠肌纤维较规整,核中心位移现象较少,bar=200 μm;F:对照组和实验组mdx 小鼠核中心位移纤维占比具有统计学差异.Fig 2 hfMSC could repair damaged muscle tissue and reconstruct the expression of dystrophin.A:Limbs isolated from mdx mice were exposed to imaging system.Fluorescence imaging of hindlimbs of mdx mice injected with hfMSC-DIR showed fluorescence sigal(left),no fluorescence signal in hind limbs of control mdx mice(right);B:The expression of dystrophin(green fluorescence)in the muscle cell membrane of mdx mice in the treatment group injected with hfMSC,bar=100 μm;C:No dystrophin(green fluorescence)expression in the muscle tissue of mdx mice in control group,bar=100 μm;D:In mdx mouse of the control group,most of the nucleus of the muscle cells were centrally moved,the muscle fibers became round,and the connective tissue proliferated,bar=100 μm;E:The muscle fibers of the mdx mice in the transplanted hfMSC group were more regular and the nuclear central displacement was less,bar=200 μm;F:CNF in mdx mouse of the two groups was statistically different;*P<0.01 vs control mdx.
2.2 mdx 小鼠的鉴定
用PCR-SSP 方法鉴定子代鼠,1 个340 bp 条带的是mdx 小鼠;1 个285 bp 条带的是dko 小鼠;340 bp 和285 bp 2 个条带的是杂合子mdx 小鼠(图1D,见封三)。本次鉴定出mdx 小鼠17 只,用于后续实验。
2.3 活体成像仪下观察结果及免疫荧光染色分析
因小鼠皮毛有自发荧光,黑色素是主要的自发荧光来源,其发光光线波长峰值在500~520 nm左右,血液也有自发荧光,这些非特异性荧光会影响检测的灵敏度,因此本实验将小鼠处死并去除皮毛再进行观察。mdx 小鼠腹股沟三角皮下注射hfMSC 1月后处死,进行一系列实验观察。注射hfMSC- DIR 组mdx 小鼠,小动物活体成像仪下可见后肢股直肌和腓肠肌等区域检测到强烈的荧光(信号颜色的范围是6.61×107~1.26×109,图2A 左,见封三),而注射生理盐水的对照组mdx 小鼠后肢肌则无荧光信号(图2A 右,见封三)。用免疫荧光法在mdx 小鼠腓肠肌纤维细胞膜上观察到人dystrophin 的表达(图2B,见封三),而对照组mdx 小鼠腓肠肌上则没有绿色荧光,即没有人dystrophin 的表达(图2C,见封三)。
2.4 腓肠肌病理变化分析
肌细胞核中心移位是评价肌组织坏死和再生的重要病理指标,通过观察病理切片并计算出CNF占所有肌纤维的比例,可以评价肌肉病理状况。正常肌纤维大小均匀,呈多角形近似六边形,排列整齐,无变性坏死的肌纤维,细胞核位于肌纤维的周边,肌间隙正常。对照组mdx 小鼠肌纤维失去正常的细胞形态,轮廓大都变圆,间隙增宽,脂肪、纤维结缔组织增生,肌纤维大小不等,部分裂开,部分呈均质性改变,肌细胞间存在大量纤维结缔组织增生和炎性细胞浸润(图2D,见封三),CNF 占比例较多;移植组肌纤维间隙变窄,排列较规整,CNF 占比减小(图2E,见封三),2 组之间CNF 存在显著差异(图2F,见封三)。
2.5 移植安全性评估
解剖观察分析每只注射hfMSC 的mdx 小鼠肌、脑、肺、心、胃、肝、脾、胆囊、肠、肾、骨髓等各器官及胸膜、腹膜等部位,形态结构均无异常,未发现肿瘤、畸形等情况。
3 讨论
本研究采用含血清的培养液容易从胎儿骨髓中分离获得贴壁密集排列、呈典型旋涡状生长的成纤维细胞样干细胞,从分离方法和细胞形态结构特征判断,完全符合MSC 的特点[8],且免疫染色分析显示这些细胞还表达胚胎干细胞标志性蛋白Oct-4 和Nanog-3。本团队早前研究无血清培养液从成体骨髓中获得的干细胞表达多潜能抗原标志[9],而且比传统意义上的MSC 具有更强的成肌分化能力。人体发育早期(胎儿期)骨髓中存在尚未分化的多潜能干细胞,在含血清的培养液中短期扩增可以维持干细胞的全能性,是获取分化能力强、分化方向多的“种子细胞”的良好来源。传统意义上的MSC 移植是安全的[10-12],与此同时,Oct-4 和Nanog-3 等通常是胚胎干细胞的抗原标志[7],hfMSC 表达这些多潜能抗原标志,与胚胎干细胞有一定相似性,也就是说hfMSC 兼具MSC 和胚胎干细胞2 种细胞的特性。理想的状态是hfMSC 作为种子细胞既具有MSC 的安全性,又具有胚胎干细胞的强分化、多分化能力。
本研究将DIR标记的hfMSC注射到mdx小鼠腹股沟三角皮下,移植后1月时在mdx小鼠后肢肌纤维丰富的部位检测到了明显的荧光信号,若细胞死亡且经过1个月的时间,则荧光信号将随代谢减弱,但本研究观察到荧光信号较强,表明注入皮下的细胞归巢到损伤肌细胞较多的区域定植。mdx小鼠不表达dystrophin。正常情况下dystrophin分布于骨骼肌和心肌细胞膜的质膜面,因此最初的hfMSC细胞上也没有表达dystrophin。本研究荧光免疫组织化学法检测到mdx小鼠肌组织中有人dystrophin的表达,且由荧光形态可见dystrophin分布于mdx小鼠肌细胞表面,并没有呈现hfMSC坏死破裂导致的弥散性分布,这更加证明了hfMSC在mdx小鼠体内可以存活,并且具有向肌细胞再生分化的功能,可以通过dystrophin修复损伤肌细胞。解剖观察肌组织及周围结构,没有发现异常结构或畸形、肿瘤,表明hfMSC虽然表达胚胎干细胞部分抗原标志,但hfMSC不像胚胎干细胞那样移植到体内会发育为畸胎瘤,反而具有MSC的安全性。这表明采用不同培养体系从不同组织来源分离获得的干细胞有可能呈现出不同的生物学特性[13]。若要更加广泛地用于再生医学研究,hfMSC的可行性及安全性仍然需要具体情况具体分析和更加深入细致地研究。