戊糖乳杆菌YY112产胞外多糖的发酵工艺条件优化
王明哲,杨 颖,唐伟敏,刘 哲,孙培龙,陆胜民,*
(1.浙江工业大学 海洋学院,浙江 杭州 310014; 2.浙江省农业科学院 食品科学研究所,浙江 杭州 310021)
乳酸菌(lactic acid bacteria,LAB)是一类可利用碳水化合物发酵生成乳酸的细菌的通称,广泛存在于自然界与生物体中,被公认为是安全的微生物,具有维持肠道菌群平衡、增强免疫力、降胆固醇、降血压、抗肿瘤、抗氧化、抗突变等一系列重要生理功能,是食品工业重要的发酵菌株[1],是发酵乳制品、肉制品、果蔬制品领域不可或缺的明星菌株,能够改善产品的风味,提高营养价值,延长保存时间[2]。乳酸菌还是益生菌家族的重量级成员,其应用领域涉及食品、饲料、保健品、医药,应用对象涉及人体、家禽、家畜、水产等[3],对于社会经济的重要性不言而喻。
胞外多糖(exopolysaccharides,EPS)是微生物分泌到细胞壁外的黏液多糖和荚膜多糖的总称,乳酸菌多糖具有抗肿瘤、抗突变、抗溃疡、抗炎症、免疫调节、降血压、降胆固醇等多种功能,已在制药领域和食品行业获得广泛应用与关注[4]。新型EPS的开发成为工业微生物研究的热点之一,其结构、性能也愈发受到重视[5]。乳酸菌EPS产量与菌株自身性质相关,也受到培养基营养成分和生长条件的影响[6-7],目前乳酸菌EPS的产量一般都比较低,通常为50~425 mg·L-1[8],通过优化发酵工艺参数,可以显著提高菌株EPS的产量[9]。作者从果蔬表面筛选到的戊糖乳杆菌YY112的多糖产量优化前即达到260 mg·L-1,具有实际应用的潜能。本试验研究发酵条件对其EPS产量的影响,为该菌株及其EPS的应用提供技术参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源
戊糖乳杆菌YY112:筛选于新鲜果蔬表面。
1.1.2 主要试剂
葡萄糖、蔗糖、乳糖、麦芽糖、果糖、乙酸钠、柠檬酸二铵、柠檬酸三铵、磷酸二氢钾、吐温-80、硫酸、苯酚、MgSO4·7H2O、MnSO4·4H2O、K2HPO4、HCl、NaOH等均为分析纯;蛋白胨、胰蛋白胨、大豆蛋白胨、酪蛋白胨均为生化试剂。
1.1.3 主要仪器
YXQ-50S11型立式压力蒸汽灭菌器,上海博迅医疗设备厂;FE28型pH计,上海梅特勒-托利多公司;SPX-250B-Z型生化培养箱,上海博迅医疗设备厂;SW-CJ-1FD型洁净工作台,苏州安泰空气技术公司;64RL高速冷冻离心机,美国Beckeman公司;UV-1800紫外可见分光光度计,日本岛津仪器公司;DK-320S电热恒温水槽,上海精宏实验设备有限公司;LABOROTA 4003型旋转蒸发仪,德国Heidolph公司。
1.2 试验方法
1.2.1 发酵液EPS的提取
取培养好的发酵液离心(20 min,10 000g,4 ℃)去除菌体,上清液中加入质量体积比80%的三氯乙酸溶液至最终质量体积比4%,4 ℃静置过夜,离心(20 min,10 000g,4 ℃)取上清液,加入3倍体积80%乙醇溶液,4 ℃静置12 h,离心(20 min,10 000g,4 ℃)取沉淀,蒸馏水溶解,经去离子水4 ℃透析48 h,每隔4 h换一次水,定容后以同样方法处理空白培养基作为对照,测EPS含量。
1.2.2 EPS含量测定
采用苯酚-硫酸法[10],以葡萄糖作为标准品,绘制标准曲线,得到线性回归方程:y=0.2606x+0.001,R2=0.9995。相同条件下测得波长490 nm处EPS水溶液的吸光度值,通过线性回归方程计算得到EPS含量。
1.3 试验设计
1.3.1 基础培养基的选择
分别配置MRS、SL、SDM、Elliker、PTYG、脱脂乳6种乳酸菌基础培养基[11],调节pH值至6.0,接入体积比2%活化种子培养液,37 ℃培养24 h,分别测定EPS含量,确定适宜基础培养基。
1.3.2 营养条件对EPS产量的影响
碳源对EPS产量的影响。以MRS培养基为基础培养基,分别添加2%葡萄糖、果糖、蔗糖、乳糖、麦芽糖,配置不同碳源MRS改良培养基,pH值调至6.0,接入体积比2%活化种子培养液,37 ℃培养24 h,分别测定EPS含量。
碳源添加量对EPS产量的影响。以MRS为基础培养基,分别添加质量体积比2%、3%、4%、5%的碳源,pH值调至6.0,接入2%活化种子培养液,37 ℃培养24 h,分别测定EPS含量。
氮源对EPS产量的影响。以MRS培养基为基础培养基,分别添加质量体积比1%大豆蛋白胨、胰蛋白胨、酪蛋白胨、普通蛋白胨配置不同氮源MRS改良培养基,pH值调至6.0,接入体积比2%活化种子培养液,37 ℃培养24 h,分别测定EPS含量。
氮源添加量对EPS产量的影响。以MRS为基础培养基,分别添加质量体积比0.5%、1%、1.5%、2%的氮源,pH值调至6.0,接入体积比2%活化种子培养液,37 ℃培养24 h,分别测定EPS含量。
酵母浸粉添加量对EPS产量的影响。以MRS为基础培养基,分别添加质量体积比0.25%、0.5%、0.75%、1%的酵母浸粉,pH值调至6.0,接入体积比2%活化种子培养液,37 ℃培养24 h,分别测定EPS含量。
正交试验优化营养成分。以碳源添加量、氮源添加量、酵母粉添加量为因素,EPS产量为指标,设计L9(33)正交试验,确定高产EPS的营养条件。
1.3.3 培养条件对EPS产量的影响
初始pH值对EPS产量的影响。将发酵培养基初始pH值分别调为5.0、6.0、7.0、8.0,接入2%活化种子培养液,37 ℃培养24 h,分别测定EPS含量。
接种量对EPS产量的影响。将培养基pH值调至6.0,分别将活化种子培养液以体积比1%、2%、3%、4%、5%接入发酵培养基中,37 ℃培养24 h,分别测定EPS含量。
培养温度对EPS产量的影响。将培养基pH值调至6.0,接入2%活化种子培养液,分别在20、25、30、35、40 ℃下培养24 h,分别测定EPS含量。
培养时间对EPS产量的影响。将培养基pH值调至6.0,接入2%活化种子培养液,37 ℃分别培养18、24、30、36、42 h,分别测定EPS含量。
1.3.4 响应面法优化培养条件
以接种量、培养温度、培养时间、初始pH值为因素,EPS产量为指标,采用Box-Behnken响应面法设计试验,确定最佳因素水平。
1.4 数据处理
使用Design-Expert. V 8.0.6试验设计软件设计试验[12],对试验数据进行方差分析、显著性差异分析和EPS产量预测。
2 结果与分析
2.1 基础培养基的选择
如图1所示,YY112在6种培养基中均可产生EPS,其中MRS培养基中产量最高,为259.98 mg·L-1;SDM培养基次之,产量为254.29 mg·L-1;脱脂乳中最低,为227.36 mg·L-1,本试验选择MRS培养基为基础培养基。
2.2 营养条件对EPS产量的影响
2.2.1 碳源种类与添加量
碳源为微生物生长代谢提供细胞碳架,为微生物生长、分裂提供物质基础,是影响微生物代谢产生EPS的重要因素之一[13]。不同菌种最适碳源种类往往不尽相同,其添加量对菌株EPS产量也有着重要影响。碳源对菌株YY112 EPS产量的影响如图2所示。
由图2-A可见,以蔗糖为碳源时,EPS产量最高,为274.26 mg·L-1,其次为葡萄糖(260.12 mg·L-1)、麦芽糖(253.09 mg·L-1)、乳糖(250.57 mg·L-1)、果糖(233.44 mg·L-1),故选择蔗糖作为碳源。由图2-B可见,EPS产量随蔗糖添加量增加而不断增加,当蔗糖添加量达到4%时,EPS产量最高,为292.99 mg·L-1,但与添加量为3%时EPS产量相比较(291.42 mg·L-1),差别不明显。综合考虑效率与经济性,选择蔗糖添加范围为2%~4%。
2.2.2 氮源种类与添加量
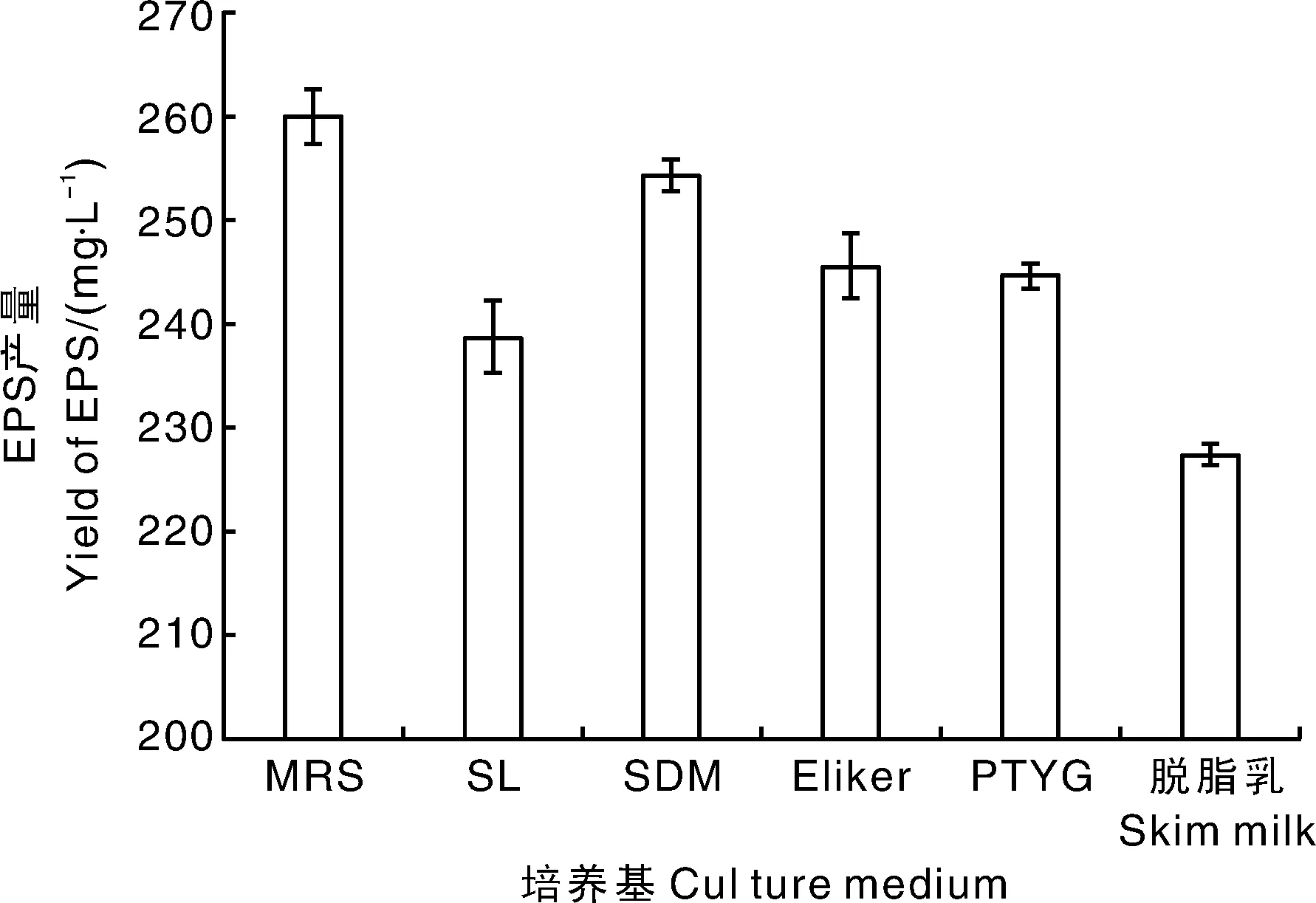
图1 不同培养基对YY112 EPS产量的影响Fig.1 Effects of different mediums on EPS yield of YY112
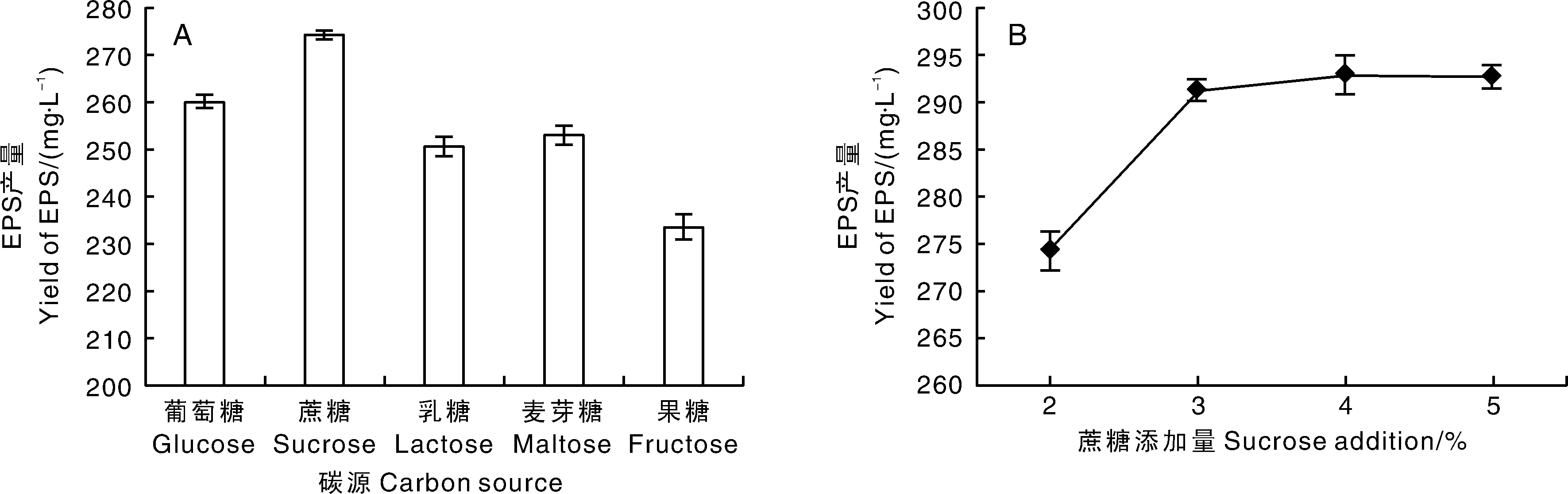
图2 碳源种类(A)和添加量(B)对EPS产量的影响Fig.2 Effects of carbon source species (A) and addition amount (B) on yield of EPS
氮源能提供微生物生长发育所必需的营养物质,是合成蛋白质和核酸所必不可少的原料,适合的氮源有利于菌体的生长代谢和EPS合成[14]。Garcia-Garibay等[15]的研究结果表明,在Lactobacillusdelbrueckiisubsp.bulgaricus菌株的牛奶培养基中添加酪蛋白可以促进菌株生长,提高其EPS产量。后续研究明确,不同菌株对营养的需求并不相同。Cerning等[16]发现,酪蛋白可以促进EPS的产量增加,但对于Lactobacillusdelbrueckiisubsp.bulgaricus菌株的生长没有明显影响。优化平衡碳源和氮源浓度是获得高产EPS的必要条件[17],碳源对YY112 EPS产量的影响如图3所示。
由图3可见,4种蛋白胨均可促进EPS合成,其中当添加大豆蛋白胨作为氮源时,EPS产量最高,为285.24 mg·L-1,其次为酪蛋白胨(274.46 mg·L-1)、蛋白胨(261.78 mg·L-1)、胰蛋白胨(270.80 mg·L-1),选择大豆蛋白胨作为添加氮源配制培养基。当大豆蛋白胨添加量为1%时,EPS产量最高,为285.22 mg·L-1,选择0.5%~1.5%为大豆蛋白胨添加量范围。
2.2.3 酵母浸粉添加量
酵母浸粉在发酵过程中为微生物提供有机氮源、维生素和生长因子等营养物质,是促进微生物生长代谢的重要有机物[18]。酵母浸粉添加量对EPS产量的影响如图4所示,EPS产量随酵母浸粉添加量增加而提高,当酵母浸粉添加量达到1.5%时,YY112 EPS产量最高,为276.58 mg·L-1,后趋于平稳,因此选择1%~2%作为酵母浸粉添加范围。
2.2.4 正交试验优化营养条件
通过结合单因素试验结果,以蔗糖添加量、大豆蛋白胨添加量、酵母浸粉添加量为因素,EPS产量为指标,设计L9(33)正交试验,试验因素水平见表1。
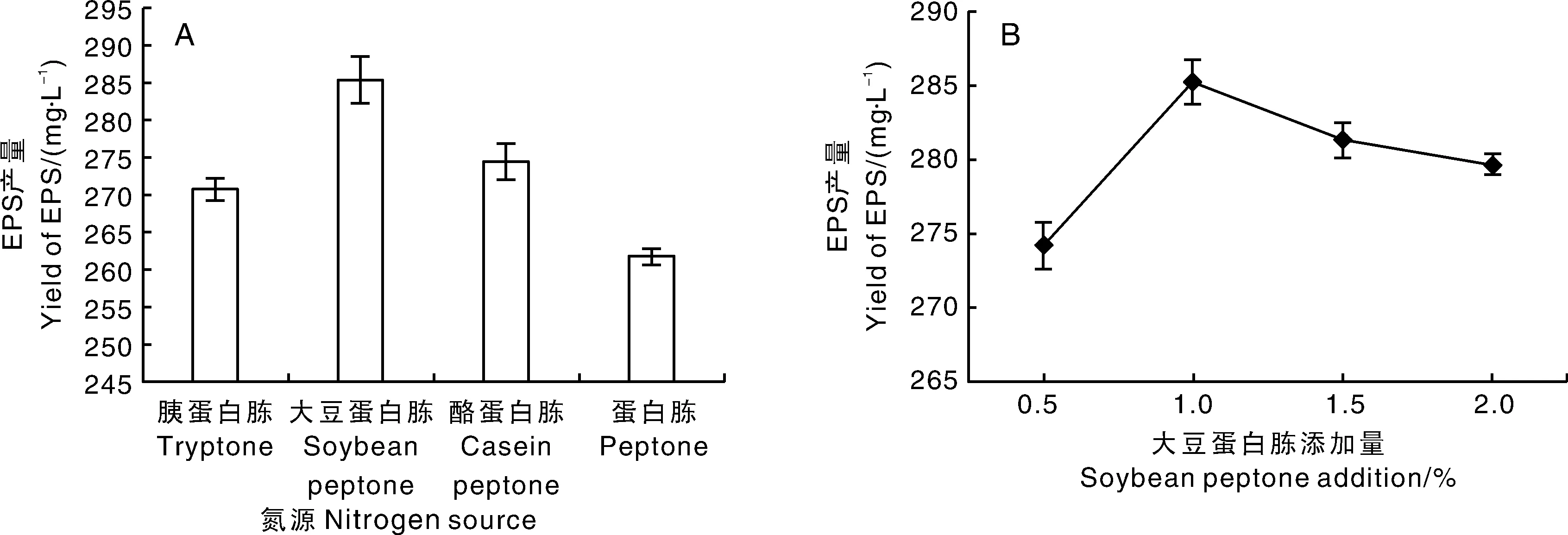
图3 氮源种类(A)和添加量(B)对EPS产量的影响Fig.3 Effects of nitrogen source species (A) and addition amount (B) on yield of EPS
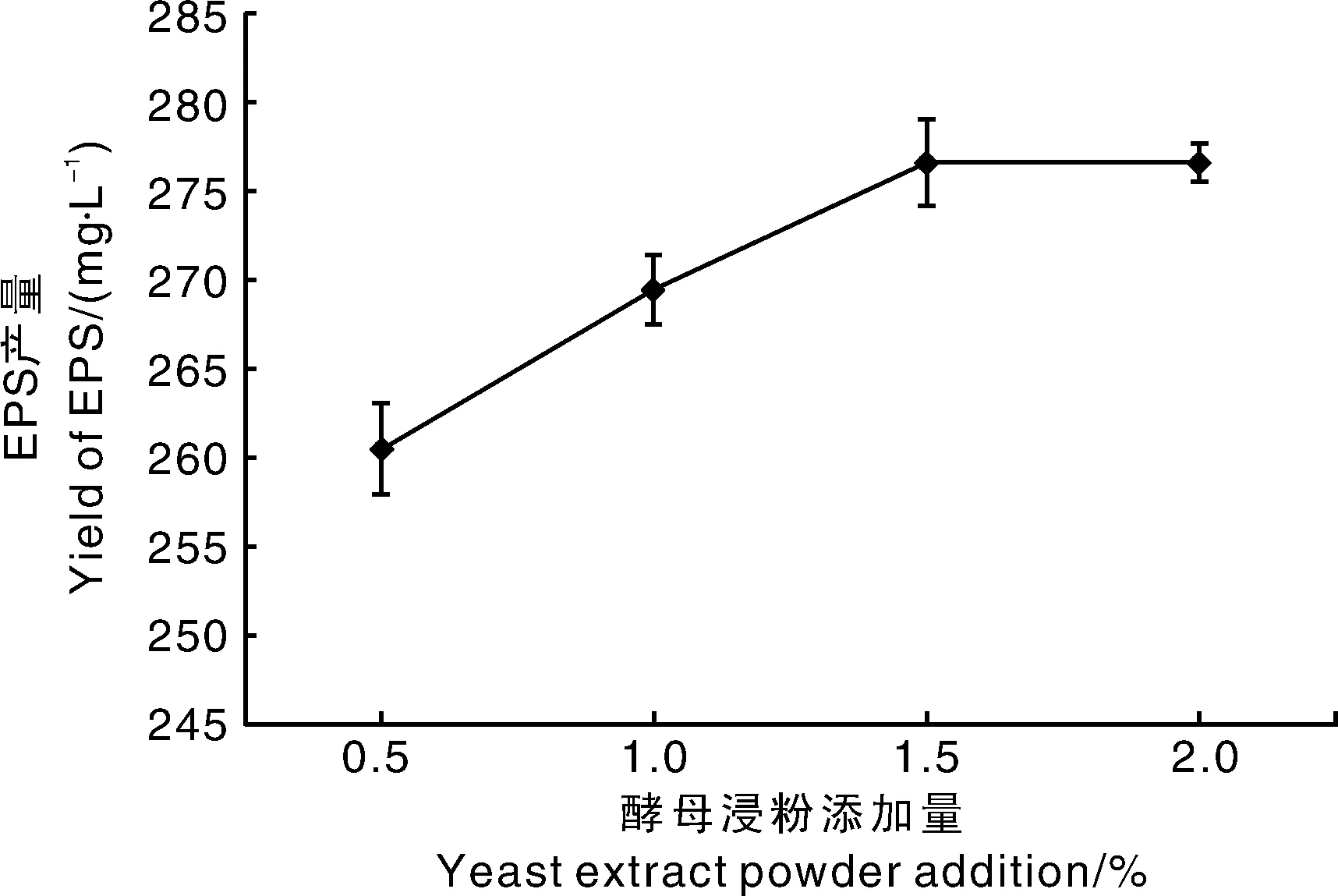
图4 酵母浸粉添加量对EPS产量的影响Fig.4 Effects of yeast extract powder on yield of EPS
正交试验设计及结果见表2,根据极差R值可以看出,蔗糖添加量是影响EPS产量最重要的因素,大豆蛋白胨添加量次之,酵母浸粉添加量影响最小。结合正交试验水平趋势图5,考虑实际结果和经济性,本试验确定最适组合为A2B2C3,即:蔗糖添加量3%,大豆蛋白胨添加量1%,酵母浸粉添加量2%。
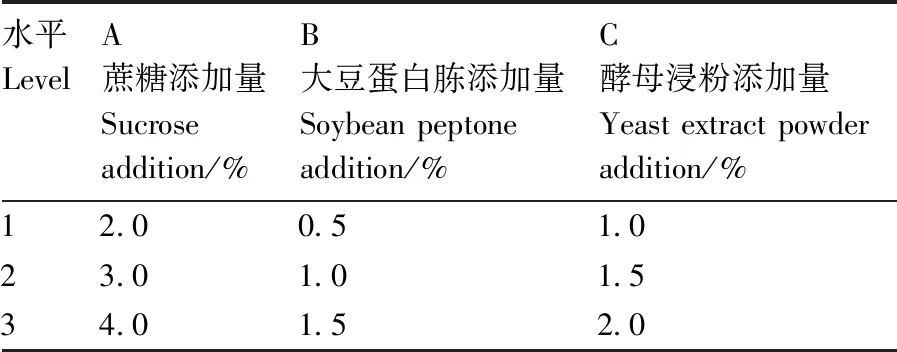
表1 正交试验因素水平Table 1 Factor level of orthogonal experiment
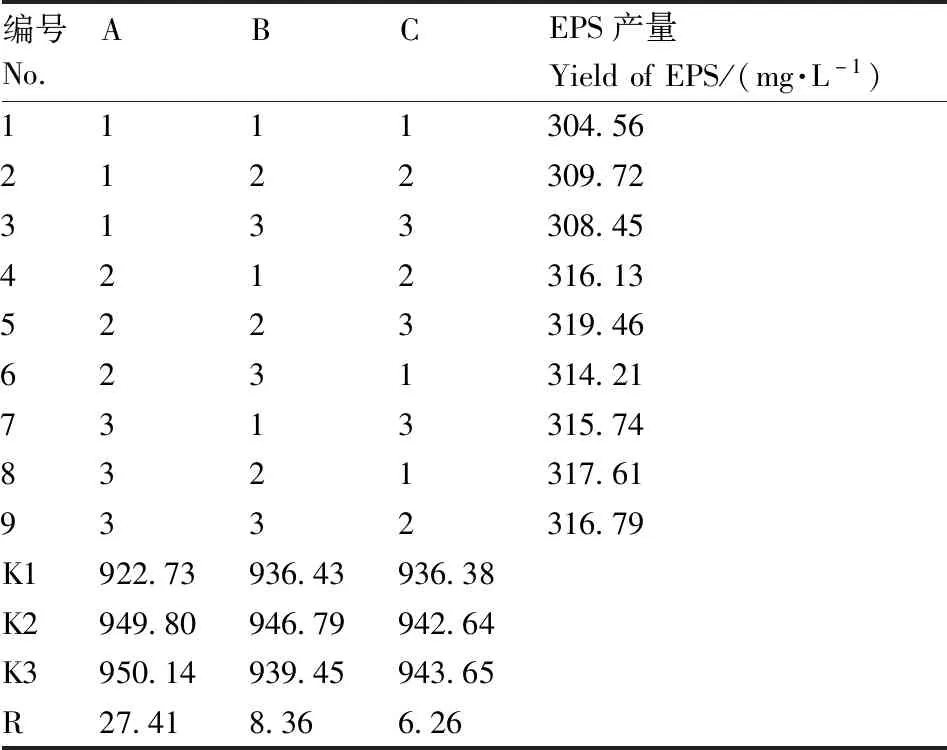
表2 正交试验设计与结果Table 2 Orthogonal experimental design and results
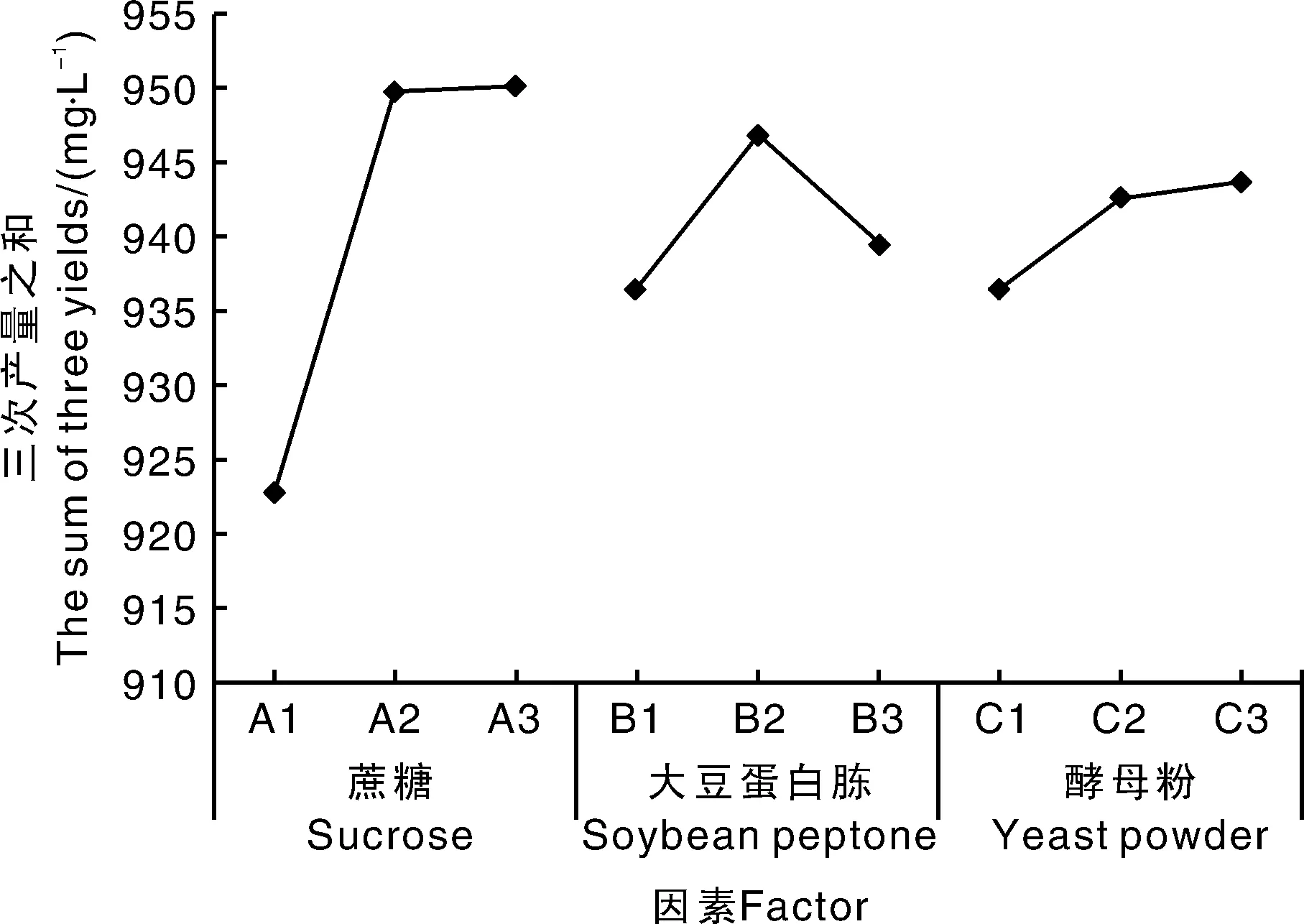
图5 正交试验水平趋势图Fig.5 Tendency of each level in orthogonal experiment
2.3 培养条件对EPS产量的影响
2.3.1 培养基初始pH值
培养基初始pH会影响微生物内酶的活性,从而影响微生物的生长代谢和产物形成,通常产EPS的最适pH值为6.0左右[19-20]。初始pH值对YY112 EPS产量的影响如图6所示,当pH值为6时,EPS产量达到最大,为320.93 mg·L-1,本试验选择5~7为发酵初始pH值范围。
2.3.2 接种量
适宜的接种量是微生物高产EPS的重要前提,不同接种量对YY112 EPS产量的影响如图7所示,EPS产量随接种量增加而增加,当接种量为4%时,EPS产量最高,为363.07 mg·L-1。当接种量为5%时,EPS产量出现略微下降趋势,因此选择3%~5%作为最适接种量范围。
2.3.3 培养温度
培养温度对YY112 EPS产量的影响如图8所示,当培养温度达到30 ℃时,EPS产量最高,为345.51 mg·L-1。当培养温度较低或较高时,EPS产量均出现下降趋势,本试验选取25~35 ℃作为最适培养温度范围。
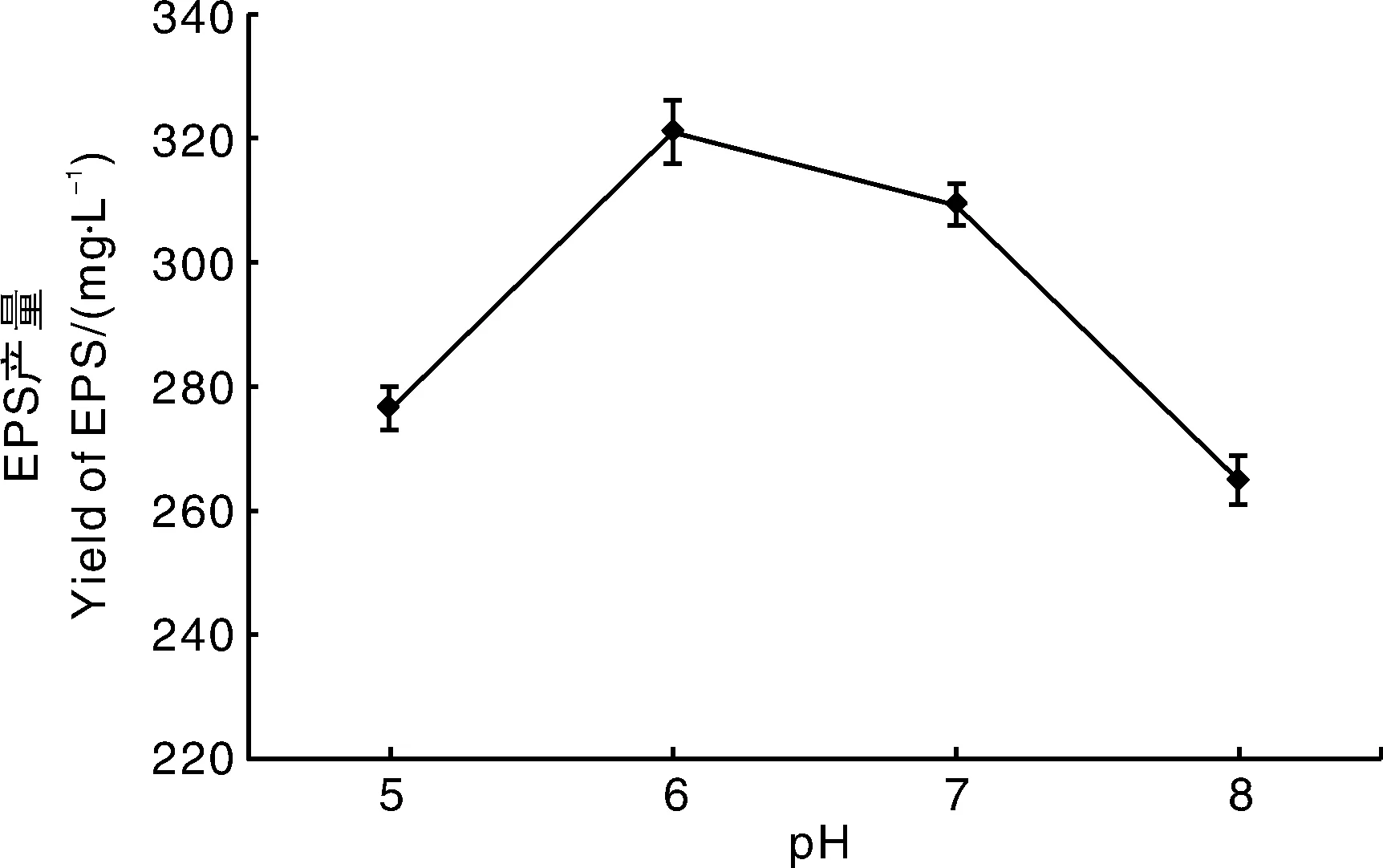
图6 pH对EPS产量的影响Fig.6 Effect of pH on yield of EPS
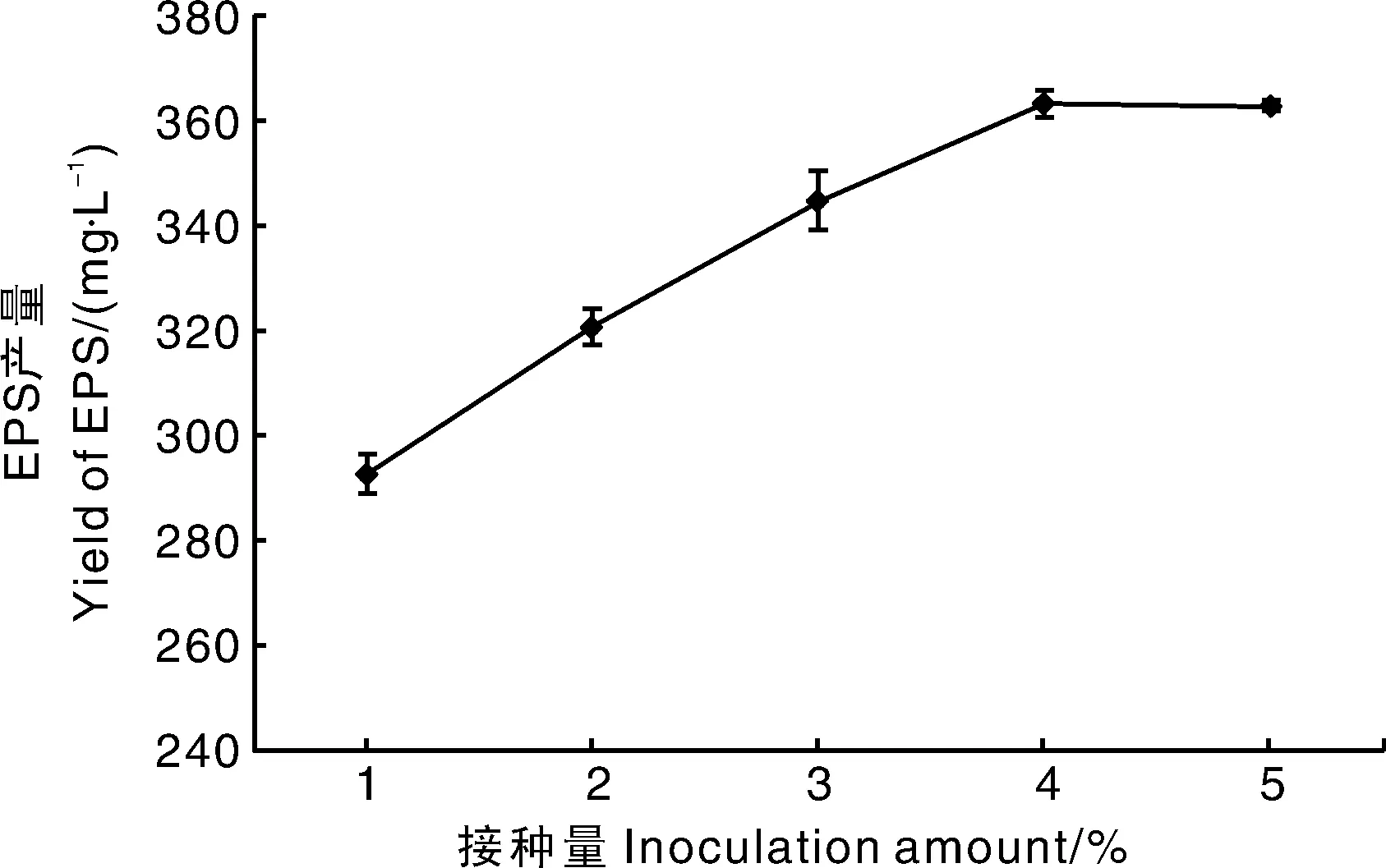
图7 接种量对EPS产量的影响Fig.7 Effect of inoculation amount on yield of EPS
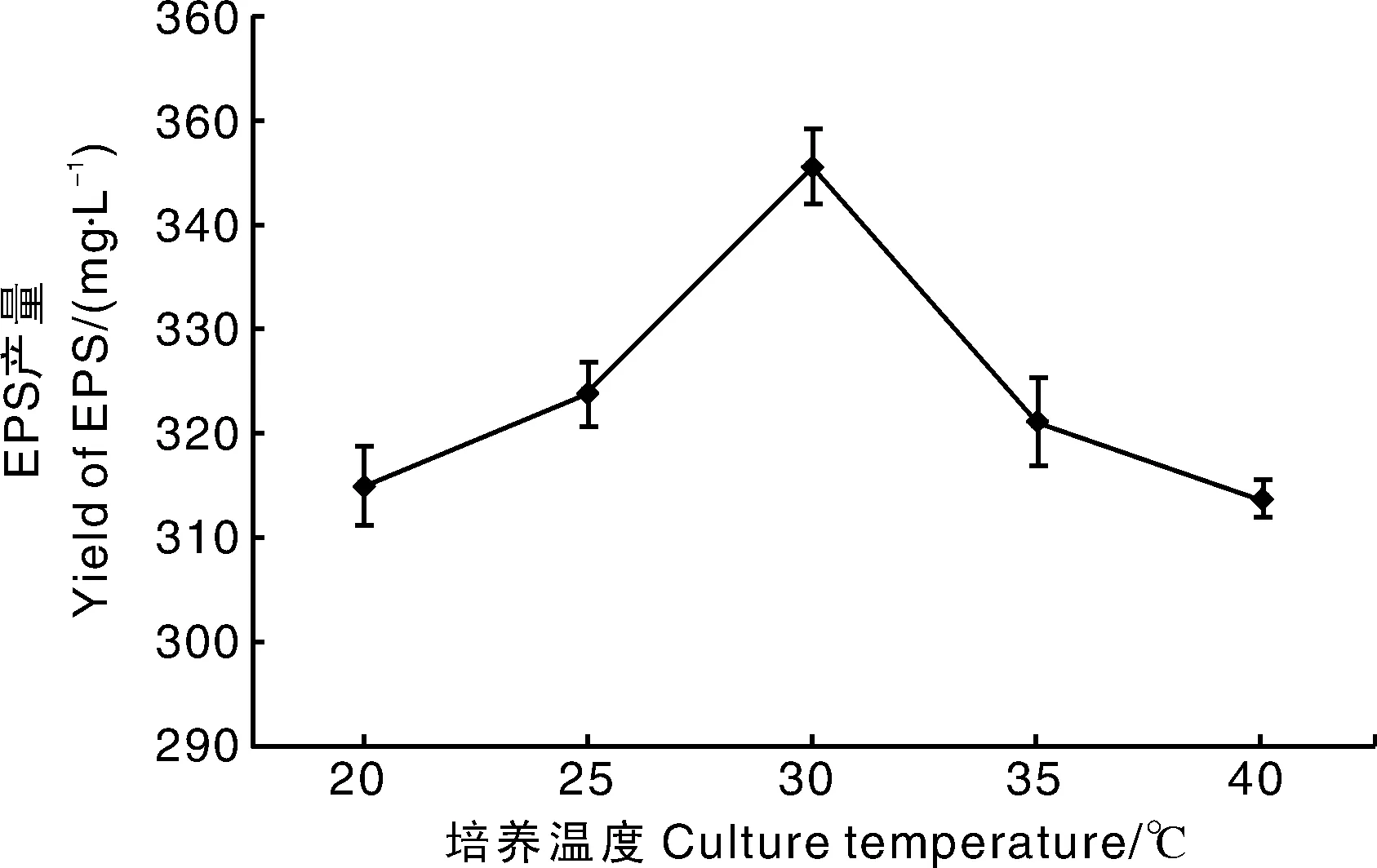
图8 培养温度对EPS产量的影响Fig.8 Effect of culture temperature on yield of EPS
2.3.4 培养时间
EPS属于微生物次生代谢产物,一般在菌株对数生长末期和稳定期产生,因此培养时间也是影响EPS产量的重要因素之一[21]。培养时间对YY112 EPS产量的影响如图9所示,当培养24 h时,EPS产量达到最大,为321.57 mg·L-1。当培养时间延长时,EPS逐渐下降,可能是由于培养基中养分减少或多糖发生了水解作用而导致的[22]。本试验选择18~30 h作为最适培养时间范围。
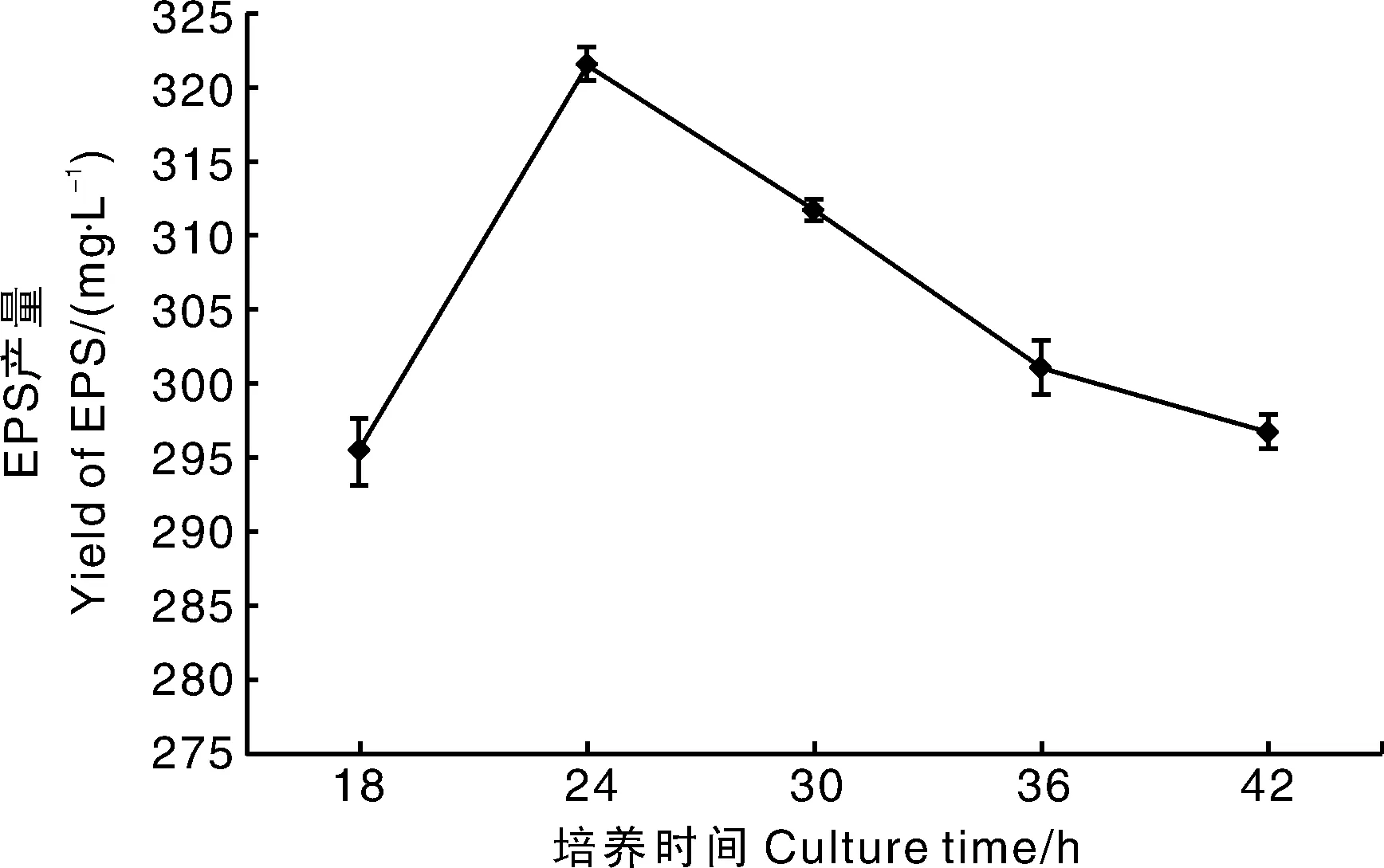
图9 培养时间对EPS产量的影响Fig.9 Effect of culture time on yield of EPS
2.3.5 响应面法优化培养条件
从单因素试验结果可知,初始pH值、接种量、培养温度、培养时间对YY112 EPS产量均有明显影响。为进一步确定最优条件,探究单因素之间的交互作用,通过Box-Behnken响应面法设计试验[23],以发酵初始pH值、接种量、培养温度、培养时间为因素,EPS产量为指标,设置5个中心试验点,确定最佳因素水平,设计29个试验点的试验方案,试验设计及水平见表3。
Box-Behnken响应面法试验结果如表4所示。以EPS产量为响应值,经回归拟合得到各试验因素对响应值的影响可用回归方程表示:Y=380.47+13.38A+4.08B-2.47C+2.21D-4.59AB-2.98AC+0.45AD-0.31BC-1.34BD-0.41CD-21.32A2-11.71B2-21.68C2-28.58D2。
根据表5中各因素F值可以看出,各因素及其交互项对EPS产量的影响均显著,影响顺序依次为:接种量>培养时间>培养温度>pH值。综合数据结果表明,该模型能够较好地反映接种量、培养时间、培养温度、pH值之间的关系,因此所得的回归方程能较好地预测YY112 EPS产量在不同条件下的变化规律。
通过Design-Expert. V 8.0.6 软件分析得到影响YY112 EPS产量因素的响应面图,结果如图10所示。从图中能够直观地看出各因素及其相互作用对试验结果的影响,响应面图所示最大响应值和各因素参数值与回归方程计算值一致。

表3 响应面分析因素水平表Table 3 The range of independent variables and their corresponding levels
由图10可知,回归方程存在极大值点,通过软件分析得出最优培养条件为:接种量4.31%、培养时间24.66 h、培养温度29.61 ℃、发酵初始pH值6.04,在此培养条件下YY112 EPS产量理论值为382.886 mg·L-1。考虑到实际可操作性,将参数优化为:接种量4%、培养时间24.5 h、培养温度29.5℃、发酵初始pH值6.0。
为检验响应面分析法的可靠性,采用上述优化参数对YY112菌株进行3次平行发酵,实际测得EPS产量为(380.97±0.45) mg·L-1,与理论预测值的相对误差为0.50%,说明通过响应面分析法优化得到的培养条件工艺参数准确可靠,具有实用价值。
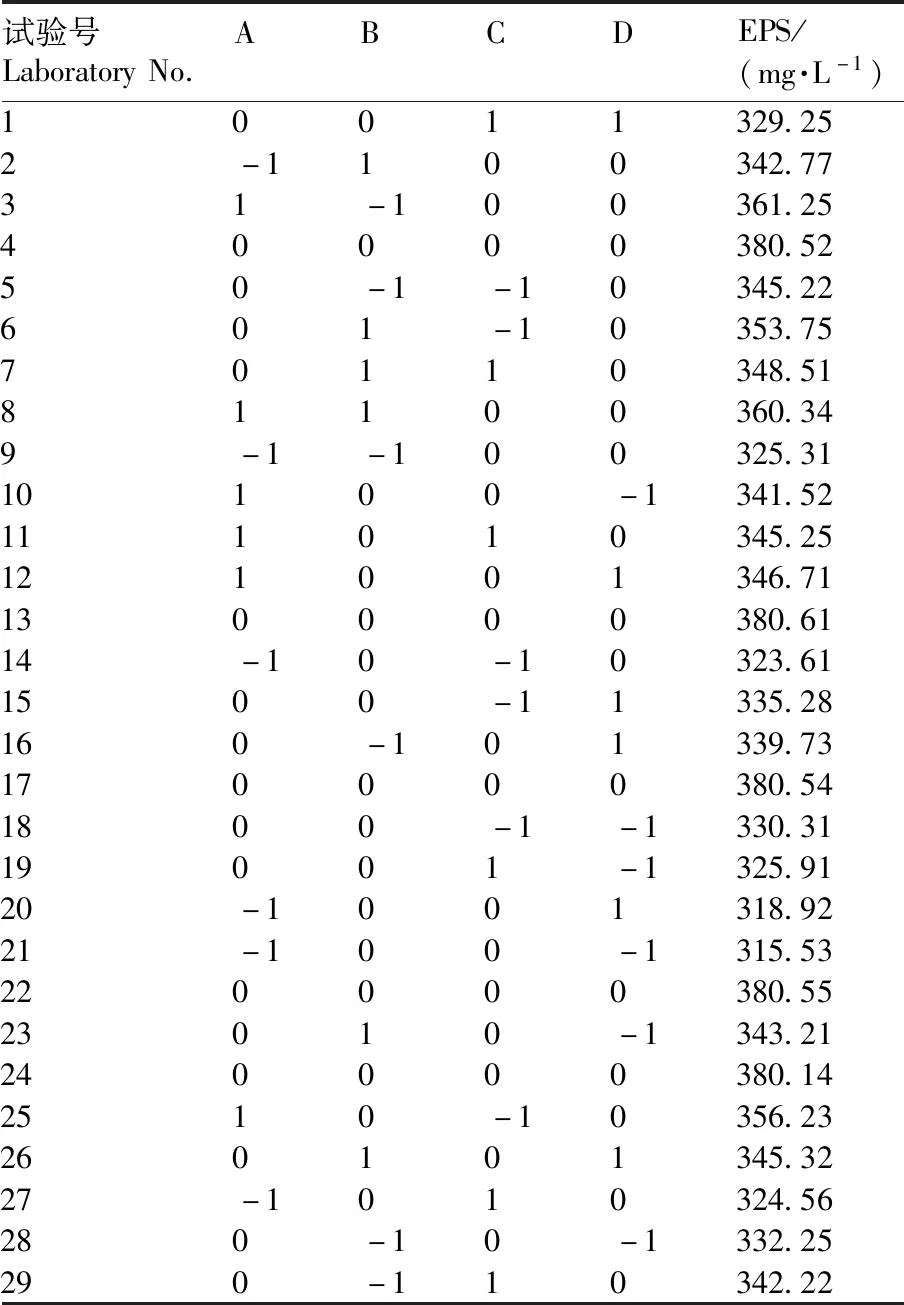
表4 Box-Behnken试验设计与响应值Table 4 The experimental design and results of Box-Behnken
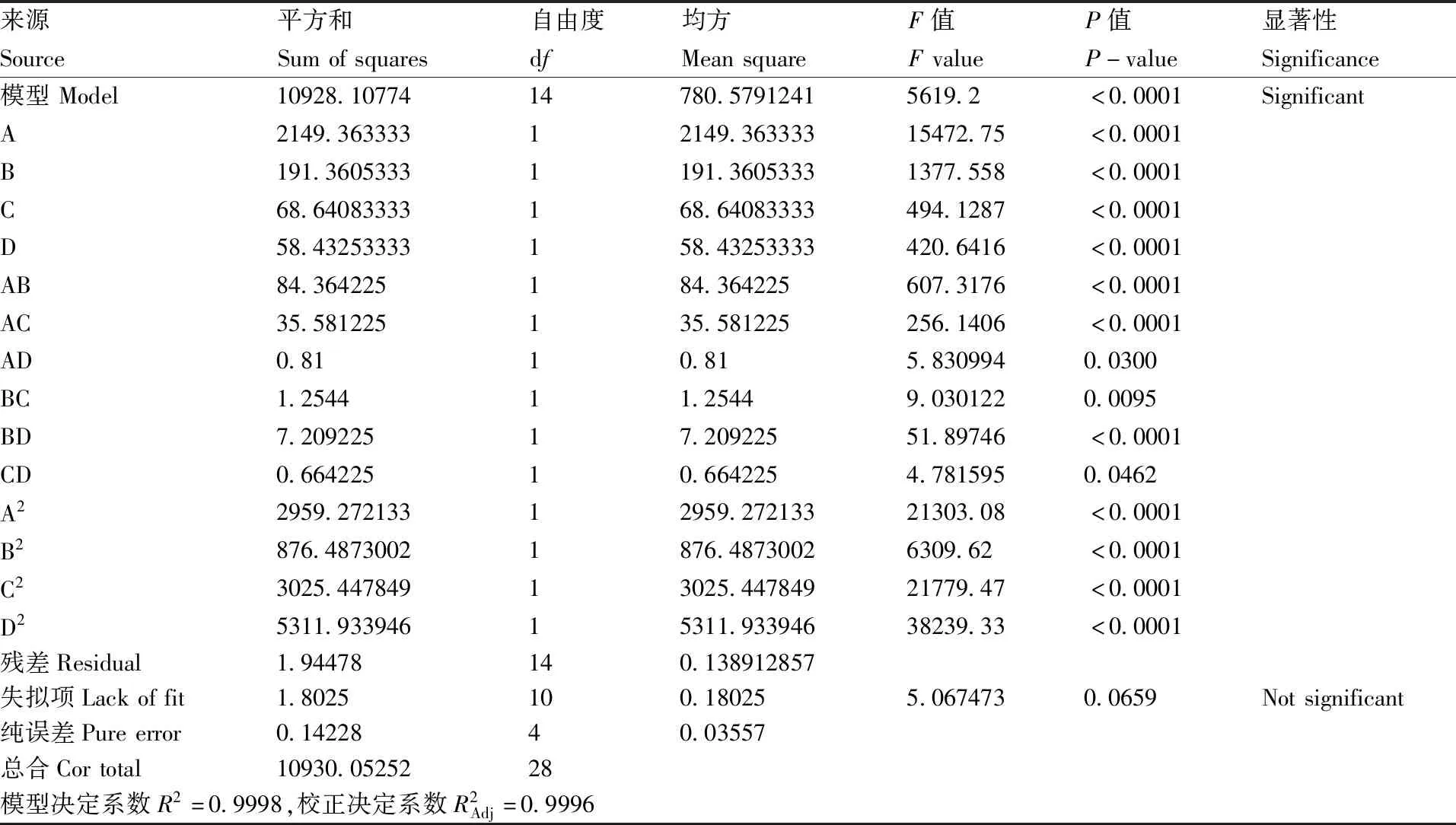
表5 响应面模型方差分析Table 5 Analysis of variance for response surface model
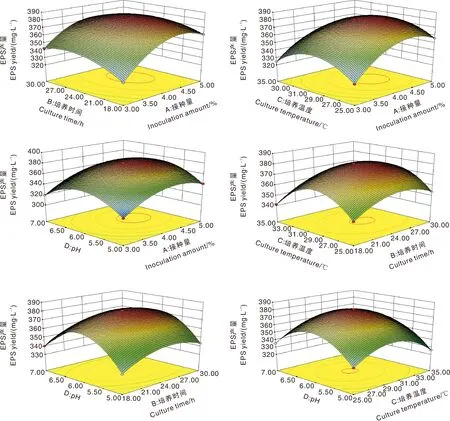
图10 pH值、接种量、培养温度、培养时间交互作用对EPS产量影响的响应面图Fig.10 Response surface diagram of effects of pH value, inoculation amount, culture temperature and culture time on EPS yield
3 结论
乳酸菌胞外多糖的产量受到多方面因素的影响。不同菌株合成胞外多糖的能力不同,同一菌株发酵条件不同,其胞外多糖的产量差异也很明显。培养基营养成分(碳源、氮源、生长因子)和培养条件(接种量、培养温度、培养时间、培养基初始pH)等都可能对乳酸菌胞外多糖的产量产生影响。正交设计方法是一种用线性数学模型进行设计的设计方法,可以找出多个因素水平的最佳组合。响应面法采用非线性模型,能求得高精度的回归方程,进行合理预测来找出最优的工艺条件。由于影响微生物发酵产多糖的因素较多,如仅设计单因素试验,在因子较多时需要很多的试验次数,工作量巨大,实施有一定难度。因此,我们往往通过正交试验分析法或响应面法进行分析。
本试验在筛选出基础培养基的基础上,采用单因素法分别确定不同营养成分和培养条件涉及因素的适宜范围,再分别采用正交试验分析法进一步确定不同营养成分最适添加量,采用Box-Behnken响应面分析法确定重要培养参数适宜水平,通过两种优化方法结合得出适合YY112发酵产生EPS的营养条件和培养生长工艺参数。优化后YY112菌株的EPS的产量为380.97 mg·L-1,较优化前的260 mg·L-1增加了46.52%,EPS产量得到了较大提升,对推动戊糖乳杆菌YY112的实际生产和应用具有积极意义。

