基于体外模拟肠道微生态体系比较不同果蔬全粉的益生元功效
石梦玄 张 璐,2 田美玲 陈 芳*
(1 中国农业大学食品科学与营养工程学院 国家果蔬加工工程技术研究中心 农业部果蔬加工重点实验室教育部果蔬加工工程技术研究中心 北京100083
2 北京食品营养与人类健康高精尖创新中心 中国农业大学 北京100193)
肠道是体内消化代谢的重要器官之一,肠腔内环境极其复杂,栖息了1013~1014个肠道微生物[1]。大量研究表明,这些微生物能够维持肠道内环境平衡。肠道菌群中的益生菌,能够在肠道中与致病菌竞争抑制其生长[2],增强肠道屏障功能[3]。菌群代谢碳水化合物产生的短链脂肪酸(Shortchain fatty acids,SCFAs)[4],能够调节上皮细胞和免疫细胞的生长,调节氧化应激,影响黏液层的组成[5]。肠道中有益菌数量和SCFAs产量的增加对维持肠道功能,保护肠道健康具有重要作用。
果蔬包含的功能成分如膳食纤维和多酚,能够与肠道菌群相互作用,改善肠道微生态环境[6-7]。膳食纤维不易被人体直接吸收,但可被肠道菌群代谢产生SCFAs,反之,SCFAs为肠道上皮细胞提供能量来源,调节肠道环境pH值[8]。多酚能够抑制肠道致病菌如类杆菌、肠球菌和葡萄球菌等的生长,促进双歧杆菌、乳酸杆菌等有益菌数量的增加,维持菌群结构平衡[9]。不同果蔬成分组成的差别会对肠道菌群及其代谢产物产生不同的影响,因此选择方便快捷、灵敏准确的研究方法初步评价不同果蔬的益生元功效有重要意义。
目前,人体肠道模拟系统(Simulator of the Human Intestinal Microbial Ecosystem,SHIME)[10]、三联体外发酵模拟系统[11]等体外模拟消化体系具有精确度高、重现性好、操作便捷的优点,逐渐在食品消化代谢研究中得到广泛运用。本研究通过建立体外模拟肠道微生态体系,研究了丝瓜、香菇、桑葚和枸杞4种果蔬冻干全粉对5种肠道有益菌数量和SCFAs产量的影响,为初步评价果蔬的益生元功效提供试验基础。
1 材料与方法
1.1 材料与试剂
“宁杞五号”枸杞、“808”香菇和“黑珍珠”桑葚全果冻干粉由中国农业科学院农产品加工研究所提供。市售“棒丝瓜”鲜果切片、冻干、研磨后得丝瓜冻干粉。
葡萄糖标准品(98%)、果糖标准品(99%)、蔗糖标准品(99%)、乙酸标准品(99.8%)、丙酸标准品(99.8%)、丁酸标准品(99.5%)、异戊酸标准品(98.5%),热稳定α-淀粉酶(TDF-100A)、淀粉葡萄糖苷酶(TDF-100A)、蛋白酶(TDF-100A)、猪胃粘膜胃蛋白酶(250 units/mg)、猪胰腺胰蛋白酶(~1 500U/mg)、猪胰腺胰酶(8×USP)、猪胃黏蛋白(Type II),美国Sigma公司;色谱级甲醇、乙腈,美国Honeywell公司;蛋白胨、酵母提取物、三号胆盐,北京奥博星生物技术有限责任公司;L-Cysteine(97%),美国Sigma-Aldrich公司;粪便基因组DNA提取试剂盒DP328,北京天根生化科技有限公司;SYBR Premix Ex Taq,日本TaKaRa公司;Folin-Phenol试剂,北京索莱宝科技有限公司;分析纯无水乙醇、葡萄糖、NaOH、K2HPO4、KH2PO4,国药集团化学试剂有限公司(沪试);肠道菌群特异性引物,北京擎科新业生物技术有限公司合成。
1.2 设备与仪器
IS-RSD3台式恒温振荡器,美国精骐有限公司;LAI-3DT型厌氧培养箱,上海龙跃仪器设备有限公司;SpectraMax iD5多功能微孔读板机,美国Molecular Devices公司;LightCycler480Ⅱ实时荧光定量PCR仪,德国Roche公司;Waters e2695高效液相色谱仪,美国Waters公司;Waters RIDetector检测器,美国Waters公司;Luna NH2色谱柱(250mm×4.6mm,5cm),美国Phenomenex公司;Agilent Technologies 7890B-5977A气相-质谱联用仪,美国Agilent Technologies公司;HP-FFAP色谱柱(19091F-413),美国Agilent Technologies公司
1.3 方法
1.3.1 体外模拟肠道微生态体系的建立 模拟胃液和小肠液分别参照Tedeschi等[12]的方法配制,并进行部分调整。模拟胃液:3.10 g NaCl,1.10 g KCl,0.15 g CaCl2,0.60 g NaHCO3,用去离子水定容1 000mL。在150mL胃电解液中添加35.40 mg胃蛋白酶,加入1.5 mL CH3COONa缓冲液(1.0 mol/L,pH 5.0)。室温下磁力搅拌10min,调至pH 2.0(0.5 mol/L HCl)。模拟小肠液:5.40 g NaCl,0.65 g KCl,0.25 g CaCl2,去离子水定容1 000 mL。将25mL小肠电解液、50mL 4%胆汁盐溶液和25mL 7%胰酶上清液混合,添加13mg胰蛋白酶,调至pH7.0(0.5mol/L NaOH)。
发酵培养基参照Chen等[13]的方法配制,并进行部分调整。0.10 g NaCl,0.04 g K2HPO4,0.04 g KH2PO4,0.01 g MgSO4,0.01 g CaCl2,2.00 g NaHCO3,2.50 g蛋白胨,4.00 g酵母提取物,0.40 g葡萄糖,2.00 g黏蛋白,0.50 g胆盐,0.46 g L-Cysteine,2mL Tween-80,用去离子水定容1 000mL,调至pH 7.0(0.5mol/L NaOH),121℃高压湿热灭菌15min,冷却后备用。
粪便菌群悬液参照Qiao Ding等[14]的方法配制。采集新鲜小鼠粪便,加入pH 7.0无菌PBS缓冲液,以1∶9(m/V)混合稀释,均质10min,1 000 r/min离心10min,去除杂质,取上层浑浊液为粪便菌群悬液。
体外发酵方法参照Qiao Ding等[14]方法,并进行部分调整。于10mL离心管中以5%的体积比加入模拟胃液,加入质量比1%果蔬冻干粉充分混匀,在37℃恒温振荡1.5 h(120 r/min)后,立即加入模拟小肠液(体积比为5%)充分混匀,恒温振荡1.5 h(120 r/min,37℃),得到果蔬粉消化液。按体积比6∶3∶1混合培养基、模拟肠道菌群液和果蔬粉消化液,于37℃厌氧环境培养24 h,分别于0,3,6,12,24 h取样5mL,12 000 r/min离心10min,沉淀和上清液分别保存-80℃待测。以不添加果蔬冻干粉为对照组。
1.3.2 果蔬冻干全粉主要碳水化合物及总酚含量测定 参考HPLC-RID法[15]测定果蔬冻干粉中葡萄糖、果糖和蔗糖含量。参考AOAC 991.43法[16]测定总膳食纤维含量。采用Folin-Ciocalteu法[17]测定总酚含量,依据没食子酸标准曲线计算总酚含量,表示为mg/100 g。
1.3.3 有益菌数量的测定 采用实时荧光定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,qPCR)绝对定量法[18]测定样品中双歧杆菌属(Bifidobacterium)、乳酸杆菌属(Lactobacillus)、普氏菌属(Prevotella)、拟 杆菌属(Bacteroides)和阿克曼氏菌(Akkermansia mucinipila)5种有益菌数量。选择总菌及上述5种有益菌的特异性扩增引物,采用基因克隆方法构建相应有益菌的质粒标准品,以10倍梯度稀释的质粒标准品为模板,利用特异性引物(表1)进行qPCR测定,绘制目的细菌的标准曲线。
以总DNA为模板,利用特异性引物(表1)进行qPCR测定。扩增体系(10μL):2×SYBR Premix Ex TaqⅡ5μL,正、反向引物各0.25 nmol,模板DNA 1μL,ddH2O补足10μL。反应程序:预变性95℃,30 s;变性95℃,5 s;退火60℃,15 s,40个循环;延伸72℃,30 s;复性95℃,10 s。将Cq值代入对应标准曲线中计算拷贝数,表示为copies/mL。

表1 肠道菌群菌属引物序列Table1 Sequence of primers for intestinal microbiota
1.3.4 SCFAs含量测定 参照Hu等[21]的方法测定上清液样品中SCFAs的含量。取800μL上清液加入200μL 50%浓硫酸漩涡混匀后,立即加入1 mL乙醚漩涡1min,冰上静置10min,12 000 r/min离心10min,加入无水CaCl2脱水后,吸取上清过膜待测(0.22μm,尼龙膜)。采用HP-FFAP色谱柱,用气-质谱仪测定乙酸、丙酸、丁酸和异戊酸,外标法计算各短链脂肪酸的质量浓度。检测器为氢火焰检测器(Flame ionization detector,FID),载气为N2,流速19.0mL/min,分流比1∶10,空气流速300mL/min,H2流速为30mL/min。检测器温度250℃,进样口温度240℃,初始温度80℃(0.5 min),升温至150℃(4℃/min),然后升温至230℃(20℃/min)保持10min。进样量1μL,重复3次。
1.3.5 数据处理 采用SPSS 20.0统计软件处理数据,单因素方差分析(ANOVA)用于比较不同组之间的差异,结果以±SD表示,a、b、c、d表示不同组之间的差异显著性(P<0.05)。
2 结果
2.1 4种果蔬冻干粉的主要碳水化合物及多酚含量
对4种果蔬冻干粉中总膳食纤维、总可溶性糖、葡萄糖、果糖、蔗糖和总酚含量进行测定(见表2)。总膳食纤维含量最高的是香菇为24.37 g/100 g,之后为丝瓜17.89 g/100 g。可溶性糖含量最高是桑葚65.75 g/100 g,其次为枸杞和丝瓜,分别为46.43 g/100 g和32.85 g/100 g。在可溶性糖组成上,香菇中葡萄糖含量是23.20 g/100 g,果糖和蔗糖未检出;桑葚的果糖含量较高为32.65 g/100 g,葡萄糖、蔗糖相对较少,分别为18.58,14.52 g/100 g;枸杞中主要为葡萄糖和果糖,分别为22.24 g/100 g和22.64 g/100 g;丝瓜中葡萄糖、果糖和蔗糖的含量分别为10.52,7.23 g/100 g和8.26 g/100 g。4种果蔬冻干粉均含有多酚,其中桑葚总酚含量最高,为5.58mg/100 g。
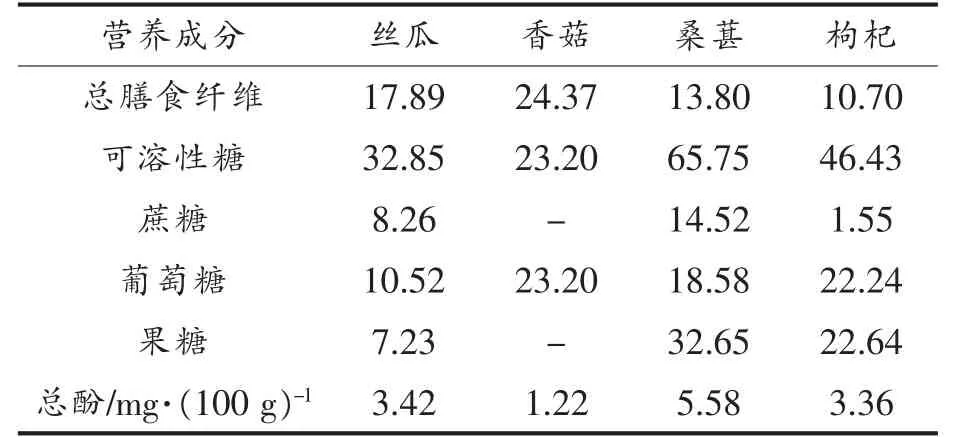
表2 果蔬冻干粉营养成分(g/100g)Table2 The nutritional components of fruit and vegetable freeze-dried powders(g/100g)
2.2 体外模拟肠道微生态体系中4种果蔬冻干粉对菌群数量的影响
对照组体外发酵0~12 h总菌数量明显上升(图1a),12~24 h趋向平稳,表明该体系有利于肠道菌群进行发酵。有研究表明双歧杆菌属和乳酸杆菌属是生物体肠道内重要的益生菌[22-23];普氏菌属和拟杆菌属是健康人体肠道菌群中的主导菌种[24],为人体提供营养并维持肠道的正常生理功能;阿克曼氏菌能够改善肠道屏障功能,被称为潜在益生菌[25]。采用膳食补充等手段促进有益菌数量的增加,对维护人体肠道健康十分重要。本研究发现,4种果蔬冻干粉分别对双歧杆菌属、乳酸菌属、普氏菌属、拟杆菌属和阿克曼氏菌数量的增加产生了不同程度的影响。桑葚、枸杞和丝瓜自发酵6 h起促进双歧杆菌属数量增加(图1b),24 h时显著高于对照和香菇组(P<0.05)。桑葚、枸杞和丝瓜自发酵3 h起显著促进乳酸杆菌属数量增加(图1c),且显著高于对照和香菇组(P<0.05)。丝瓜自体外发酵6 h起显著促进普氏菌属和拟杆菌属数量增加(图1d-1e),12 h和24 h时均显著高于其它各组(P<0.05)。然而,果蔬各组均未能显著促进阿克曼氏菌数量的增加(P<0.05),如图1f所示。
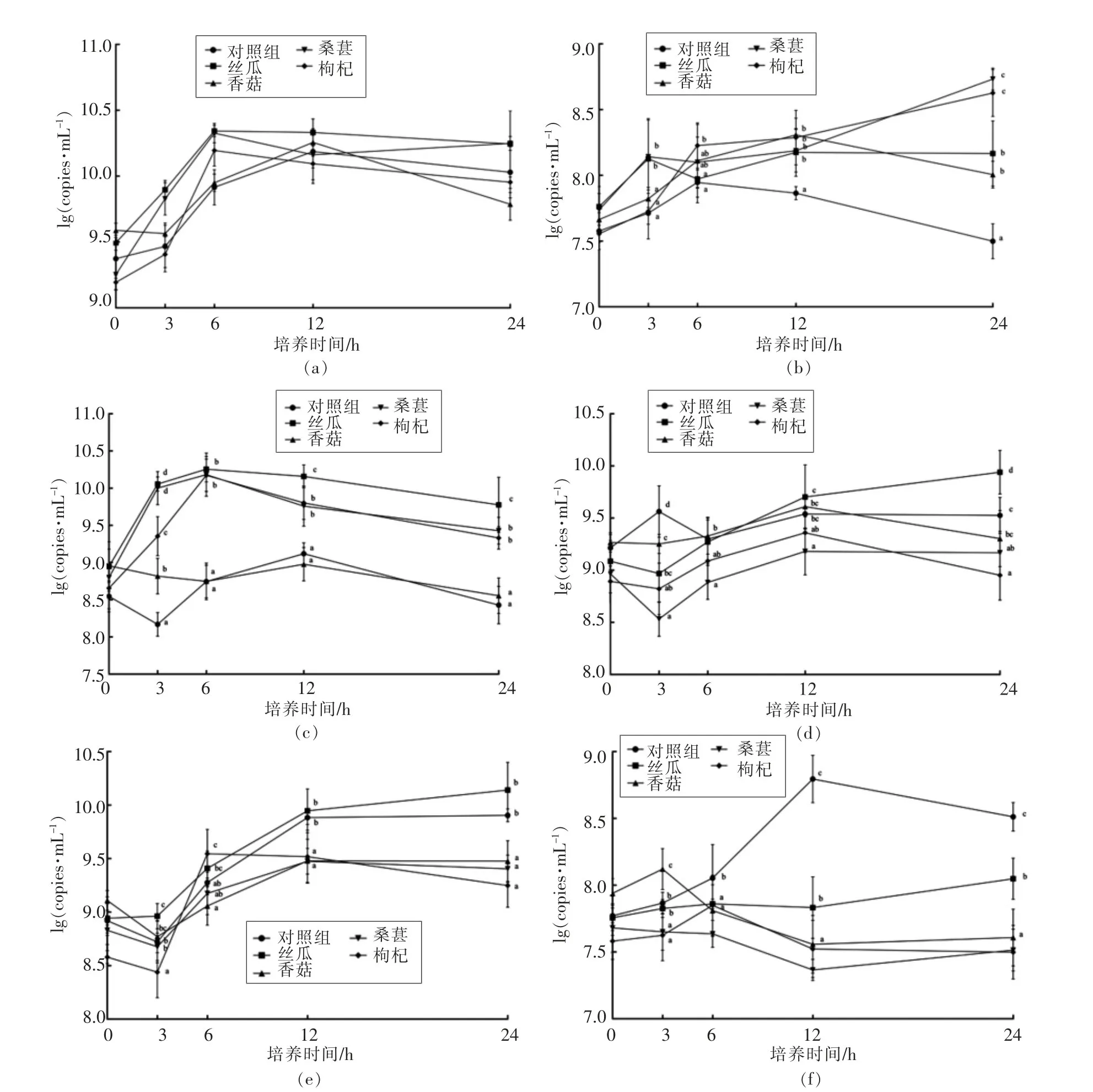
图1 体外发酵各组(a)总菌、(b)双歧杆菌属、(c)乳酸菌属、(d)普氏菌属、(e)拟杆菌属和(f)阿克曼氏菌数量变化Fig.1 The number of(a)all bacteria,(b)Bifidobacterium,(c)Lactobacillus,(d)Prevotella,(e)Bacteroides,and(f)Akkermansia mucinipila in the in vitro fermentation system
2.3 体外模拟肠道微生态体系中4种果蔬冻干粉对短链脂肪酸含量的影响
肠道菌群主要代谢产物为SCFAs,包括乙酸、丙酸和丁酸等,乙酸参与脂肪生成和糖异生过程,丙酸可以影响肝脏和胆固醇代谢[4],丁酸是肠道上皮细胞的重要能量来源[26],异戊酸属于支链脂肪酸,具有显著的抗炎效果[27]。SCFAs含量可以作为评价肠道微生态平衡的重要指标。如图2a所示,4种果蔬冻干粉对乙酸增加均有明显的促进作用,其中桑葚组显著高于对照和其它果蔬组(P<0.05),在24 h达到最高值为465.41μg/mL。发酵24 h时,丝瓜粉组的丙酸含量达到122.35μg/mL,显著高于其它果蔬组(P<0.05),低于对照组(图2b)。丝瓜粉组自发酵6h起促进丁酸含量增加,且显著高于其它果蔬组(P<0.05),12 h达到最大值为130.24μg/mL(图2c)。各果蔬组处理的异戊酸含量均较低,仅丝瓜组有促进作用(图2d)。
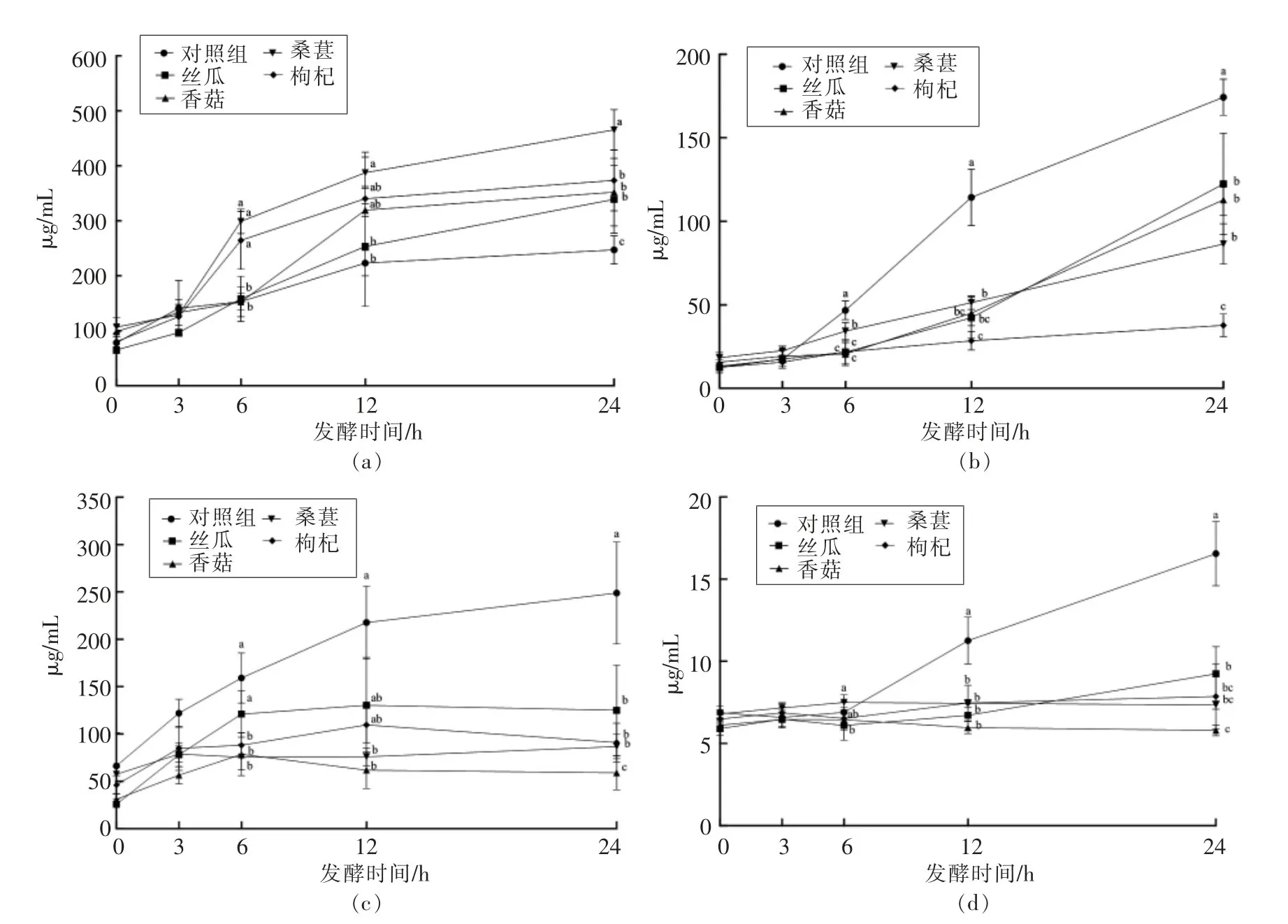
图2 体外发酵各组(a)乙酸、(b)丙酸、(c)丁酸和(d)异戊酸的产量Fig.2 The production of(a)acetic acid,(b)propionic acid,(c)butyric acid and(d)iso-valeric acid in the in vitro fermentation system
3 结论与讨论
体外模拟肠道微生态体系具有操作简便、重现性好和成本经济等特点,能够方便快捷地研究肠道菌群及其代谢产物的变化。常见的体外发酵体系有人肠道模拟系统(SHIME)[10]、三联体外发酵模拟系统[11]和迷你体外模拟肠道系统(Copenhagen MiniGut)[28]等。本研究基于体外模拟肠道微生态体系,分别评价了丝瓜、香菇、桑葚和枸杞冻干粉对肠道菌群及其代谢产物SCFAs的影响,结果表明,4种果蔬冻干粉均能够不同程度增加有益菌数量和SCFAs含量,为今后筛选健康膳食干预、科学饮食搭配提供试验参考。
果蔬中富含膳食纤维,膳食纤维尤其是不溶性膳食纤维能够直接经过胃、小肠部位进入肠道[29]。许多研究证明普氏菌属和拟杆菌属均可利用复杂碳水化合物产生乙酸和丙酸[24,30],双歧杆菌和乳酸杆菌是益生菌,可以维持免疫平衡和增强肠道屏障功能[22-23],利用单糖或低聚糖代谢产生乙酸[2]。丁酸CoA可在乙酸存在的条件下通过butyryl CoA:acetate CoA转移酶合成丁酸[31]。果蔬中的单糖可被双歧杆菌和乳酸杆菌利用[32],多酚可以选择性地促进双歧杆菌和乳酸杆菌数量增加[33]。本研究发现丝瓜能够显著促进普氏菌属、拟杆菌属、双歧杆菌属、乳酸杆菌属数量及其代谢物乙酸、丙酸、丁酸含量(图1-2)。丝瓜的总膳食纤维和总酚含量均较高(表2),推测丝瓜的膳食纤维可能促进普氏菌属和拟杆菌属直接代谢产生乙酸和丙酸,多酚及可溶性糖促进双歧杆菌和乳酸杆菌数量增加,大量乙酸存在的环境促使丁酸CoA转化为丁酸,这些使丝瓜呈现出明显的益生元功效。本研究还发现桑葚粉的果糖和总酚含量最高,且对双歧杆菌属数量和乙酸含量的增加显著高于其它果蔬组,乳酸杆菌数量增加显著高于除丝瓜组以外的其它果蔬组。同样的,枸杞粉的单糖和总酚含量相比桑葚粉含量较低,具有促进双歧杆菌属、乳酸杆菌属数量和乙酸含量的增加效果,然而比桑葚组较弱,说明果蔬对有益菌数量和SCFAs产量的影响与营养成分含量有极大关系。阿克曼氏菌是黏液降解菌,特异性利用肠道中的黏蛋白,能够改善肠道屏障功能。据报道是与降脂、降血糖等功能密切相关的有益菌种[25,34]。通过基因组测序发现该菌具有果糖和甘露糖代谢途径[35],然而目前尚缺研究证实。本研究显示4种果蔬冻干粉均未能对阿克曼氏菌数量增加产生显著性影响,这说明果蔬调节阿克曼氏菌的特殊性和复杂性。特定营养组分对阿克曼氏菌的调节机制,以及阿克曼氏菌与其它菌群的相互作用仍需进一步挖掘。
通过上述分析得出,本研究建立的体外模拟肠道微生态体系可以用来评价果蔬冻干粉的益生元功效,且研究发现丝瓜、桑葚和枸杞能够促进肠道中4种有益菌生长和SCFAs产生,其中丝瓜和桑葚展示出显著的益生元功效。针对这些果蔬中各个营养组分的益生元效果以及如何对人体肠道菌群起到益生作用还有待进一步研究。

