4周电针干预对大鼠白色脂肪“棕色化”的影响及其机制*
高 扬, 于 亮, 付 悦, 王 璐, 郭春杰
((北京体育大学运动人体科学学院, 北京100084)
近年来,肥胖群体罹患心脑血管、高血压和糖尿病等疾病的风险逐年增加,已成为重要的社会问题。有氧运动作为“减脂控重”的常规方法,虽然可以降低体重和体脂含量,改善血脂水平,降低患病风险,但对于久坐不动、心肺功能较差、体重负荷较大或下肢损伤等特殊人群并不适用。因此,上述人群迫切需要一种安全、有效的调控脂代谢的方法以满足其减脂需求。而针刺作为一种传统的干预手段,既能诱导瘦素(leptin)等激素的产生调控体重[1],又能降低白色脂肪细胞的炎性反应,增加棕色脂肪的含量,起到减脂的作用[1]。但针刺是否通过白色脂肪“棕色化”达到减脂效果,以及相应机制尚不明确。
Irisin是一种由含Ⅲ型纤连蛋白域蛋白5重组蛋白(fibronectin type Ⅲ domain containing 5, FNDC5)蛋白酶水解产生的新型肌动蛋白,可“crosstalk”多个组织器官发挥生物学效应。课题组前期研究发现,Irisin受有氧运动等能量状态改变条件的影响,当AMP/ATP的比值升高时,腺苷酸活化蛋白激酶(adenosine 5'-monophosphate activated protein kinase, AMPK)被激活,可以磷酸化激活下游靶分子,促进骨骼肌中过氧化物酶体增殖激活受体γ辅激活因子1α(peroxisome proliferator activated receptor γ coactivator-1α, PGC-1α)和FNDC5/Irisin的表达增加,Irisin释放进入血液循环,上调脂肪组织中解偶联蛋白(uncoupling protein 1, UCP1)的表达,实现白色脂肪细胞向米色样脂肪细胞或者棕色样脂肪细胞转变[2]。有文献报道,针刺不仅能够激活AMPK信号转导途径改善脑能量代谢状态[3],还能增加骨骼肌AMPK-mRNA表达和AMPK蛋白活性[4],促进脂肪分解,改善肥胖大鼠脂质代谢[5]。考虑到共同涉及的能量状态改变问题,针刺促进Irisin水平表达的作用及潜在机制可能与有氧运动近似。本研究通过建立电针干预模型,以有氧运动作为参照,观察4周干预过程中大鼠体重、体脂以及脂肪组织形态的变化,检测血清Irisin水平及腓肠肌和脂肪组织中蛋白表达情况,明确白色脂肪“棕色化”的效果及AMPKα-PGC-1α-FNDC5-Irisin-UCP1信号通路的作用机制。
1 材料与方法
1.1 研究对象
选取24只8周龄SPF级雄性SD健康大鼠,体重在290 g~310 g之间(购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2019-0009),在温度20℃~24℃,湿度30%~50%的环境下进行单笼饲养,每日给予普通膳食饲料,自由摄食和饮水,昼夜循环照射12 h。正式实验前预适应3 d,随后将大鼠随机分为安静对照组(Sed组)、有氧运动组(Exe组)、电针组(ElA组),8只/组。
1.2 模型建立
1.2.1 运动模型 适应性跑台训练3 d后,根据Bedford TG[6]等的研究,采用65%最大摄氧量强度的跑台运动,每天以20 m/min的速度进行训练,1 h/d,6天/周,实验进行4周。
1.2.2 电针模型 将大鼠固定,电针刺激两侧腓骨小头下5 mm(足三里)以及腹正中线,剑突和耻骨联合上缘连线的上2/3与下1/3的交界处,旁开5 mm(天枢)的位置[7],32号1寸毫针刺入3 mm~5 mm,连接电子脉冲针疗仪,频率2/10 Hz,强度1 mA,留针20 min/d,6天/周,实验进行4周(图1)。

Fig. 1 The position of acupuncture
1.3 样品的采集与处理
在最后一次跑台训练后,禁食12 h,采用腹腔注射戊巴比妥钠麻醉大鼠,剂量为50 mg/kg,待大鼠无自主活动时,心尖和腹主动脉取血处死,分离双侧腓肠肌、肾周和附睾周围白色脂肪组织并称湿重,用锡纸包好并标记,放入液氮桶中保存,用于Western blot检测。
分离肩胛周围脂肪组织后,切割黄豆粒大小,进行OCT包埋,用于脂肪组织HE染色;剩下的肩胛脂肪用锡纸包好,放入液氮桶中保存,用于Western blot检测。当日取材结束后,将所有组织移至-80℃的冰箱中贮存。
静置心尖血1 h后,预冷离心机至4℃,将试管对称放入离心机中,12 000 r/min离心5 min,吸出血清移入新的EP管,标记并移至-20℃的冰箱中贮存,用于ELISA检测。
1.4 实验指标检测
1.4.1 体重和脂肪组织的称量 打开天平,将塑料盒放在天平上,数值归零后将大鼠放入塑料盒中,待数值稳定后,记录体重;将锡纸放在天平上,数值归零后将每块脂肪组织放在锡纸上,待数值稳定后,记录脂肪的湿重。注意每次称量前都要将数值归零。
1.4.2 双能X线吸收测量法 适应性饲养一周后,采用双能X线吸收测量法(DEXA),记录大鼠体脂含量。仪器校准后,用戊巴比妥钠麻醉大鼠,剂量为50 mg/kg,待大鼠无自主运动时,放在扫描床上,对其进行全身扫描,保存所获的数据和照片;4周实验结束后,再次采用双能X线吸收测量法(DEXA),记录大鼠体脂含量并保存所有数据和照片。
1.4.3 酶联免疫(ELISA)检测大鼠血清中Irisin水平 先稀释标准品,在酶标包被板上加样(需要设置空白孔)。加完样后用封板膜封板,37℃环境下孵育30 min。揭掉封板膜,弃去液体拍干。重复加入洗涤液洗涤,拍干。加入酶标试剂(空白孔除外),孵育30 min后洗涤。加入显色剂,37℃环境下避光显色15 min。加入终止液,终止反应,用酶标仪进行测定(需在15 min内完成)。
1.4.4 蛋白免疫印迹(Western blot) 提取组织蛋白:切取100 mg腓肠肌或脂肪组织,放入EP管中。加入1 ml RAPI裂解液(含有磷酸酶抑制剂和蛋白酶抑制剂),剪碎匀浆,冰浴静置30 min。离心机离心8 min(12 000 r/min,4℃)后取上清。根据BCA蛋白定量法测定蛋白浓度,加入样品缓冲液和裂解液,将各组蛋白浓度调为一致。沸水煮10 min变性后冷却分装,移至-40℃的冰箱中保存备用。
Western blot检测蛋白表达:制胶(10%的分离胶和浓缩胶)。加样后进行SDS-PAGE电泳90 min(0~60 min 80 V电压,60~90 min 120 V电压)。转膜90 min(恒定电流300 A,在冰水中进行)。封闭(AMPKα、PGC-1α、FNDC5、UCP1用5%脱脂牛奶封闭70 min,p-AMPKα用5%BSA进行封闭2 h)。使用5%BSA配制抗体(AMPKα浓度1∶2 000,p-AMPKα浓度1∶2 000,PGC-1α浓度1∶2 000,FNDC5浓度1∶2 000,GAPDH浓度1∶2 000,β-actin浓度1∶1 000,UCP1浓度1∶4 000),一抗4℃过夜。二抗孵育90 min(目的蛋白浓度和内参浓度均为1∶2 000)。TBST洗膜3×10 min。曝光并对条带灰度值进行Image Lab分析和处理。
1.4.5 石蜡切片和HE染色 固定液固定新鲜脂肪组织24 h后,用手术刀修理平整,放入脱水盒。使用脱水机进行脱水浸蜡。包埋浸好蜡的脂肪组织。将组织放在冷冻台,待蜡凝固切片备用。将石蜡切片脱蜡至水后,苏木素染液染色(10 min),并用自来水冲洗。依次放入85%、95%的酒精中脱水(各5 min),放入伊红染液中染色5 min。最后进行脱水封片。显微镜下观察图像,采集并分析。
1.4.6 脂滴面积的计算方法 打开Case Viewer软件对脂肪组织切片进行观察并保存400倍镜下的图片,打开Image-Pro Plus,点击文件打开保存的脂肪切片,确定标尺后,点击测量(计数/面积)进行计数,对于不完整的脂滴需补齐边缘。每张图片测量3次取平均值。
1.5 主要仪器和试剂
Western blot电泳仪、电转仪,Bio-Rad公司;xMark 酶标仪,Bio-Rad公司;防脱载玻片,北京中杉金桥生物技术有限公司。AMPKα抗体,ab80039,Abcam公司;p-AMPKα抗体,ab133448,Abcam公司;PGC-1α,ab54481,Abcam公司,FNDC5抗体,ab174833,Abcam公司;UCP1抗体,ab10983,Abcam公司;Irisin ELISA试剂盒,AD0002RA,Andy gene; 磷酸酶抑制剂,Roche公司;蛋白酶抑制剂,Roche公司;BCA蛋白测定试剂盒,Thermo公司。
1.6 统计学处理

2 结果
2.1 体重增长
实验期间,每周固定时间称量并记录大鼠体重,4周结束后,与Sed组相比,Exe组、ElA组大鼠体重增长速度明显缓慢(P<0.01),且Exe组从第1周开始体重增长减慢并具有显著性差异(P<0.01),而ElA组从第3周出现显著性差异(P<0.05,表1)。因此电针干预对控制体重增长有一定的作用,并且随着实验干预周期的延长,电针的效果与有氧运动相当。
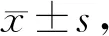
Tab. 1 Weight gain in rats after 4 weeks (g, n=8)
2.2 体脂变化
观察4周干预前后大鼠体脂百分比发现(图2),4周后Sed组体脂含量增加2.63%,而Exe组体脂含量降低5.23%,ElA组体脂含量降低4.95%,且与Sed组相比均有显著性差异(P<0.01,表2)。

Fig. 2 The DEXA result of Rats after 4 weeks

Tab. 2 Body fat percentage of rats (%, n=8)
2.3 白色脂肪湿重和脂滴形态
4周干预后,与Sed组相比,ElA组白色脂肪减少(P<0.05),Exe组白色脂肪减少更多(P<0.01,表3)。观察各组大鼠白色和棕色脂肪组织形态发生变化,与Sed组相比,Exe组、ElA组白色和棕色脂肪组织脂滴面积均减小(P<0.01),ElA组脂滴面积虽然减小,但是效果不及Exe组(P<0.01,表3,图3)。

Tab. 3 Wet weight of white fat in rats after 4 weeks (g, n=8)

Fig. 3 HE staining of perirenal fat (up) and epididymal fat (down)adipose tissue(counted×400)
2.4 骨骼肌蛋白表达情况
2.4.1 AMPKα、p-AMPKα蛋白表达 经过4周干预后,与Sed组相比,Exe组、ElA组AMPKα蛋白表达增加(P<0.05),p-AMPKα、p-AMPKα/AMPKα蛋白表达显著增加(P<0.01,表4,图4),这表明运动和电针刺激可以激活腓肠肌中AMPKα,促进p-AMPKα蛋白表达。
2.4.2 PGC-1α、FNDC5蛋白表达 4周干预后,Exe组、ElA组大鼠腓肠肌中PGC-1α、FNDC5蛋白表达均显著增加,均明显高于Sed组(P<0.01),这表明运动和电针均可以增加腓肠肌中PGC-1α、FNDC5蛋白表达(表4,图4)。

Tab. 4 The expressions of AMPKα, p-AMPKα, PGC-1α and FNDC5 in gastrocnemius of n=8)

Fig. 4 The expressions of AMPKα, p-AMPKα, PGC-1α and FNDC5 in gastrocnemius of rats
2.5 大鼠血清Irisin水平的检测
经过4周干预,与Sed组相比,Exe组和ElA组血清中Irisin水平明显升高(P<0.05),Exe组和ElA组之间没有显著性差异(P>0.05,表5)。
2.6 脂肪组织蛋白表达情况
4周干预结束后,与Sed组相比,ElA组大鼠肾周白色脂肪UCP1蛋白表达显著性增加(P<0.01);与Exe组相比,ElA组UCP1蛋白表达显著增加(P<0.01,表5,图5)。
经过4周干预,与Sed组相比,Exe组、ElA组大鼠肩胛棕色脂肪UCP1蛋白表达均增加,ElA组大鼠肩胛棕色脂肪UCP1蛋白表达更加显著(P< 0.01,表5,图5)。表明电针和有氧运动不仅可以增加白色脂肪组织UCP1蛋白表达,而且还能增加棕色脂肪组织UCP1蛋白表达。

Tab. 5 The expressions of Irisin and UCP1 of n=8)

Fig. 5 The expressions of Irisin and UCP1 in fat tissues of rats
3 讨论
在生长发育过程中,如果出现能量积累,很容易造成体脂和体重增加。目前最常见控制体重的方式是运动,有规律的有氧运动既能降低人体BMI和内脏脂肪含量[8],又能改善低密度脂蛋白和甘油三脂的水平[9]。本研究发现4周有氧运动也可以降低大鼠体脂含量,有效控制体重增长。同样,针刺作为一种干预肥胖的方法,已经广泛应用于临床和试验中,而且Meta分析已经评估并验证针刺治疗肥胖的功效和优越性[4],本研究对大鼠进行4周电针干预,发现大鼠体脂含量降低,体重缓慢增长且增长趋势逐渐趋于运动组,这说明电针也能有效控制体重增长,降低体脂含量,且随着时间的延长,电针干预可以达到有氧运动减脂的效果。另外,如果能量摄入过多,多余的能量将以甘油三脂的形式储存在白色脂肪组织中,造成白色脂肪堆积,引发肥胖。但是,如果成功诱导白色脂肪组织向棕色脂肪组织转化,可以提高机体耗能能力、产热增加、促进能量消耗,进而降低体脂含量。本研究发现4周电针和有氧运动干预后,大鼠肾周和附睾周围脂肪含量减少,这说明电针和有氧运动均能有效减少大鼠白色脂肪含量,改善大鼠内脏脂肪,提示在减脂中使用电针干预或许能达到有氧运动减脂的效果,而且电针引起的疼痛应激的生理生化效应对本研究的影响较小。因此对于久坐不动、心肺功能较差、体重负荷较大或下肢损伤等特殊人群来说,可以选择电针“足三里”“天枢”等穴位防治肥胖,且能达到近似有氧运动减脂的效果。
脂肪细胞作为体内最大的能源库,具有能量代谢、脂肪代谢的功能,对维持机体能量代谢具有重要作用。其中白色脂肪细胞由大量单泡脂肪细胞聚集而成,在HE染色切片上,脂滴呈空泡样,具有储存多余能量的特点。棕色脂肪细胞由多泡脂肪细胞组成,含有大量线粒体,具有产热消耗能量的作用。因此,驱使白色脂肪细胞向棕色脂肪细胞转变,可以增加机体产热和能量消耗。诸多研究发现电针刺激可以诱导米色样或棕色样脂肪细胞生成,增加棕色脂肪含量[1]。本研究观察棕色脂肪组织切片HE染色,发现脂滴的大小和数量发生显著变化。与对照组相比,电针组和运动组脂滴面积非常显著减小,这说明电针和有氧运动均能减少白色脂肪含量,促使棕色脂肪含量增加。与运动组相比,电针组脂滴面积较大、数量较多,说明运动诱导白色脂肪“棕色化”的效果可能更佳,但也可能是电针时间较短所致,因此运动和电针促进白色脂肪“棕色化”的效果还有待进一步研究。另外,脂肪细胞中含有一种特定标记物——解偶联蛋白(UCP1),促使棕色脂肪组织中的线粒体解偶联,增加机体产热燃烧能量[10],因此,电针干预促进白色脂肪“棕色化”的过程伴随着解偶联蛋白(UCP1)表达增加,但是其分子机制尚不清楚。
腺苷酸活化蛋白激酶(AMPK)作为最重要的能量平衡调节剂,与肌肉因子和脂肪细胞因子密切相关。研究发现不仅长期耐力训练能够增加机体骨骼肌细胞AMPK的水平[11],而且电针也能够增加骨骼肌AMPK的活性,增加机体外周组织线粒体生物合成以及代谢功能等[12]。本研究同样发现电针和有氧运动刺激后骨骼肌中AMPK蛋白表达增加,提示AMPK的高表达可能促进肌肉因子与脂肪组织“crosstalk”,加速脂肪分解,抑制体重增长以及减少白色脂肪的重量,维持能量代谢平衡。同时,肌肉因子在骨骼肌和脂肪“crosstalk”中起着重要作用,对预防非传染性慢性疾病也有很多益处。Irisin作为一种新型肌动蛋白,具有减脂效果,运动后人类和大鼠骨骼肌Irisin分泌增加[13]。Huh[14]等也发现运动促进过氧化物酶体增殖物激活受体-γ辅激活因子(PGC-1α)表达,引发肌肉编码膜蛋白FNDC5水解产生Irisin,进入血液循环与其他组织“crosstalk”,从而发挥作用。目前,不同运动方案中Irisin的表达情况仍存在争议。例如,间歇性短跑[15]、90 min跑台运动[16]能够促进血清中Irisin的表达,但是Yoshifumi实验表明耐力训练后1 h,Irisin水平没有发生变化[17]。另外,诸多研究认为小鼠3周自由轮转运动[18]或人类进行10周耐力训练[18]也能使Irisin的表达增加。基于课题组前期有氧运动减脂的研究[2],增加电针干预,期望探究电针干预是否通过调节Irisin “crosstalk”脂肪组织达到减脂的效果。因此本研究对大鼠进行4周电针干预后,发现骨骼肌中PGC-1α、FNDC5蛋白表达显著增加,血清中Irisin的表达也显著升高,这说明电针干预激活骨骼肌AMPK活性后,通过AMPK-PGC-1α-FNDC5-Irisin信号通路,促进骨骼肌分泌Irisin,改善葡萄糖代谢,增加机体能量消耗,预防肥胖。另外,运动组和电针组之间蛋白表达没有显著差异,进一步说明电针可以作为有氧运动减脂的补充方式,达到有氧运动控制体重的效果。
另外,FNDC5/Irisin靶向作用白色脂肪组织,能够上调UCP1的表达,促进白色脂肪“棕色化”,可以有效预防肥胖症并改善葡萄糖代谢。运动能够增加棕色脂肪组织中UCP1蛋白表达[19],诸多研究提示电针干预具有同有氧运动近似的作用[20],可能通过Irisin靶向作用脂肪组织调节UCP1蛋白表达,从而诱导白色脂肪“棕色化”。因此本研究通过检测大鼠的白色脂肪和棕色脂肪中UCP1蛋白表达,发现4周干预后,运动组和电针组白色脂肪和棕色脂肪组织中UCP1蛋白表达均显著升高,这说明电针可能通过AMPK-PGC-1α-FNDC5-Irisin-UCP1信号通路,刺激骨骼肌分泌并释放Irisin,与脂肪组织“crosstalk”,促进脂肪组织UCP1蛋白表达增加,实现白色脂肪“棕色化”(图6)。与运动组相比,电针组UCP1蛋白表达更高,这提示电针诱导白色脂肪“棕色化”的效果可能比单纯运动好,有待进一步探究。

Fig. 6 The mechanism of “Browning" white fat induced by electroacupuncture
综上所述,4周电针干预具有与4周有氧运动近似的减脂效果,可以控制大鼠体重增长,降低体脂百分比,减少白色脂肪组织含量。电针干预可以通过AMPK-PGC-1α-FNDC5-Irisin-UCP1信号通路,促进骨骼肌分泌并释放Irisin,靶向作用脂肪组织,实现骨骼肌与脂肪组织“crosstalk”,诱导白色脂肪“棕色化”,从而起到减脂作用。这虽为传统针刺在防治肥胖方面提供理论依据,但尚需进行长期针刺与有氧运动干预对白色脂肪“棕色化”影响的研究,以进一步验证效果明确机制。

