硫酸镁对枯草芽胞杆菌发酵的影响
张丽霞, 杨 帆, 娄 恺, 王 琦
(1. 新疆天物生态科技股份有限公司,新疆 乌鲁木齐 830000; 2.中农绿康(北京)生物技术有限公司,北京 102101; 3. 新疆农业科学院 微生物应用研究所,新疆 乌鲁木齐 830091; 4.中国农业大学 植物病理学系, 北京 100193)
以芽胞杆菌及其代谢产物为核心的生防制剂的使用在提升农作物品质,增加产量,减少化肥农药的使用方面做出了重要的贡献[1],尤其在防治植物病原真菌引起的各种病害方面效果显著[2],枯草芽胞杆菌普遍具有安全、繁殖快、抗逆性强[3]、易于定殖等优势,研究发现枯草芽胞杆菌能够分泌抗生素、抗菌蛋白、酶或多肽等活性物质[4-6],防治植物病害的同时促进植物生长。芽胞杆菌的发酵培养是其走向生产应用的第一步,也是最重要的一步。在培养基优化的过程中发现MgSO4的添加量对枯草芽胞杆菌B201的发酵过程有着显著的影响。镁离子对芽胞杆菌发酵产孢的积极作用已有不少报道,金华等[7]发现镁离子对丁酸梭状芽胞杆菌Z-10芽胞的形成具有显著的促进作用,林陈强等[8]报道培养基中添加适量的镁离子对芽胞杆菌CHB201的菌体生长和芽胞形成有显著影响。目前培养基的优化多以发酵周期、活菌数以及芽胞率为主要衡量指标[9-11],但是在生产上芽胞杆菌的发酵对后续微生物产品的加工以及储存起着决定性的作用[12]。本研究将在保留传统指标的前提下,结合发酵液中残糖残氮含量等指标综合选择适用于菌株B201发酵生产的MgSO4添加量。
1 材料与方法
1.1 材料
1.1.1 供试菌株 枯草芽胞杆菌(Bacillussubtilis) B201,由中国农业大学分离保藏。
1.1.2 培养基(g/L) ①种子培养基:NaCl 5,牛肉膏 3,蛋白胨 7,pH 7,装液量500 mL/2 L,121 ℃ 湿热灭菌30 min;②发酵培养基:淀粉 40.57,酵母粉 18.52,蛋白胨 15.78,CaCO35.2,K2HPO43.33,MnSO40.017,葡萄糖 15.67,KCl 1.11,MgSO4浓度待调整,pH 7,118 ℃湿热灭菌30 min。装液量400 mL/2 L,接种量为培养基装液量的10%(体积分数)。
1.1.3 主要仪器及设备 生化培养箱(DHP-9272,上海一恒科技有限公司);恒温振荡摇床(DHZ-DA,江苏省太仓市豪成实验仪器制造有限公司);紫外-可见分光光度计(Lab Tech UV BLUE STAR B,北京莱伯泰科仪器有限公司);分析天平(METTLER TOLEDO AL104,梅特勒-托利多仪器(上海)有限公司);生物显微镜(OLYMPUS CX22);电热恒温水浴箱(HW·SY21-K,北京市长风仪器仪表公司);pH计(SartoriusPB-10,赛多利斯科学仪器(北京)有限公司)。
1.2 方法
1.2.1 MgSO4添加量设置 根据预实验设置5个MgSO4添加量梯度(质量分数,下同),分别为 0.13%、0.24%、0.46%、0.87%、1.70%添加量。
1.2.2 发酵周期、活菌数和芽胞率统计 将枯草芽胞杆菌B201甘油菌接种于固体活化培养基上,32 ℃培养待单菌落出现。挑取单菌落于种子培养基中,32 ℃ 180 r/min培养16 h,以10%的接种量接种至发酵培养基中,32 ℃ 180 r/min培养,不定期涂片观察,直到发酵结束,从接种到完成产孢为一个发酵周期。发酵结束后,取发酵液采用涂平板计数方法进行活菌计数,采用计数器进行芽胞率统计,每个处理统计3个视野。
1.2.3 发酵液灭菌前后pH变化 配置好培养基,以pH试纸为参考用NaOH溶液调节培养基pH至中性后,用pH计进行测量。装液量200 mL/500 mL,灭菌后检测培养基pH。
1.2.4 菌体形态变化 通过预实验,初步判断约50 h结束发酵,同时为减小中途取样对发酵过程造成的影响,设置12 h为取样节点,用移液枪取5 mL发酵液用于pH检测。在完成pH测量后,涂片观察并拍照。
1.2.5 发酵液pH、残糖和残氮的测定 发酵结束后测量发酵液的pH值。DNS法检测残糖发酵液还原糖含量,检测用样2 mL;凯氏定氮法检测发酵液氨基氮含量,检测用样5 mL。
1.2.6 数据处理与作图 文中数据分析软件为SPSS 22.0,作图软件为Graphpad Prism 8。
2 结果与分析
2.1 MgSO4添加量对菌株B201发酵周期、活菌数、芽胞率的影响
由表1可知,培养基中MgSO4的添加量对枯草芽胞杆菌B201发酵周期、活菌数及芽胞率具显著影响。随着MgSO4添加量的增加,活菌数逐渐降低,MgSO4添加量为0.13%时活菌数为111.67×108cfu/mL,1.70%时活菌数为68×108cfu/mL。发酵周期和芽胞率随着MgSO4添加量的增加先升后降,MgSO4添加量为0.46%时发酵周期最短为26 h,其他处理发酵周期相同为48 h,0.24%时,芽胞率为89.33%,与0.13%时相比无显著差异,但显著高于0.46%、0.87%和1.70%的处理。
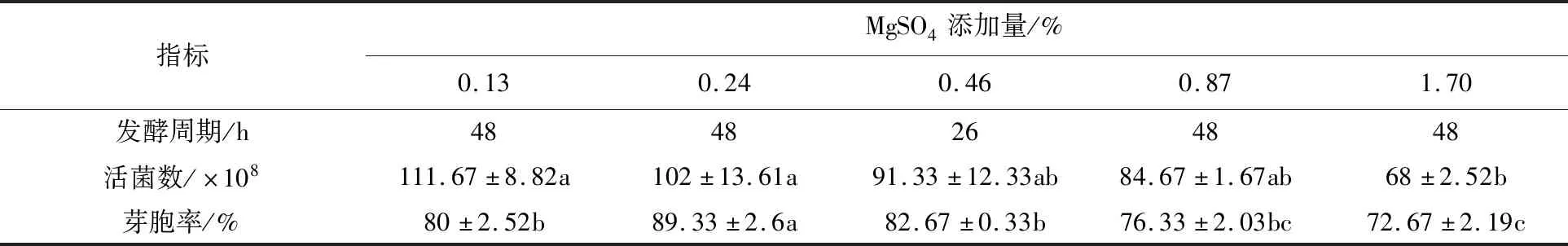
表1 不同MgSO4添加量培养基发酵基本情况
2.2 培养基灭菌前后pH值变化
实验结果表明(图1),用pH试纸调节培养基的pH存在约7%的误差。添加0.13%、0.24%、0.46%MgSO4的培养基灭菌后pH下降,而添加0.87%和1.70%MgSO4的培养基灭菌后pH明显上升,随着MgSO4添加量的增加灭菌后的培养基pH逐渐升高。本次实验在使用NaOH调节pH的过程中,由于大量添加了0.87%和1.75%MgSO4,使MgSO4与NaOH反应生成片状Mg(OH)2沉淀,剧烈搅拌后,沉淀均匀分散。其中Mg(OH)2溶于水的Mg(OH)2的部分是完全电离的,而高温灭菌使Mg(OH)2沉淀溶解度增大,推测这可能是添加0.87%和1.70%MgSO4灭菌后培养基pH剧烈升高的原因。
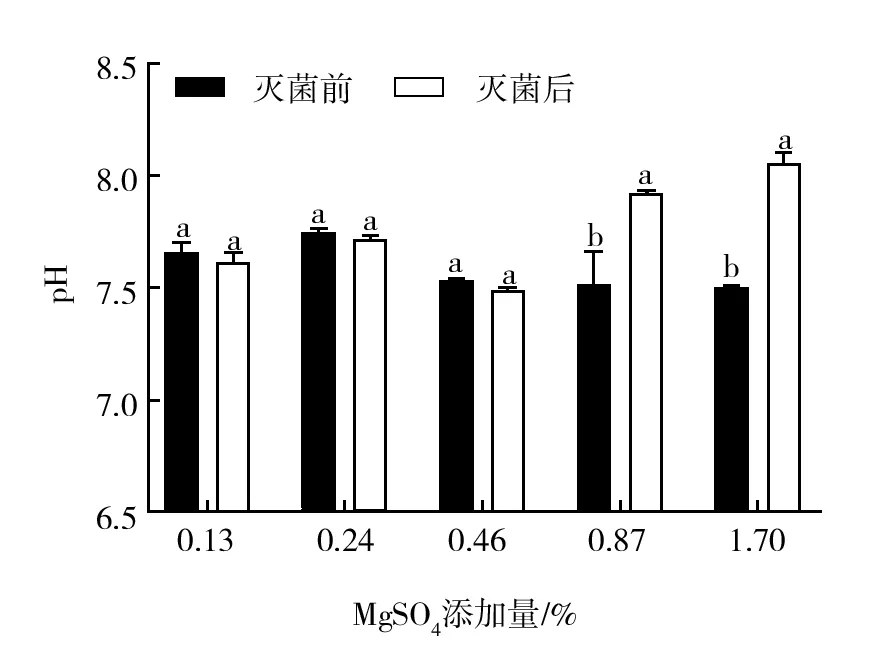
图1 不同培养基灭菌前后pH变化Fig.1 pH changes before and after sterilization with different media pH图中不同小写字母表示在5%水平上差异显著Different lowercase letters in the figure indicate significant differences at 5% level
2.3 发酵过程中不同时期菌体生长状态
发酵12 h时涂片观察,0.87%和1.70%处理菌体较少,且菌体形状会发生变化,在高浓度MgSO4的培养基中菌体短小,菌体形态的改变从0.46%处理时就开始出现,随着MgSO4浓度增大,导致细菌细胞膜内外渗透压不同,膜内的水分透过膜进入培养基,造成细胞失水,菌体生长受到影响。发酵24 h时,不同培养基中的菌体形态无差异,发酵36 h时,添加0.13%、0.24%、0.87%和1.70%MgSO4的培养基处理均有产孢迹象,48 h发酵结束。结果见图2。
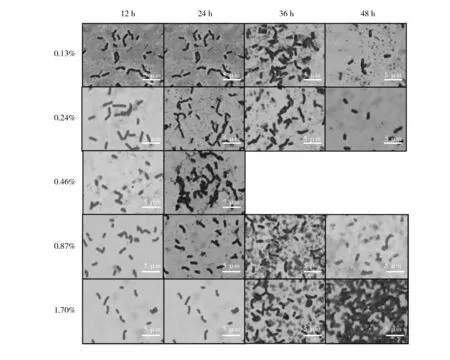
图2 不同发酵时期菌体形态Fig.2 Cell morphology in different fermentation stages
2.4 MgSO4添加量对发酵液pH、残糖和残氮的影响
从表2可以看出,发酵液中的剩余还原糖和氨基氮随着MgSO4添加量的增加而升高。添加0.13%MgSO4的发酵液中剩余还原糖和残留氨基氮含量最少。添加0.87%和1.70% MgSO4的残氮量较高,均高于添加0.13%、0.24%和0.46%MgSO4处理组,且两种处理间无显著差异,0.13%和0.24%两处理发酵液残糖含量较低,且均低于0.46%、0.87%和1.70%处理组,且两处理组间无差异。添加0.46%MgSO4发酵液pH值低于其他处理组。实际生产中多用采苯甲酸钠防腐[13],由于苯甲酸钠发挥防腐作用的pH值需要小于4[14-15],因此需要加入大量的酸来调节pH,这在一定程度上增加了生防菌剂的生产成本,如果放罐时发酵液的pH值低,应减少调酸用量。

表2 MgSO4添加量对发酵液pH、残糖和残氮的影响
3 讨 论
本研究发现芽胞杆菌B201可在MgSO4添加量为1.70%条件下完成整个生长周期,表明该菌株有一定的耐盐能力,这为菌株B201田间应用优异表现又添新的力证。
姚露燕等[16]研究了多种金属离子对枯草芽胞杆菌BS-MM03芽胞形成的影响,结果发现镁离子可明显影响其芽胞率,关于金属镁离子对芽胞杆菌发酵的影响,研究者多谈到其对芽胞杆菌芽胞率和活菌数的影响[17-19],而对金属镁离子在缩短发酵周期,加速产孢进程方面的报道较少。本研究发现0.46%的MgSO4添加量使菌株B201发酵周期较其他处理缩短了45.83%。已有研究证实镁离子是许多酶的辅助因子,MgSO4参与微生物细胞壁的形成,对菌体生长具有重要的作用[20]。然而,在芽胞生产过程中,不同菌种所需镁离子的质量浓度存在差异,罗顺等[21]研究发现混凝土自修复菌Bacillussp. 高芽胞获得率的最适镁离子质量浓度为0.24 g/L,董佩佩等[22]对1株凝结芽胞杆菌产芽胞培养基进行优化发现,其所需镁离子最适质量浓度为0.49 g/L。吴迎奔等[23]发现Mg3(PO4)2的添加量为0.2 g/L时有助于侧孢芽胞杆菌C5芽胞形成,本研究表明MgSO4添加量为0.24%时,菌株B201的芽胞率最高。单因素实验表明,MgSO4对枯草芽胞杆菌发酵进程、芽胞率以及活菌数都有着极其显著的影响,且不同指标的最高值出现在不同量的MgSO4添加条件下。芽胞杆菌的芽胞形成是数百个基因协同作用的复杂过程,其中芽胞形成最主要调控因子为 Spo0A 和几个 sigma 因子[24],同时研究报道 Spo0A 因子的磷酸化状态(Spo0A~P)对 sigma 因子的转录起着重要的调控作用[25]。近期研究人员发现Spo0A 因子的激活作用是受到磷酸化激酶 KinA 的诱导,KinA 的积累达到一定程度才能诱导 Spo0A 因子发挥作用[26]。猜测镁离子可能是KinA的重要辅助因子,合适的镁离子浓度加速了产孢的进程,而镁离子对菌株B201芽胞形成产生显著影响的内部机理还有待进一步探究。本研究不仅对菌株B201发酵培养基中MgSO4用量进行了优化,还为培养基的优化调控提供了更多的思路。