高产不饱和油脂海鞘真菌桔青霉Asc-2-4的诱变选育
罗国聪,柴慧子,雷晓凌*, 聂芳红,罗正东
(1. 广东海洋大学 食品科技学院,广东 湛江 524088;2. 暨南大学 病原微生物研究所,广东 广州 510632)
海鞘是海鞘纲的尾索动物,属于海洋污损生物之一,其独特的滤食系统使其富集了大量的微生物[1]。近年来,国内外报道了从海鞘中发现了很多生物碱、萜类、甾体等活性物质,具有抗肿瘤、抗病毒、抗微生物等显著的生物活性[2],相对于陆地真菌而言,海洋真菌能够耐受海洋特有的如高盐、高压、低氧、低光照等多种极端条件,因此产生了化学结构独特的次级代谢产物[3]。某些微生物能够在一定条件下将碳源、氮源以及一些无机盐转化,油脂含量达到其生物量的20%以上,称为产油微生物[4]。产油真菌是其中的一大类,如深黄被孢霉、高山被孢霉和拉曼被孢霉等。产油真菌在不同环境下的适应能力很强,多产碳十六和碳十八系列不饱和脂肪酸,发酵产油具有周期短,不受产地限制等优势[5],可以作为生物油脂的菌种来源或作为优质脂肪酸的补充来源。发展生物油脂能改善我国的能源结构,获取产油性状良好的菌株是发酵产油的一个关键因素,获取一株优质的产油菌株已成为国内外研究的热点。诱变育种技术是获得高产突变菌的一种有效方式,本研究前期从海鞘中筛选得到1株高产油脂的海鞘共附生真菌桔青霉(Penicilliumcitrinum)Asc-2-4[6],期望通过紫外线-氯化锂复合诱变[7],结合丙二酸筛选技术,选育出高产突变株,以期提高菌株的油脂产量和不饱和脂肪酸产量,可望作为功能性油脂微生物被开发利用,为开发海洋真菌油脂资源提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源 前期从海鞘中分离出的1株高产油脂的真菌,桔青霉菌(Penicilliumcitrinum)Asc-2-4,NCBI登录号为KX462901,保藏于广东省微生物菌种保藏中心,保藏编号为GDMCC NO:60059。
1.1.2 培养基(g/L) ①种子培养基:马铃薯粉 28,海精盐 30,酵母膏 1,(NH4)2SO410,pH自然;②发酵培养基:马铃薯 200,葡萄糖 100,KH2PO42,蛋白胨 0.5,酵母膏 0.5,柠檬酸钠 0.1,海精盐 30,K2HPO40.2,pH自然。
1.1.3 试剂与仪器 氯化锂、丙二酸、氯仿、氢氧化钾、盐酸均为分析纯;14%三氟化硼甲醇溶液为色谱纯。HYG-A全温振荡培养箱(金坛市万华实验仪器厂);BMJ-250霉菌培养箱(上海博讯实业有限公司医疗设备厂);LDZX-50KBS立式压力蒸汽灭菌器(上海申安医疗机械厂);GC-2010PLUS自动进样气相色谱仪(日本岛津)。
1.2 方法
1.2.1 紫外线-氯化锂复合诱变 菌株Asc-2-4取出后接种至马铃薯葡萄琼脂培养基平板中,(28±1) ℃活化培养3~4 d,活化3代,用接种环刮取菌丝体的孢子到10 mL 0.9%的无菌生理盐水中,制备孢子悬液,加蒸馏水稀释,调整孢子悬液浓度在106~108个/mL。为了研究紫外线-氯化锂的最适诱变时间,以紫外线-氯化锂诱变时间为自变量,孢子存活率为因变量,制作存活率曲线。诱变时间为0、30、60、90、120 s,诱变结束后,取200 μL孢子悬液,涂布于PDA平板,每组3个平行,(28±1) ℃避光培养3 d,以菌落形成单位(CFU)计算存活率,对照组为未经诱变处理的孢子悬液[8]。
存活率(%)=(诱变后菌落形成数/空白对照菌落形成数)×100%
1.2.2 丙二酸筛选浓度的确定 向冷却至50 ℃的100 mL PDA培养基中分别加入500 g/L的丙二酸溶液0、0.2、0.4、0.8、1.2 mL,分别配制出0、1、2、4、6 g/L质量浓度的丙二酸PDA培养基,接种出发菌株孢子悬液到含丙二酸的平板中,涂布均匀,(28±1) ℃培养3 d。与对照组比较,确定丙二酸临界浓度[9]。
1.2.3 发酵培养基无机盐的条件优化 在前期的单因素试验中,发现MgSO4、KH2PO4、FeCl3三种无机盐对突变菌Asc-2-4-1的产油含量有影响,以KH2PO4、MgSO4、FeCl3设置正交试验,即KH2PO4(3、4、5 g/L),MgSO4(50、100、150 mg/L),FeCl3(2、4、6 mg/L),以油脂得率为考量指标,考察KH2PO4、MgSO4、FeCl3对菌株Asc-2-4-1产油脂的影响,从而确定这三种无机盐的最佳配比。

表1 正交实验因素水平表
1.2.4 培养与测定方法 ①摇瓶种子培养:从斜面中挑取1环菌丝到种子培养基中,(28±1) ℃,180 r/min摇床培养48 h。②摇瓶发酵培养:以5%(体积分数)的接种量将种子液接种到发酵培养基中,180 r/min,(28±1) ℃恒温摇床培养7 d。③生物量的测定:采用干重法测量生物量。④油脂的提取:超声波辅助酸热法提取油脂[10]。油脂经甲酯化处理[11],气相色谱分析脂肪酸成分。⑤计算公式:生物量(g/L)=干菌体质量/发酵液体积;油脂含量(%)=(提取油脂的质量/干菌体质量)×100%;油脂得率(g/L)=生物量(g/L)×油脂含量(%);不饱和脂肪酸含量(g/L)=油脂得率(g/L)×不饱和脂肪酸百分含量(%)。
2 结果与分析
2.1 紫外线-氯化锂复合诱变时间的确定
紫外线-氯化锂复合诱变育种技术是获得高产突变菌的一种有效方式。紫外线是物理诱变剂,氯化锂是一种碱金属卤化物,本身不具备诱变作用,但可以协助加强紫外线的诱变作用[12]。
紫外线-氯化锂复合诱变的孢子存活率曲线如图1,菌株孢子悬液存活率随着诱变时间增加而降低。现代育种理论认为,当菌株存活率在20%~30%时,正突变率会相对较高[13]。因此本研究确定最佳的诱变时间为70 s,与孙登岳[14]确定的紫外线-氯化锂复合诱变时间相近。
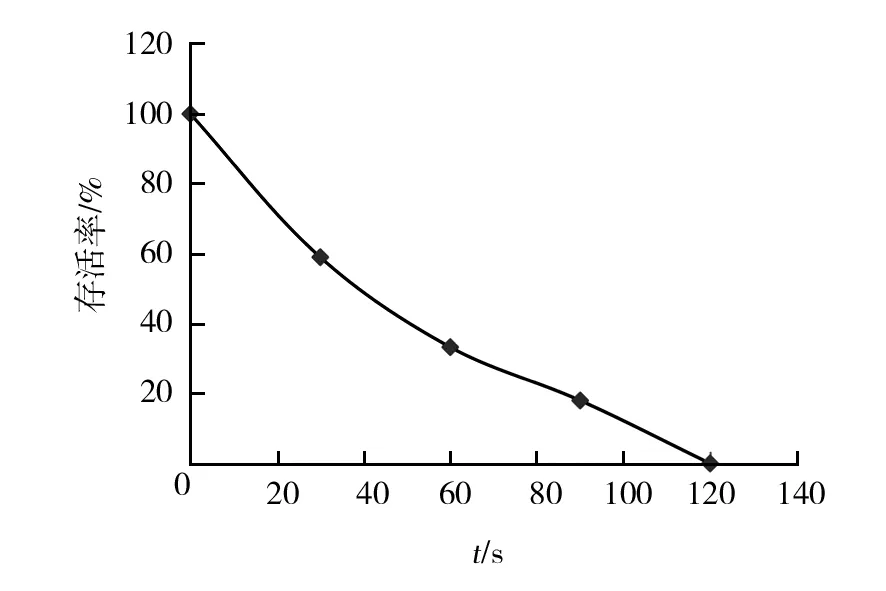
图1 紫外线-氯化锂复合诱变存活率曲线Fig.1 The curve of survival ratio of Asc-2-4 mutated by UV and LiCl
2.2 丙二酸筛选浓度的确定
丙二酸抗性菌株的ATP代谢比较高,在发酵前期有利于菌体的生长,在发酵后期有利于微生物合成油脂。丙二酸结构类似于琥珀酸,能够竞争性抑制琥珀酸脱氢酶,能够抑制三羧酸循环,属于呼吸酶抑制剂[9],见表2。
当丙二酸的添加量大于4 g/L时,几乎所有菌落都不能生长,抑制率达到100%;当丙二酸添加量为1 g/L,达不到抗性筛选的效果;当丙二酸添加量为2 g/L时,部分菌落能正常生长,菌落直径较大。因此选用2 g/L的丙二酸作为筛选剂量加入平板培养基中,对突变菌进行选择。所确定的丙二酸质量浓度比陈金卿等[15]筛选耐丙二酸高产DHA菌株的质量浓度(0.5 g/L)略高,该质量浓度能保障起到一定的筛选作用,能筛选出一些性能较好的突变菌,为下一步研究提供优质菌种。

表2 不同浓度的丙二酸对Asc-2-4的抑制作用
2.3 高性能突变菌株的复筛
将出发菌株和突变菌株摇瓶发酵,得到的生物量、油脂含量、油脂得率如图2所示。
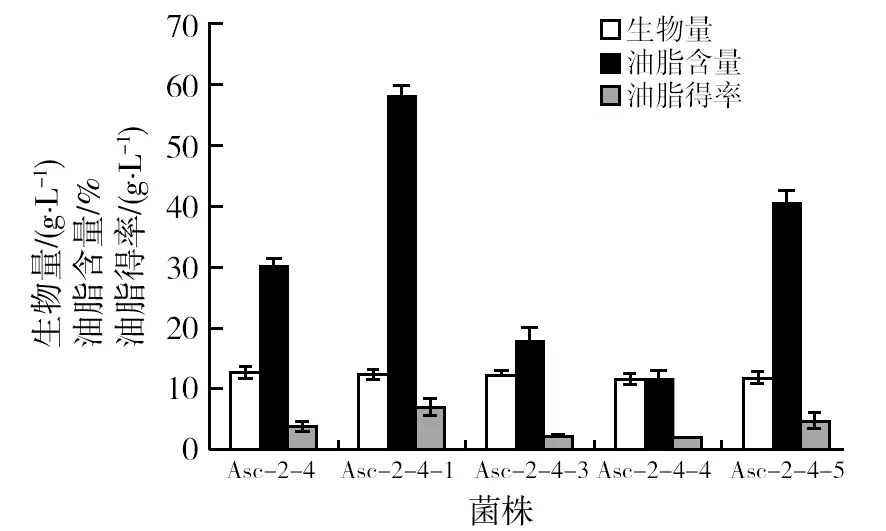
图2 出发菌株和突变菌株的生物量和油脂得率比较Fig.2 The compare on biomass and lipid synthesis of original strain and mutant strains
由图2可知,各菌株的生物量都保持在11~13 g/L的范围,出发菌株Asc-2-4的油脂含量为30.05%,与之相比,有两株突变菌株油脂含量和油脂得率有所提高。 Asc-2-4-1的油脂含量为57.99%,提高了92.98%;Asc-2-4-5的油脂含量为40.28%,提高了34.04%。而就油脂得率而言,出发菌株为3.85 g/L,Asc-2-4-1和Asc-2-4-5分别为7.10 g/L和4.80 g/L,相对于出发菌株来说,油脂得率都有所提高,分别提高了84.42%和24.68%。综合比较生物量,油脂合成能力,突变菌Asc-2-4-1产油脂具有较大优势,所以选择突变菌株Asc-2-4-1用于后续的发酵条件优化。该菌株保藏于广东省微生物菌种保藏中心,编号为GDMCC No:60609。
2.4 无机盐添加量的优化
在前期的单因素试验中,发现FeCl3、MgSO4、KH2PO4三种无机盐对突变菌Asc-2-4-1的产油含量有影响,设置不同配比的无机盐添加到发酵培养基中,期望得到其发酵培养基中无机盐添加量的最佳配比,见表3。
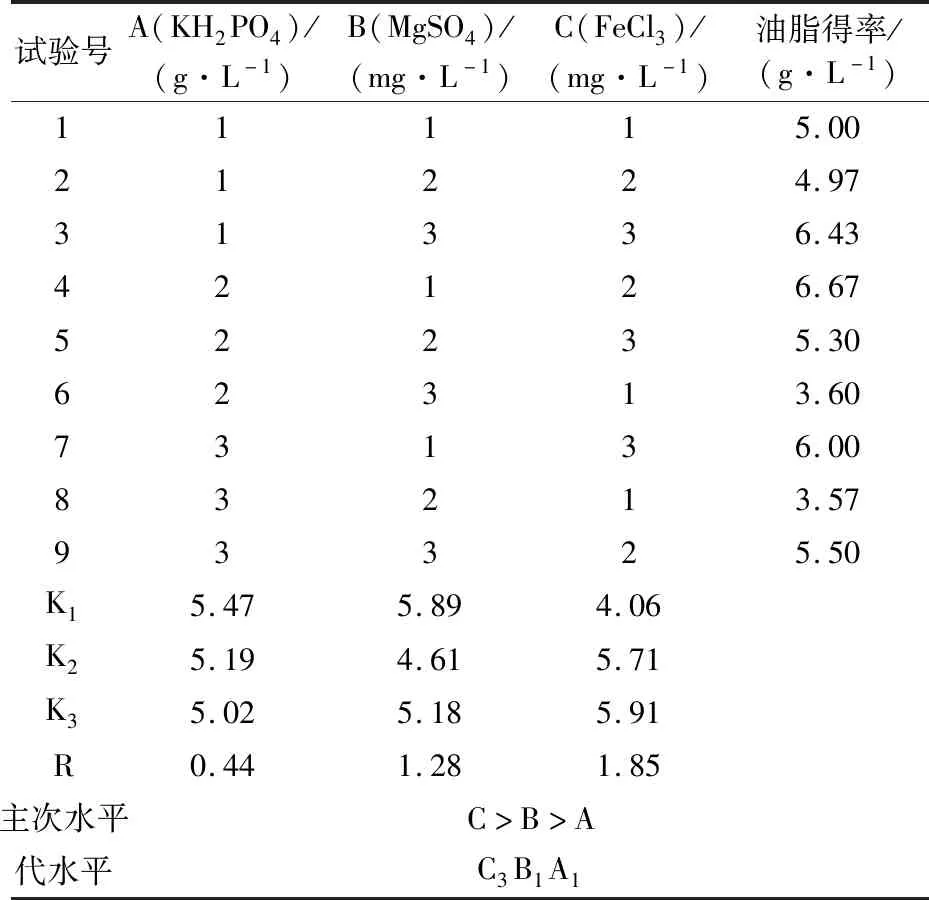
表3 无机盐正交试验
以油脂得率为考查指标,由极差分析和方差分析可见,影响油脂得率因素的顺序为FeCl3> MgSO4> KH2PO4(C>B>A),其中FeCl3的添加量对油脂得率的影响最为显著,最优配比为C3B1A1,即FeCl36 mg/L、MgSO450 mg/L、KH2PO43 g/L。
2.5 突变菌株Asc-2-4-1优化前后产油脂能力比较
从表4可以看出,优化前后脂肪酸百分含量是比较接近的,对照组的不饱和脂肪酸百分含量为53.80%,优化组的不饱和脂肪酸百分含量为54.07%。对照组和优化组的生物量较相近,最后得到优化组的油脂含量、油脂得率和不饱和脂肪酸含量均有小幅度的提升。
C16∶0向C18∶0转化的碳链延长是合成ω-3系列不饱和脂肪酸过程中一个重要的步骤,∑C18/∑C16的比值可以反映碳链延长酶的延长碳链能力,比值越大说明菌株合成ω-3系列不饱和脂肪酸的能力越强[16]。

表4 突变菌株Asc-2-4-1优化前后发酵参数对比
从图3可以看出,与对照组相比,优化组的∑C18/∑C16比值明显增大,表明优化后的发酵培养基有利于合成ω-3系列不饱和脂肪酸。
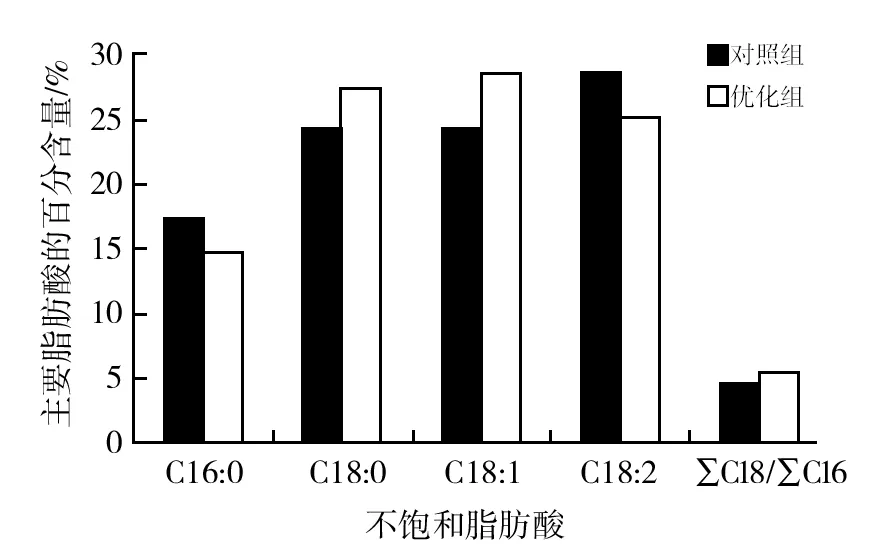
图3 菌株Asc-2-4-1金属离子优化前后主要脂肪酸含量对比Fig.3 Analysis of total fatty acid compositions of before and after optimization
2.6 突变菌Asc-2-4-1油脂成分分析
所含主要脂肪酸成分如图4所示,有棕榈酸(C16∶0)占17.35%;硬脂酸(C18∶0)占24.79%;油酸(C18∶1)占24.40%;亚油酸(C18∶2)占28.59%;饱和脂肪酸(棕榈酸,硬脂酸)占其脂肪酸成分42.14%;不饱和脂肪酸(油酸,亚油酸)占其脂肪酸成分52.99%。
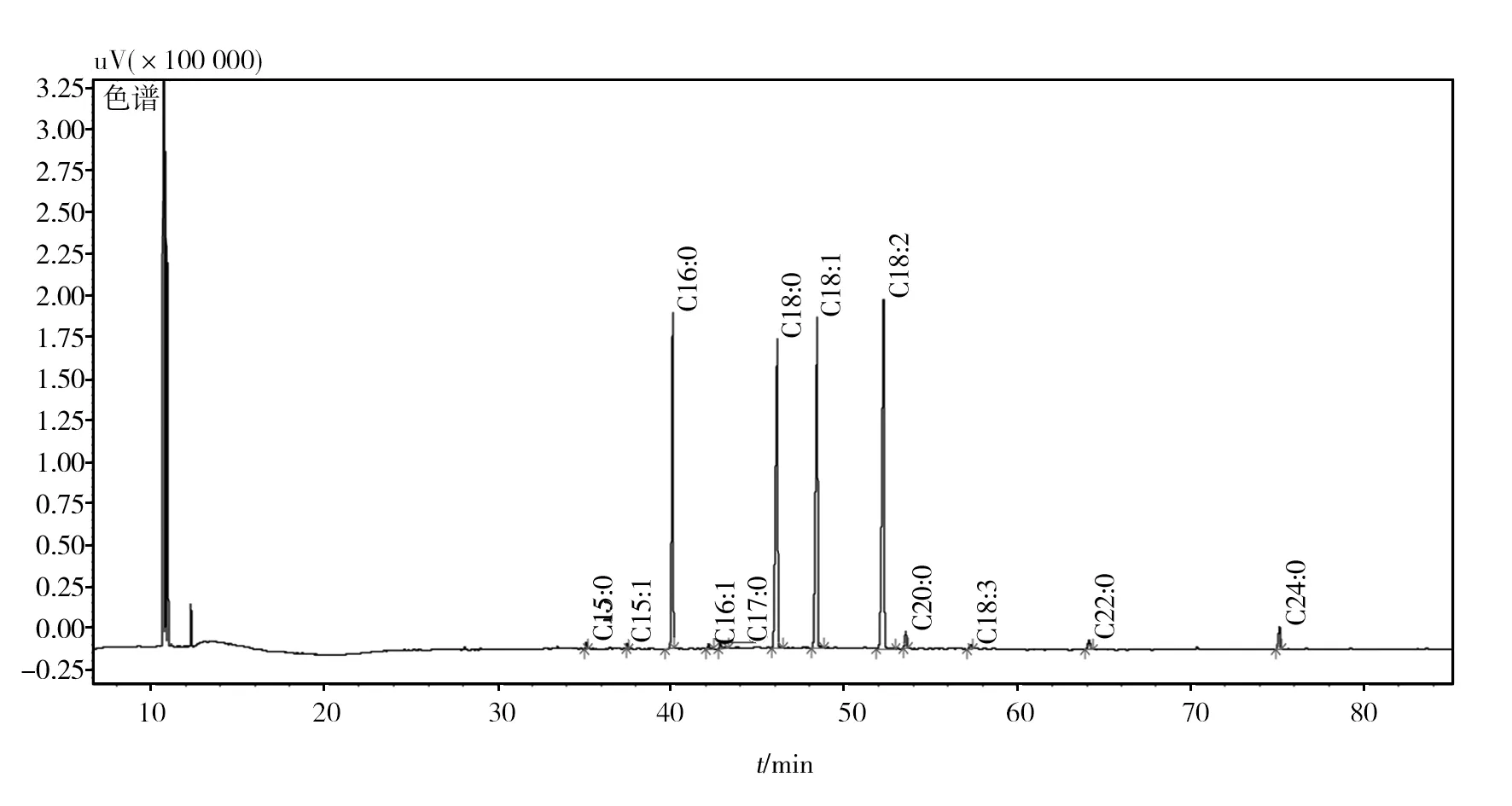
图4 菌株Asc-2-4-1油脂的脂肪酸成分分析Fig.4 Analysis of fatty acid compositions of fungi Asc-2-4-1
次要脂肪酸成分有十五烷酸(C15∶0),银杏酸(C15∶1),棕榈油酸(C16∶1),十七烷酸(C17∶0),花生酸(C20∶0),二十二烷酸(C22∶0),二十四烷酸(C24∶0),α-亚麻酸(C18∶3)、二十四烷酸(C24∶0)。从Asc-2-4-1提取的粗油脂如图5所示。
图5 从Asc-2-4-1提取的粗油脂Fig.5 Crude oil extracted from fungi Asc-2-4-1
3 讨 论
本研究通过建立紫外线-氯化锂诱变,结合丙二酸(2 g/L)初筛的方法,成功获得4株油脂得率更高的突变菌株,其中2株的油脂得率有所提高,Asc-2-4-1和Asc-2-4-5的油脂得率分别提高了84.42%和24.68%。李慧玲等[17]采用紫外线和硫酸二乙酯复合诱变得到1株高产油脂突变XN001,生物量为22.38 g/L,油脂含量为45.73%。突变菌Asc-2-4-1的生物量为12.25 g/L,油脂含量为57.99%,与之相比,Asc-2-4-1的生物量稍低,油脂含量基本在同一范围内,说明本研究诱变-筛选方法的效率高,有一定的可行性。此外,培养基经过无机盐优化后,突变菌Asc-2-4-1的不饱和脂肪酸含量提高了6.96%,表明Fe3+、Mg2+可促进油脂积累、生物量增加,从而提高油脂得率,并且菌株的不饱和脂肪酸产量越高,长链的不饱和脂肪酸越多,易流动,有利于油脂的运输[18]。
目前研究青霉发酵产油的脂肪酸组成成分主要有油酸、棕榈酸和亚麻酸[19]。油酸是一种人体必需的营养物质,可延缓动脉粥样硬化,对高血压患者有很好的保健作用,是Asc-2-4-1所产生的油脂中的主要成分之一,占油脂提取物的24.40%,可作为生产油酸的生物油脂来源之一。
突变菌Asc-2-4-1的油脂含量最高可达58.04%,与已发现的通过发酵条件优化和诱变育种的青霉菌生产油脂含量最高为64.15%[20]相比,其油脂含量较接近,但其生物量稍显不足,后续可通过碳源、氮源、碳氮比等培养基优化方法提高菌体含量,还可进行发酵罐发酵,调节溶氧量提高菌体的生物量。海洋真菌作为海洋微生物的一个重要类群,具有研究和开发的巨大潜力[21]。