松材线虫生防真菌伊氏线虫菌研究进展*
茅裕婷 马 涛 蓝来娇 温秀军
(华南农业大学林学与风景园林学院 广东省森林植物种质创新与利用重点实验室 广州 510642)
松材线虫病(Bursaphelenchusxylophilus)又称松树萎蔫病,是一种能造成松林快速枯萎死亡、对森林资源造成严重危害、给国民经济带来极大损失的全球检疫性和毁灭性流行病害(潘宏阳等, 2009; Vicenteetal., 2012)。松材线虫病致病因子为松材线虫,并通过人为因素和媒介天牛等进行传播扩散(Zhaoetal., 2008; 张星耀等, 2011)。目前,主要从其病原松材线虫和传播媒介松褐天牛(M.alternatus)2个方面,实行预防为主,结合物理、化学和生物防治对松材线虫病进行综合治理,但都没能控制和拔除疫区(Leeetal., 2003; 刘刚, 2006; 仇辉康, 2015)。
目前生防微生物和植物性杀线虫物质被用于生物防治松材线虫,并得到了广泛的研究(Olibeiraetal., 2004; 袁永平等, 2010; 姚伍等, 2018)。伊氏线虫菌(Esteyavermicola)又称伊氏杀线真菌和蠕虫埃斯特菌,是第一个被记录的内寄生松材线虫的真菌,对松材线虫表现出高侵染性和寄生率,具有作为抗松材线虫病的生物防治剂的前景和潜力,在美国和韩国均获得专利(Liouetal., 1999; Tzeanetal., 2001; Fangetal., 2010; 王婷婷等, 2014a; 王瑞珍, 2017)。目前,应用伊氏线虫菌进行松材线虫病防治引起越来越多的关注,本文综述了伊氏线虫菌的最新研究进展,并简要讨论其在未来松材线虫病生物防治中的应用潜力以及研究方向,以期为国内广大生物防治工作者提供参考,推动该菌在生物防治松材线虫病上的推广应用。
1 发现
Liou等(1999)在被松材线虫侵染的黑松(Pinusthunbergii)心材木片上发现了一个寄生于松材线虫的新属新种真菌,并将其命名为Esteyavermicola,这是首次对该菌的报道,菌株号为ATCC74485,为模式种。2000年,在捷克的正毛束小蠹(Scolytusintricatus)及其所在的橡树(Querqus)坑道中第2次分离出了伊氏线虫菌,菌株号为CBS115803(Kubátováetal., 2000)。2006年,在韩国清道郡松林土壤里被侵染的腐生线虫中第3次分离得到伊氏线虫菌,菌株CNU120806(Wangetal., 2008)。2014年,在天津从巴西进境木质包装材料截获的鲁尔夫伞滑刃线虫(B.rainulgi)中分离出1株内寄生真菌菌株NKF13222,经过鉴定确定其为伊氏线虫菌的一个新菌株(王婷婷, 2014b; Wangetal., 2014a)。此外,伊氏线虫菌还有2个菌株,由皇家荷兰生物科技研究所培养物保藏中心(CBS)1982年分离于日本的菌株CBS156.82和1998年于意大利的菌株CBS100821,这2株菌株在伊氏线虫菌被命名和详细描述之前一直被命名为其他名字,因此几乎不为人所知(Wangetal., 2009a)。目前,已发现的6个菌株(表1)分别来自于东亚、欧洲和南美洲,该真菌作为松材线虫的内寄生性天敌,可能遍布在全球范围内。
从形态学特征和侵染模式对几个菌株进行区分:CNU120806与ATCC74485、 CBS115803相似,NKF13222与ATCC74485相似,但NKF1322与CBS115803、CNU120806在孢子形成和孢子萌发方式上有差异(Wangetal., 2009a; 王婷婷, 2014b; Wangetal., 2014a)。基于2个基因序列β-tubulin和EF1-α构建的系统发育树显示ATCC74485和NKF13222有更近的亲缘关系(王婷婷, 2014b; Wangetal., 2014a)。通过28S rRNA基因序列分析,CBS115803和CNU120806有100%的同源性,在亲缘关系上最近(Wangetal., 2009a)。
2 形态特征与生物学特性
伊氏线虫菌是真菌界(Fungi)子囊菌门(Ascomycota)子囊菌纲(Ascomycetes)肉座菌目(Hypocreales) Ophiostomataceae 科Esteya属唯一的种。各菌株形态特征比较见表2。
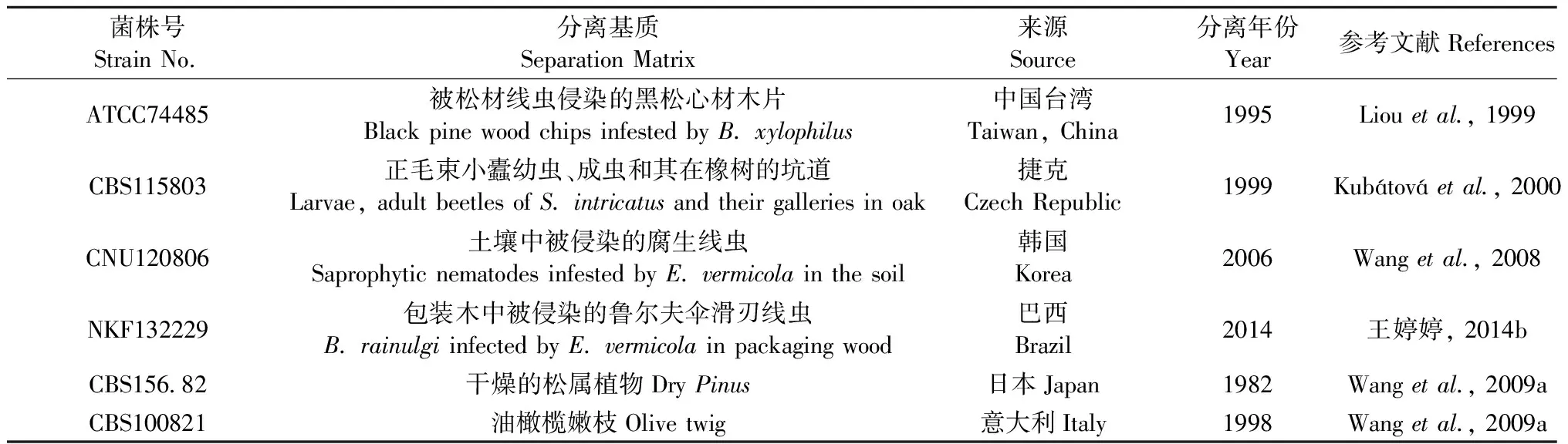
表1 伊氏线虫菌的6个分离株的详细信息Tab.1 Details on the six E. vermicola isolates available to date

表2 4个E. vermicola菌株的形态特征比较Tab.2 Comparison of morphological characteristics of 4 E. vermicola strains
3 侵染机制
3.1 孢子萌发方式
不同菌株伊氏线虫菌的孢子萌发方式不同(表2)。伊氏线虫菌在固体培养基中培养时,月形孢子一般从孢子凹面中间处萌发并产生1个或多个芽管,接着芽管分枝形成营养菌丝,但有时月形包子也会在孢子凸面中间处萌发。杆状孢子一般从孢子1/3~1/2处萌发并可产生1到多个芽管,但有时杆状孢子也会从孢子端部萌发,其与钩丝孢属真菌产生的附着胞相似。伊氏线虫菌在PDB液体培养基中培养时,会产生圆形、卵形或长椭圆形等不同形态的芽生孢子。芽生孢子出芽方式多变,可以再萌发产生芽孢,或者发芽后形成细长的柄,在柄上产生黏性孢子; 也可以萌发产生其他芽孢后,通过分化产生瓶梗状产孢细胞和黏性孢子; 还可以1个芽胞2边发芽形成2种产孢细胞并着生不同的分生孢子。在WA培养基上接种液体培养产生的芽生孢子会直接在芽孢上产生可黏附线虫的黏性孢子或者继续出芽聚集形成芽孢堆; 有些芽生孢子会发芽萌发延伸为菌丝并着生着瓶梗,于瓶梗上产生黏性孢子(曾显雄, 2003)。目前,可通过中性红和亚甲蓝的混合物对孢子进行染色来快速评估伊氏线虫菌分生孢子的活性,染色后活细胞中的细胞质呈红色,细胞壁呈蓝色染色,而死细胞的细胞质呈蓝色(Wangetal., 2014b)。
3.2 孢子黏附侵染机制
伊氏线虫菌侵染松材线虫的过程和机制: 线虫在菌落中游走时碰到月形孢子凹面,月形孢子立即黏附于线虫体表,并从产孢梗上脱落,随着线虫移动。月形孢子以凹面随机黏附到线虫体表任何部位,但分布最多的是线虫头部,然后是尾端,最少的是线虫身体中部。月形孢子黏附线虫体表16~24 h后,从孢子状构造处开始分化产生侵入钉,穿透黏着层压迫线虫体壁,接着侵入钉穿透线虫体壁的角质层及肌肉层,逐渐膨大形成菌丝体释放到线虫体内。之后,菌丝体吸取线虫细胞营养生长,形成同化菌丝,并产生分支,在线虫体内蔓延生长。随着菌丝的生长,线虫移动减慢,活性降低,黏着48 h后,菌丝挤破线虫体壁向外长出,3~4天后的菌丝开始生长、分枝并蔓延,6天后长出的菌丝开始产孢进行2次生长,在室温下8~10天伊氏线虫菌就彻底消解线虫(曾显雄, 2003; Liouetal., 1999; 杜婷, 2013; 杜婷等, 2014; 王婷婷, 2014b)。
不同伊氏线虫菌菌株对松材线虫的侵染过程相同,但侵染能力却有较大差别,其中CBS115803对松材线虫的侵染力最高,CBS115803菌株孢子仍着生于产抱梗上时,接种线虫24 h后,孢子黏附率达100%,4天后线虫死亡率达100%,ATCC74485与CNU120806 对松材线虫的侵染力较低(Wangetal., 2008; 2009a; 杜婷, 2013; 杜婷等, 2014; 黄海华等, 2016)。分生孢子脱离产孢梗后,其对线虫的黏附率和死亡率都显著降低,所以其致病力也会相应下降; 在1×106、1×107、1×108和1×109个·mL-1的4个孢子浓度对线虫的作用中,孢子对线虫侵染能力随着孢子浓度的降低而降低(杜婷, 2013; 杜婷等, 2014)。
3.3 松材线虫与真菌之间的相互关系
伊氏线虫菌可以产生吸引松材线虫的挥发性和非挥发性化合物。挥发性吸引物质由活菌丝体产生,可以扩散到周围空气中以将远端分离的线虫吸引到真菌附近,再将其吸引黏附到分生孢子上(Wangetal., 2009b; 2010a)。通过紫外线照射后,真菌死亡,无法产生吸引线虫的物质,所以不再吸引线虫(Wangetal., 2010a)。伊氏线虫菌的活菌丝体不仅对琼脂平板上的松材线虫有吸引力,还对接种线虫15天和30天的松苗里的松材线虫以及发病枯萎松树中的松材线虫都有强烈的吸引作用。在松材线虫病初期,松树体内松材线虫数量较少,线虫主要受松树组织释放的物质吸引; 随着松材线虫数量的增加,松材线虫病进入第2阶段,松树吸引松材线虫的物质产量减少,此时伊氏线虫菌对松材线虫的吸引力相对增加; 最后,松树衰弱逐渐死亡,松树对松材线虫的吸引力减弱或消失,而伊氏线虫菌表现出对松材线虫具有较高吸引力(Wangetal., 2009b)。伊氏线虫菌能够在松树分泌的树脂和其他化学物质中存活,并用月形孢子繁殖侵染其他在寄主树中移动的松材线虫(Wangetal., 2011a)。
从伊氏线虫菌活菌丝体产生的挥发性物质中,鉴定了3种吸引松材线虫的物质,分别为α-蒎烯、β-蒎烯和樟脑,比例约为28∶12∶1,使用α-蒎烯、β-蒎烯和樟脑吸引松材线虫的最小剂量分别为50、12、1.6 ng(Linetal., 2013)。其中化合物α-蒎烯和β-蒎烯也是松褐天牛的幼虫和成虫及其寄主马尾松和垂死黑松的挥发性有机物组分(Takeuchietal., 2006; Fanetal., 2007; Zhaoetal., 2007; Aikawaetal., 2008)。α-蒎烯、β-蒎烯和樟脑对松材线虫有较强的吸引力,樟脑在被松材线虫感染的松树生物测定中显示出对松材线虫的吸引力显著增加(Yunetal., 2012)。因此Lin等(2013)认为伊氏线虫菌采取了宿主欺骗,其通过产生模拟松材线虫宿主松树的香味(α-蒎烯、β-蒎烯和樟脑)而引诱松材线虫吸取营养,然而,只有这3种成分已被确定,可能还有一些活性挥发物被忽略,同时还需要进一步确定伊氏线虫菌非挥发性化合物成分。
松材线虫为伊氏线虫菌提供营养,同时松材线虫也能以伊氏线虫菌的菌丝体为食。线虫代谢物和匀浆物都能刺激和促进伊氏线虫菌生长,但线虫代谢物的影响略高于线虫匀浆物,线虫挥发物对伊氏线虫菌的生长没有影响,但是松材线虫能够增强伊氏线虫菌的孢子形成(Wangetal., 2010b; Wangetal., 2015a)。
3.4 对其他寄主的研究
伊氏线虫菌作为一种线虫内寄生真菌,不仅能够通过侵染杀死松材线虫,还可以侵染多种其他线虫(表3)。不同菌株对不同线虫表现出的侵染性不同,与松材线虫相比,CNU 120806对全齿复活线虫(P.redivivusl)侵染性更高(Wangetal., 2008)。NKF13222对于松材线虫的的侵染性最高,其次为拟松材线虫,最低的是水稻干尖线虫(Aphelenchoidesbessyi)(Kubátováetal., 2000; 王婷婷等, 2014a)。伊氏线虫菌感染性依赖于线虫种类而变化,但目前这种机制尚不清楚,但是这种寄生线虫-寄主关系可能为除松材线虫以外的其他种类的线虫,特别是一些重要的植物寄生线虫提供了一种生物防治的途径,此外可以用更多的线虫物种评估伊氏线虫菌的感染性,以发现更多可能的宿主并扩大应用。
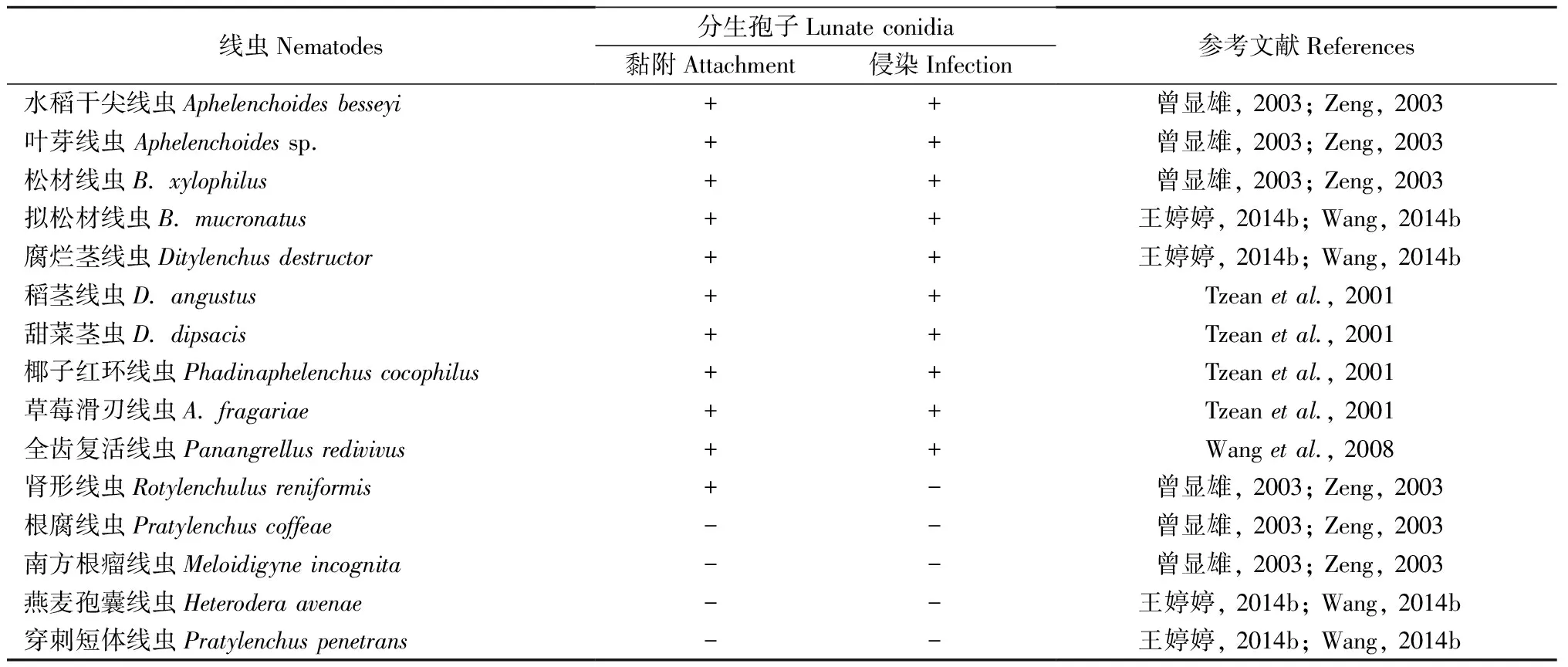
表3 伊氏线虫菌对不同线虫的黏附和侵染①Tab.3 Differential response of nematodes to the attachment and infection by lunate conidia of E. vermicola
①+: 黏附或侵染Attachment or infection -: 不黏附或侵染No attachment or infection.
4 培养条件对伊氏线虫菌生长、产孢和孢子侵染活力的影响
4.1 营养条件
营养和环境因素决定了伊氏线虫菌的生长和孢子形成,从而影响其对宿主线虫的感染力。营养对不同伊氏线虫菌菌株生长和产孢的影响是不同的(表2)(Liouetal., 1999; Wangetal., 2008; Wangetal., 2014a)。伊氏线虫菌在营养丰富的固体培养基中培养,其孢子表现出对线虫有较强的侵染力(杜婷等, 2015)。在营养丰富的PDA培养基中菌株NK13222生长速度较快,8天后菌落直径为3.2~3.5 cm,菌丝浓密,外围新鲜的菌丝呈白色,孢子量多,但大部分为杆状孢子,月形孢子非常少。菌株NK13222在营养较弱的CMA培养基中生长速度与PDA培养基无明显差异,但其菌丝稀少,孢子较多,但杆状孢子居多。菌株NK13222在营养较弱的WA培养基中生长速度非常缓慢,8天后的菌落直径约为2.3 cm,菌丝稀少呈白色絮状,孢子量较少,但大部分为月形孢子,杆状孢子较少。所以在菌株扩繁时可选择营养丰富的PDA培养基,而在需要获得较多月形黏性孢子时可选择营养条件最弱的WA培养基(王婷婷, 2014b; Wangetal., 2014a)。在另一个试验中也显示了同样的结果,伊氏线虫菌在PDA培养基(高碳源)上生长和产孢能力最强,但是月形孢子的比例和线虫侵染力最低,而WA培养基(无营养)上月形孢子比例和线虫侵染力最高(王海华等, 2016)。
4.2 碳浓度、碳氮比和碳氮源
碳浓度、碳氮比和碳氮源的不同对伊氏线虫菌菌丝生长和产孢有不同的影响。碳浓度为12 g·L-1、碳氮比为40∶1时,孢子产量最高; 碳浓度为12 g·L-1,碳氮比为5∶1时,菌丝生物量最高,在培养第7天时菌丝体达到最大值,第11天时孢子产量最高(杜婷等, 2015)。补充甘氨酸和L-亮氨酸作为氮源对菌落的生长速率有显着影响,使菌落干质量比硝酸铵和对照增加5倍。硝酸铵和L-亮氨酸作为氮源可以促进孢子形成,产生超过6×106CFU·g-1,但以甘氨酸作为氮源提高了月形孢子的比例。同时,氮源的补充对松材线虫黏附率和死亡率有显着影响(Wangetal., 2011b)。菌株NKF13222的产孢量与不同的碳氮源和碳氮比之间有很大关系,碳氮源为SA(C:蔗糖;N:硫酸铵)、SP(C:蔗糖;N:蛋白酪)和GIY(C:葡萄糖;N:酵母提取物)组合的孢子量明显低于GaA(C:半乳糖;N:硫酸铵)和GaP(C:半乳糖;N:蛋白酪)的组合中孢子量; 在PDB(无氮源)培养基中培养时,其产孢量均低于以上处理; 在GaA和SA组合中,C∶N=10∶1时,其产孢量最大,但当C∶N=1: 10时,则都没有孢子产生; 在SP和GIY组合中,孢子量随着碳氮比降低而增加; 最适合菌株NK13222产孢的液体培养为GaP组合,C∶N=100∶1,产孢量达到最多,为8.52×108个·mL-1。菌株NKF13222对糖浓度的要求不高,在低糖浓度和高糖浓度下菌株的生长差异不明显,糖浓度为20 g·L-1时菌株的菌落直径最大(王婷婷, 2014b; Wangetal., 2014a)。
4.3 矿物盐和过氧化氢
添加矿物盐和过氧化氢对伊氏线虫菌的生长、产孢和侵染活性的有明显影响。在氯化物盐(KCl、CaCl2、MgCl2、FeCl2和FeCl3)和钙盐(CaCl2、CaCO3和CaSO4)8种矿物盐中,0.4%~0.6%的CaCl2对伊氏线虫菌的生长速度和孢子形成起到最大的增强作用,对松材线虫的黏附率和侵染率最高,但是CaCO3产生的月形孢子比例最高(Wangetal., 2011c)。在过氧化氢浓度1.65 mmol·L-1、处理时间9.40 min、碳氮比=9∶1的条件下,产孢量为(2.048 ±0.053)×109个·g-1最高,是对照的12倍(Xueetal., 2014a)。另外,将孢子与40%的甘油在真空条件下混合置于4 ℃下保存30天后,孢子仍能萌发且萌发率高于其他处理(杜婷, 2013)。
4.4 pH值
菌株在弱酸或弱碱条件下均能很好生长,但超过一定的pH值,菌落生长会受到抑制。在pH为5的PDA培养基中伊氏线虫菌的直径和干质量在15天后增加,而在pH为9和10的PDA培养基中伊氏线虫菌的直径和干质量受到抑制。在pH为6的PDA或PDB中伊氏线虫菌的孢子形成量最高,分别为2.0×107和1.4×107CFU·mL-1。在pH为4的PDA培养基中的月形孢子比例最高,而在pH为7的PDB培养基中的月形孢子比例最高(Wangetal., 2013)。菌株NKF13222在pH为4.5~10.5范围内可生长,最适生长pH为4.5~8.5;当pH>9.5时,菌株生长速度明显减缓,当pH为11.5时,菌株停止生长。在pH为6.5时,8天后菌落直径最大,为4.33 cm(王婷婷, 2014b; Wangetal., 2014a)。
4.5 温度等其他因素
不同温度和波动温度培养都对伊氏线虫菌的生长产生影响。伊氏线虫菌最适生长温度为25~26℃,在此温度下,其生长速度最快,分生孢子萌发率最高。在10和15 ℃下,菌丝生长8天后菌落直径小于1 cm,生长速度十分缓慢; 在20和25 ℃下菌丝加速生长,在25℃下菌丝生长8天后菌落直径达4.4 cm,生长速度最快; 25~26 ℃之后,菌丝生长速度随着温度升高而降低,在30 ℃和20 ℃下菌株生长速度无明显差异,但当温度升高到35 ℃后,菌株不生长(Kubátováetal., 2000; Xueetal., 2013a; 王婷婷, 2014b; Wangetal., 2014a; Wangetal., 2015b)。干燥条件使伊氏线虫菌孢子含水量降低,而影响其萌发,在干燥条件下其孢子萌发能力与保存的时间呈负相关,孢子在干燥条件下保存48 h后就会完全失活,但如果孢子含水量保持在40%以上,其萌发率就能维持在80%左右(杜婷, 2013)。菌株NKF13222在全黑暗条件下菌株长势良好,菌丝旺盛,而光暗交替或全光照条件都不利于菌株的生长,菌丝生长速度降低,菌株长势较弱,全光照条件时菌株生长最慢(王婷婷, 2014b; Wangetal., 2014a)。
5 伊氏线虫菌的抗性
众所周知,诸如风、雨、紫外线辐射,高温和干旱等环境压力是影响生物防治剂在田间或野外建立和生存的障碍。添加甘氨酸或黄芩(Scutellariabaicalensis)、鱼腥草(Houttuyniacordata)和铁皮石斛(Dendrobiumofficinale)提取物可以极大地提高伊氏线虫菌对热、紫外线辐射和干旱胁迫的抗性(Wangetal., 2011b; Xueetal., 2013b)。它们之所以有促进效应,一个可能的原因是热休克蛋白表达和海藻糖合成的上调,另一个可能与细胞内糖醇和糖含量的适应有关(Xueetal., 2013a)。在较低温度下伊氏线虫菌表现出更好的生长,对干燥、紫外线和过氧化氢胁迫的耐受性更强,并且过氧化氢酶表达增加。但是,低温培养表现出比高温培养更弱的热应激耐受性和更低的超氧化物歧化酶表达。在20~30 ℃温度波动下培养的伊氏线虫菌表现出最佳性能。因此,对于实际生产应用而言,这种微弱的波动、温和的温度对于伊氏线虫菌的产量和胁迫耐受性会更好(Wangetal., 2015b)。
6 伊氏线虫菌分子生物学研究
近几年来,对于伊氏线虫菌分子生物学层面的研究增多。伊氏线虫菌基因组(34.2 Mbp)已被完整测序,其中扩展的转运蛋白家族和endo-beta-glucanase意味着伊氏线虫菌在扰乱线虫代谢和寄生行为方面具有很大的遗传潜力(王瑞珍, 2017; Wangetal., 2018a)。菌株CBS 115803的完整线粒体基因组通过PacBio RS II测序技术完成测序,环状分子长度为47 282 bp,GC含量为24.85%。注释的基因包括14个保守的蛋白质编码基因,1个大的和1个小的rRNA亚基(rnl和rns)以及27个tRNA,通过对线粒体基因组序列的系统发育分析,发现伊氏线虫菌与Sporothrix属有较近的亲缘关系(王瑞珍, 2017; Wangetal., 2017a)。同时在菌株CBS100821、ATCC74485、CBS115803和CUN120806细胞内发现存在内生细菌,该内生细菌隶属于γ-变形菌门(Gammaproteobacteria),球状,细胞直径在50 nm~2 μm之间,细胞壁厚度、细胞大小和繁殖程度在细菌生长的前期和后期不同。该细菌与伊氏线虫菌之间存在紧密的共生关系,目前还不可人工培养,对于该细菌的研究将有助于揭示内生细菌在伊氏线虫菌宿主进化和生态学作用,该研究还需要进一步进行(王瑞珍, 2017)。
伊氏线虫菌被报道时间不长,所以对其分子层面的侵染机制还在不断探索。目前,一个对松材线虫具有强毒力的丝氨酸蛋白酶基因Evsp(GenBank登录号KP698922)从菌株NKF13222被克隆出来。Evspcontains的全长cDNA含有一个165 602 bp的ORF,编码一个含有551个氨基酸的蛋白质。基因组Evsp包括由内含子(20 702 bp)分开的2个外显子(39 602 bp和126 002 bp),真菌基因组中只有一个Evspgene拷贝。其与枯草溶菌素丝氨酸蛋白酶中的催化结构域高度同源。通过基于丝氨酸蛋白酶氨基酸序列的系统发育分析发现,伊氏线虫菌与内寄生真菌、昆虫病原真菌、产毒真菌及机会真菌有着较近的亲缘。丝氨酸蛋白酶rEvsp能降解并破坏松材线虫体壁,其可能在伊氏线虫菌对松材线虫侵染过程中起到重要作用。将约3.6 kb的线性融合片段转化进伊氏线虫菌得到基因缺失突变体菌株ES84,其和野生型菌株NKF13222对松材线虫的黏附率和侵染率差异不显著,可能是伊氏线虫菌的丝氨酸蛋白酶rEvsp在基因功能上存在冗余性(张龙, 2015; Wangetal., 2015c)。
在野外试验中,仅通过显微镜观察检查伊氏线虫菌是非常不方便和低效的,并且无法将月形孢子和其他真菌的菌丝体区分开来。最近,将FTA-DNA提取和PCR扩增结合起来,通过存在176 bp特异性片段从环境中检测伊氏线虫菌是一种简单易行的方法。基于伊氏线虫菌的几丁质酶基因设计的引物(上游5′-GTGCCTCTACCAAG ACTCGC-3′;下游5′-CGCCAAATGTCAAGATCCGC-3′)表现出优异的特异性,高灵敏度和效率,该方法为后续的研究提供了重要的技术支持。理论上,只要样品含有的伊氏线虫菌菌丝体或分生孢子,它们就可以被有效地检测到(魏柯, 2014; Weietal., 2014)。
7 在松材线虫病防治中应用
7.1 制剂剂型
如运用伊氏线虫菌进行林间防治松材线虫病,就要将其研制成为一种适应野外生存条件,具有长保质期的制剂剂型。采用4%脱脂牛奶、0.2%腐植酸、5%山梨醇、0.05% CaCl2、延展剂和抗生素配方制成的孢制剂,在不利的环境条件下能对真菌孢子起到最有效的保护作用,并能提高该种真菌孢子应对多种环境胁迫时的抵抗力和对线虫的致死率(Wangetal., 2012)。将伊氏线虫菌加入2%海藻酸钠和5%粘土制成的伊氏线虫菌藻酸盐 - 黏土制剂,是一种非真空包装的制剂,在4℃中保存其孢子活力最强,而且能有效延长伊氏线虫菌的保质期。添加了15%甘油、0.5%酵母提取物和0.5%草药提取物制备的3种分生孢子制剂的保质期也显著延长(Xueetal., 2014b)。将10%高岭土、0.1%司盘80、1%阿拉伯糖、5%山梨糖醇和5%PEG8000掺入海藻酸钙凝胶胶囊中在-70 ℃保存1个月,伊氏线虫菌分生孢子还保持较高的生存力(Wangetal., 2016)。用珍珠岩作为真菌载体保存于液氮中,2天和1年后其均能保持原来的生长,且其微生物形态未被改变(Homolkaetal., 2007)。
7.2 使用方法
伊氏线虫菌具有很高的开发为一种防治松材线虫病生物农药的潜力。在温室和野外采用树干注射、树冠喷洒和伤口接种等不同方法施用含有该真菌的生防菌,均能降低松材线虫对松树的侵染,还在用该菌处理过的松树中发现该菌菌丝、孢子和被月形孢子侵染的松材线虫(Wangetal., 2011a; Wangetal., 2011b)。
树干注射: 温室试验和2年的林间试验发现接种的伊氏线虫菌可以在松树内生长繁殖并不断侵染松树内的松材线虫,可在4~5天内杀死几乎所有测试的松材线虫(Sungetal., 2010)。用300 μL和40 mL 伊氏线虫菌分生孢子悬浮液(109个·mL-1)注射接种松树幼苗和大树,所有处理过的松树都是健康的。此外,在木片上未观察到由该真菌引起的坏死或变色(Wangetal., 2011d)。
树冠喷洒: 伊氏线虫菌喷洒处理显著提高了被松材线虫感染的松树幼苗的存活率。将3×108和3×106个·mL-1的伊氏线虫菌分生孢子悬浮液喷洒在将要死亡的赤松(Pinusdensiflora)上,2个月后线虫密度分别下降约79%和47%。同时,在接种松材线虫前1个月将真菌喷洒到4年生松树幼苗上时,幼苗的存活指数达到0.67,而没有真菌喷洒的对照幼苗仅为0.067,并且在经过处理的木材部分中观察到伊氏线虫菌感染的线虫和菌丝(Wangetal., 2011a)。在另一试验中,喷洒了107cfu·mL-1伊氏线虫菌的植物比未处理的松树幼苗的存活率高73.0%。在线虫感染前14天用107cfu·mL-1伊氏线虫菌处理松树幼苗,其存活率提高了90.0%。从喷洒了伊氏线虫菌的死松幼苗中分离的松木线虫的数量比对照中的松材线虫数量少76%。此外,在死亡或枯萎的松树幼苗中可以检测到被伊氏线虫菌感染的线虫和菌丝(Wangetal., 2017b)。
伤口接种: 将被月形孢子黏附的松材线虫(40%)悬浮液接种至赤松松苗上并置于温室培养,镜检发现幼苗枝条木段组织中有被染成蓝色的线虫和菌丝,在木段切片中还发现了正常线虫,有的线虫体表还能看到月形孢子和菌丝,偶尔能看到菌丝和月形孢子分散在木段切片中(Zhaoetal., 2007)。在韩国晋州经过长达6年的林间试验中,松树在人工接种松材线虫(PWN)感染前用伊氏线虫菌处理,30%以上的树存活6年,未经过伊氏线虫菌处理的树全部死亡。同时,在6年后可以在处理过的松树内部检测到伊氏线虫菌的存在(Wangetal., 2018b)。
8 展望
松材线虫病是一种能造成松林成片毁灭的流行性病害,严重破坏了疫区生态系统,造成了巨大的经济损失,控制松材线虫病的传染和制定防治策略极为重要。伊氏线虫菌作为一种松材线虫的内寄生真菌,从自然界中分离,无毒,寄主范围较小,不影响其他生物的生存,而且其能在松树中存活,并用月形孢子繁殖寄生其他移动的松材线虫,具有作为一种真菌剂制防治松材线虫病的潜力(Wangetal., 2011d)。除真菌伊氏线虫菌外,松材线虫的生防微生物有食线虫真菌、细菌和放线菌等。目前已经有野外试验证明对松材线虫病防治有效的生防微生物除了伊氏线虫菌之外还有Smal-007(韩正敏等, 2013; 南京林业大学, 2014)。Smal-007是从美国松材线虫体表分离筛选到的一株嗜麦芽窄食单菌(Stenotrophomnasmaltophilia),该菌致病力弱、定殖和替代能力强、对环境安全无毒(曾腓力等, 2012; 贲爱玲等, 2013)。在福建三明市等地小面积的林间防治试验取得良好结果,但在喷洒该细菌后要保持48 h无雨,因为降雨会影响细菌的定殖(姚伍等, 2018)。Smal-007只能降低松材线虫的致病力,并不能直接杀死线虫,而伊氏线虫菌是内寄生于松材线虫体内,可杀死松材线虫,2种生防菌的防治机制不同。
本实验室对真菌伊氏线虫菌野外防治松材线虫病做了初步研究。设置了A、B、C和D4组试验,研究了利用伊氏线虫菌孢子悬浮液来预防松材线虫病的可行性。3组试验分别为先喷洒孢子悬浮液和1周后接入松材线虫(A处理),喷洒孢子悬浮液的同时接入松材线虫(B处理),先接入松材线虫和1周后喷洒孢子悬浮液(C处理),只接线虫不喷孢子悬浮液(D处理,对照);线虫接入量为每棵树1 000头,孢子悬浮液浓度为1×108个·mL-1,接入量为每棵10 mL。试验结果表明A组在接种完线虫的第2个月开始出现枯萎症状,比其他处理表现出症状要更缓、更少。A、B和C不同处理对线虫的侵染活力上存在差异,D组大部分松树遭到了严重的为害,表现出松针变黄、大部分枯萎和死亡。初步证明运用伊氏线虫菌孢子悬浮液来预防松材线虫病具有一定的可行性,但是最佳预防时间等其他的条件还需要进一步的试验研究。除上述试验外,本实验室还对松褐天牛与真菌伊氏线虫菌的相互作用关系进行了初步试验。设置了天牛取食的松树枝喷洒孢子悬浮液和天牛浸泡孢子悬浮液再取食松树枝2个初步试验,研究伊氏线虫菌是否可以通过松褐天牛取食松枝的伤口进入松树内。结果表明这2个处理间差异不显著,但随着时间的延长,直接喷洒在树枝上的孢子侵染的能力相对要强。
综上所述,喷洒伊氏线虫菌孢子悬浮液能在一定程度上保护松树,尽管效果没有化学药剂快,但该菌是一种非常有潜力的可用于防治松材线虫的天敌。目前对伊氏线虫菌的生物防治研究还在初期阶段,林间的推广应用要考虑坏境和气候等多方面的因素的综合影响。尽管在试验中伊氏线虫菌有明显的致死松材线虫的效果,但松材线虫病是松树、病原松材线虫、媒介松褐天牛、真菌等微生物、各种环境和气候条件之间复杂的相互作用造成的,伊氏线虫菌侵染松材线虫的效力会受到这种复杂性的影响。因此还需要大量的研究来进一步推进该菌的应用,下一步应该增加林间防治试验的研究,探明防治的最佳条件,如防治时间,防治次数和剂量等,形成一套完整的防治方案。同时,目前关于伊氏线虫菌的研究主要集中在其与松材线虫之间。松褐天牛作为松材线虫的携带者,是松材线虫病的传播媒介,其与伊氏线虫菌之间的关系也值得深入研究,可为松褐天牛与伊氏线虫菌相结合防治松材线虫病提供基础。

