中国东部沿海中小型河流鱼类的整体遗传多样性评价
——以曹娥江为例
任 岗 宣鑫玲 谢亚婷 李碧莹 陈 旻 蔡亚军 沈文英
(1. 绍兴文理学院生命科学学院, 绍兴 312000; 2. 绍兴市水政渔业执法局, 绍兴 312000)
中国东部除长江、淮河、闽江等大型河流外多为流域面积小、水位落差大、干流长度短、地表径流大的中小型河流, 如曹娥江、甬江、九龙江等。由于处于经济社会发达地区, 水利设施阻隔、水体污染、过度捕捞等因素对河流水生生物特别是鱼类的生境造成了较大的破坏, 生态系统较为脆弱[1,2]。物种遗传多样性是指物种内不同群体或同一群体内不同个体的遗传变异总和, 它是生物多样性的重要组成部分。遗传多样性水平不仅反映了一个物种的进化历史和潜力, 同时也体现了物种对不良生存环境条件的适应和抵抗能力[3]。开展研究鱼类遗传多样性不仅有助于了解鱼类物种的起源、适应进化历程的遗传基础, 同时也为合理保护和开发利用鱼类资源提供科学依据[4]。然而, 目前已有的研究对中国东部中小型河流整个水系鱼类的遗传多样性水平缺乏整体的了解和评估; 同时对于水利工程建设、水体污染、过度捕捞等人为干扰因素对鱼类遗传多样性影响的研究仍多以单一鱼类种类为研究对象, 其影响程度缺乏全面科学的评估。
曹娥江是绍兴市的母亲河, 其自然地理、生物区系组成、遭受的外界环境胁迫等方面在东部中小河流中具有较好的代表性。本研究以曹娥江为例, 分析了来源于不同支流、江段21个种26个群体的代表性鱼类基于线粒体细胞色素b基因(Cytb)分子标记的遗传多样性水平, 并对河流鱼类整体的遗传多样性水平进行评估。同时, 本研究进一步探讨水利工程、过度捕捞和水体污染等人为干扰因素对曹娥江鱼类种群遗传多样性水平的影响, 以期更加全面客观的掌握造成目前曹娥江鱼类遗传多样性现状的可能原因, 为曹娥江乃至中国东部沿海河流的鱼类资源管理、保护和利用提供重要的理论依据。
1 材料与方法
1.1 材料
本研究于2018年5—9月选取曹娥江支流的镜岭、黄泽江段, 中下游仙岩、三界、上浦江段和河口的滨海共6个地点作为标本采集地(图1), 在当地渔民协助下利用流刺网和地笼进行鱼类样品采集。采集的全部鱼类样品活体或冷藏保存带回实验室进行分类鉴定。
1.2 鱼类种类鉴定及样品保存
鱼类样品的物种鉴定参考《浙江动物志: 淡水鱼类》、《中国鱼类系统检索》进行[5,6], 其食性类型和对环境的耐受性类型依据参考文献[6, 7]确定。每条鱼样品取背部肌肉用无水乙醇-20℃冷冻保存。每个物种及其不同地理群体尽可能取30—40尾个体。
1.3 组织及DNA提取
剪取80 mg鱼背部肌肉样品采用传统酚—氯仿法提取基因组DNA。
1.4 PCR扩增及测序
以线粒体细胞色素b基因(Cytb)作为分子标记,鲤科鱼类Cytb基因的PCR扩增采用通用引物L14724 和H15915[8], 鲈形目鱼类采用引物AFbL和AFbR[9]。对花䱻(Hemibarbus maculatus)等14种上述引物PCR扩增和测序失败或效果不佳的鱼类根据NCBI数据库中该物种线粒体全基因组序列用Primer Premier 6.0软件[10]设计引物(表1)。PCR反应体系和扩增程序参考何舜平等[11]。PCR产物经1%琼脂糖凝胶电泳检测后送ThermoFisher公司纯化并双向测序, 测序引物为扩增引物。

图1 曹娥江流域鱼类采样点(•代表采样点位置)Fig. 1 Sampling sites of fishes in Cao’s River (• represents sampling sites)
1.5 序列分析
测序获得的Cytb正反向序列用ContigExpress软件(版本号Vector NTI Suite 6.0, Invitrogen)进行拼接, 同一物种的序列用Clustal X 2.0软件[12]进行序列比对和校对, 并用Mega 7.0软件[13]计算序列的碱基组成。用DNASP4.10软件[14]计算多态性位点(S)、单倍型数(N)、单倍型多样性指数(h)和核苷酸多样性指数(π)。
1.6 数据分析
曹娥江不同采集江段间、不同环境耐受性类型间的鱼类种群体单倍型多样性指数(h)和核苷酸多样性指数(π) 结果均用“平均值±标准差”表示, 结果均用SPSS 20.0软件的单因素方差分析进行组间差异分析, 对总体方差差异显著的再用Duncan法进行多重比较, 显著差异水平为P<0.05。不同食性类型间、曹娥江与中国大型河流间鱼类种群单倍型多样性指数(h)和核苷酸多样性指数(π)均用SPSS 20.0软件的t检验进行组间差异分析, 显著差异水平为P<0.05。
2 结果与讨论
2.1 鱼类物种分布
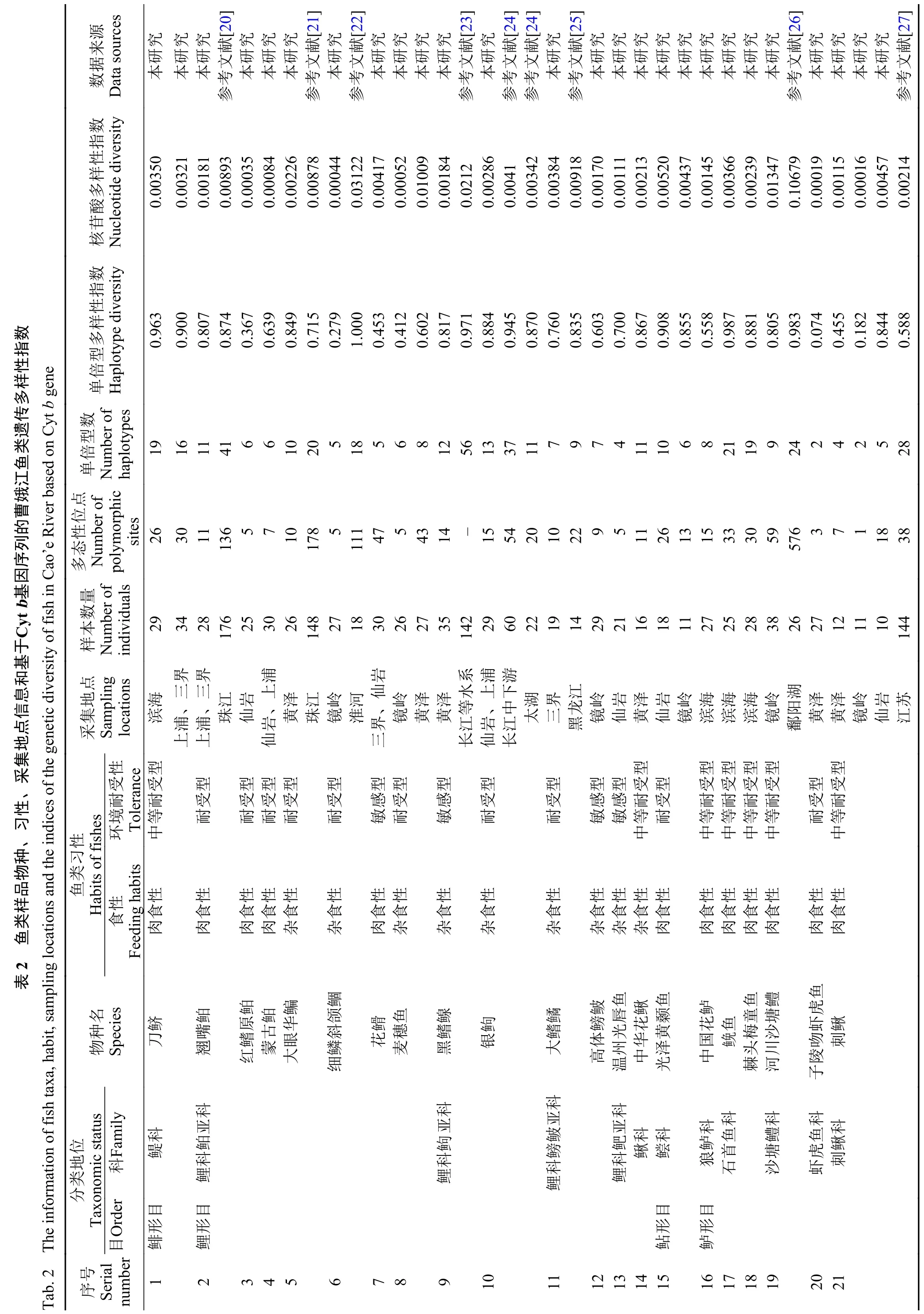
经鉴定共捕获鱼类6目17科57属87种。依据鱼类的分类地位、食性、生活习性和对环境的敏感性等特点及不同采样地点, 选取刀鲚(Coilia nasus)等代表性鱼类21个种26个群体, 分属5目9科属(表2)。
2.2 Cyt b基因序列变异特征
通过测序、拼接共获得21个物种26个群体全长1140 bp的Cytb序列638条。Mega 7.0软件分析序列碱基组成表明, 所有种类Cytb序列均表现出显著的G碱基偏倚性, A+T含量(平均55%)高于C+G含量(平均45%), 符合鱼类线粒体Cytb基因的共有特征[15]。
2.3 曹娥江鱼类整体遗传多样性水平
单倍型多样性指数(h)和核苷酸多样性指数(π)是评价物种遗传多样性的2个重要指标, 其数值越大表明该种群的遗传多样性越丰富, 对环境改变的适应能力越强, 其生存竞争力就越强[16]。对21种鱼的Cytb基因全长序列的单倍型和核苷酸变异数进行分析发现, 多态性位点数(S)为1—59, 单倍型数(N)为2—21, 单倍型多样性指数(h)为0.074—0.987,核苷酸多样性指数(π)为0.00016—0.01347(表2)。曹娥江鱼类种群的遗传多样性呈现单倍型多样性指数(h)较高而核苷酸多样性指数(π)较低的特征。这与我国东部河流淡水鱼类的种群相对数量大、分布广, 并且总体遗传多样性相对丰富的特征相一致[17]。
比较不同江段鱼类的遗传多样性指数发现, 从河口、中下游到上游鱼类群体单倍型多样性指数h显著降低(表3,P<0.05), 而核苷酸多样性指数π呈逐步增加的趋势。这一结果表明, 曹娥江水系鱼类的有效种群数量从河口到上游逐步降低, 种群变得更不稳定和脆弱[18]。因此, 在曹娥江鱼类资源的管理和保护工作中, 我们需要通过设立自然保护区、全面禁捕等更多措施来加强上游地区鱼类资源的保护, 增加鱼类种群的数量。
基于多个物种的鱼类遗传多样性分析能够更好的反应河流鱼类整体的资源状况。然而, 目前对中国东部中小型河流鱼类整体遗传多样性还缺乏相关的研究和评估。本研究选取翘嘴鲌(Culter alburnus)、红鳍原鲌(Chanodichthys erythropterus)、大眼华鳊(Sinibrama macrops)、细鳞斜颌鲴(Plagiognathops microlepis)、银(Squalidus argentatus)等9种曹娥江鱼类, 将其遗传多样性指数与长江中下游、淮河、珠江等大型河流同一种类的遗传多样性指数进行比较(表3)。结果发现, 曹娥江鱼类种群的核苷酸多样性指数水平显著低于大型河流鱼类种群(P<0.05, 表3), 表明与大型河流中的鱼类相比, 曹娥江整体的鱼类遗传多样性水平处于中等偏下水平, 其可能受到更大的生存胁迫压力,正在通过更快的核苷酸序列变异来适应不利的生境[19]。
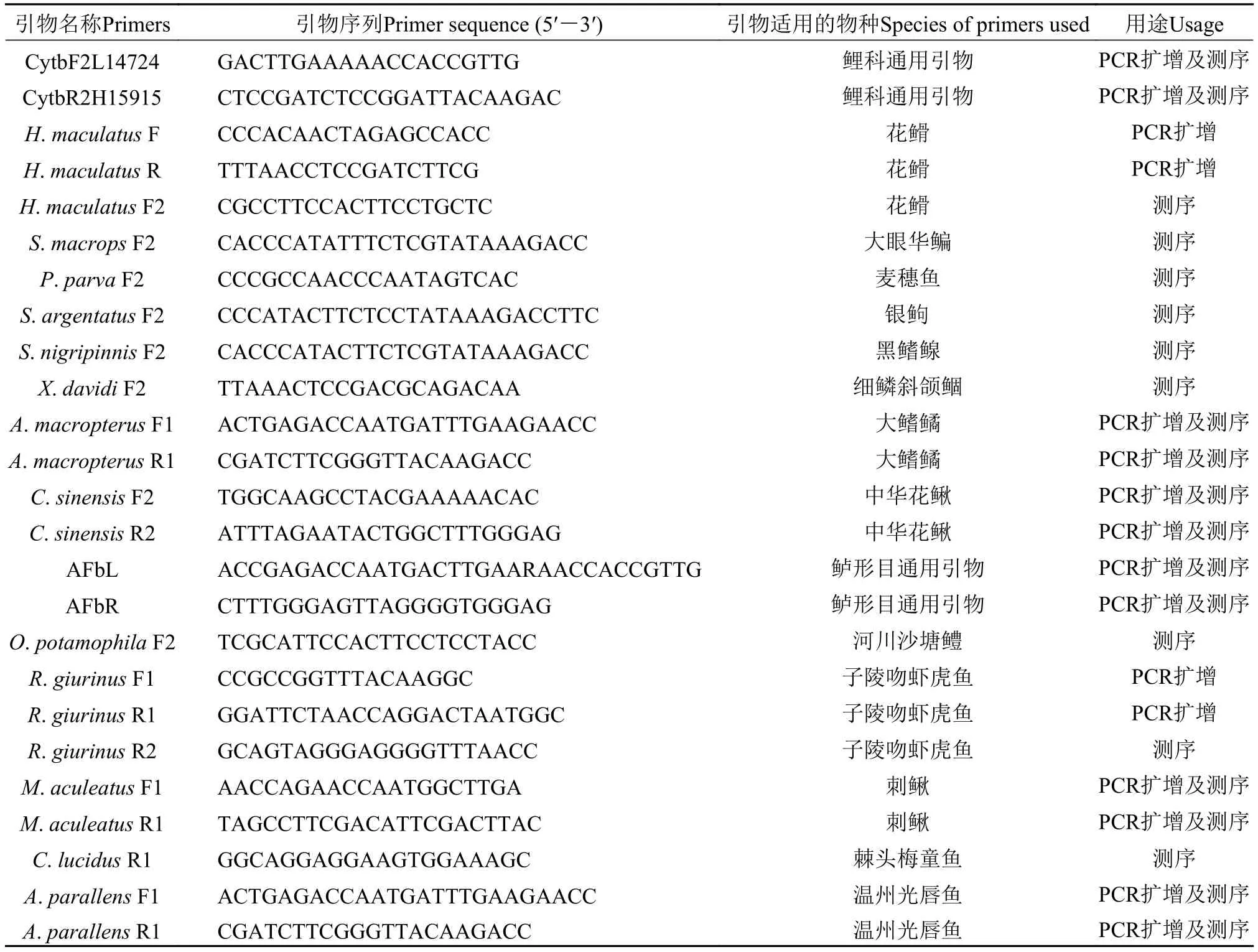
表1 本研究中鱼类线粒体细胞色素b基因的PCR扩增引物和PCR产物测序引物信息Tab. 1 The primers used for PCR and sequencing
2.4 人为干扰因素对曹娥江鱼类遗传多样性的影响
曹娥江等东部中小型河流处于经济社会发达地区, 其生态系统正遭受水利设施阻隔、水质污染、过度捕捞、栖息地破坏等人为干扰因素的巨大压力。这些人为干扰因素都可能会对曹娥江鱼类的遗传多样性产生重要的影响。
images/BZ_74_237_292_2242_3150.png
为了探究水利工程曹娥江大闸对鱼类遗传多样性的影响, 本文选取洄游型鱼类刀鲚为研究对象进行河口和内河两个地理群体遗传多样性差异分析。结果表明, 刀鲚内河上浦、三界种群单倍型多样性指数和核苷酸多样性指数水平(h=0.900,π=0.00321)略低于河口滨海种群(h=0.963,π=0.00350)。研究表明, 大型水利工程能够阻断鱼类等水生生物的洄游, 阻碍鱼类种群间的基因交流, 从而降低鱼类种群的遗传多样性水平[28—30]。本研究结果表明,尽管曹娥江大闸阻碍了刀鲚的洄游, 限制了内河群体数量的补充, 但由于大闸建设时间不长, 同时存在过鱼设施, 因此曹娥江内河刀鲚的种群遗传多样性水平得到了一定程度的维持。此外, 除了曹娥江大闸, 曹娥江干流和支流先后修建了多个拦水大坝、水库等水利设施。水利设施的建设使得河流水体的流速变缓、浮游生物增加, 促使部分植食性和杂食性鱼类数量增加, 而肉食性鱼类数量减少,进而影响鱼类的遗传多样性水平和结构[31]。比较曹娥江内河9种杂食性和9种肉食性鱼类之间的Cytb基因遗传多样性水平发现, 两者的单倍型多样性指数和核苷酸多样性指数均无显著差异(表3)。这一结果可能与同种食性的鱼类中不同物种对由水利设施引起的生境胁迫压力产生的遗传变异速度不同有关[32]。
水质条件是鱼类生存的关键因素。为掌握水质污染对曹娥江鱼类遗传多样性的影响, 本研究对来源于中游三界、上浦和仙岩江段不同环境耐受型鱼类的种群遗传多样性进行了分析。结果表明,花䱻等敏感型鱼类种群的单倍型多样性指数水平显著低于刺鳅等中等耐受型鱼类(表4,P<0.05)。从20世纪90年代后的近二十年间, 曹娥江中下游水域长期受医药化工、造纸等行业的重金属和持久性有机物等污染物污染, 致使水体环境持续恶化, 对鱼类生存造成了巨大的压力[33]。本研究结果提示, 曹娥江鱼类特别是敏感型鱼类遗传多样性的下降可能与水质污染引起的种群数量快速减少密切相关。因此, 开展水域水污染治理将对曹娥江鱼类种群数量的维持和遗传多样性的修复具有重要作用。
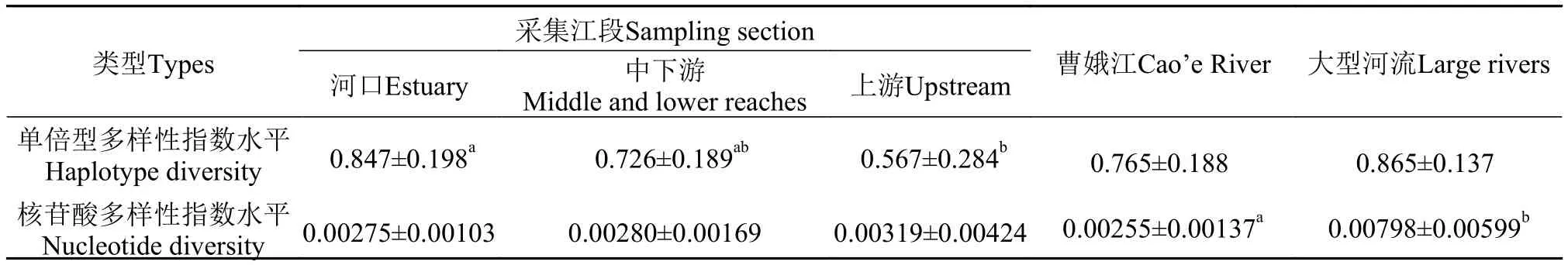
表3 基于Cyt b基因序列的曹娥江鱼类不同江段间、曹娥江与中国东部大型河流间鱼类遗传多样性差异比较Tab. 3 The genetic diversities based on Cyt b gene among the fishes from different sections of Cao’e River, and between the fishes from Cao’e River and from the large rivers in East China
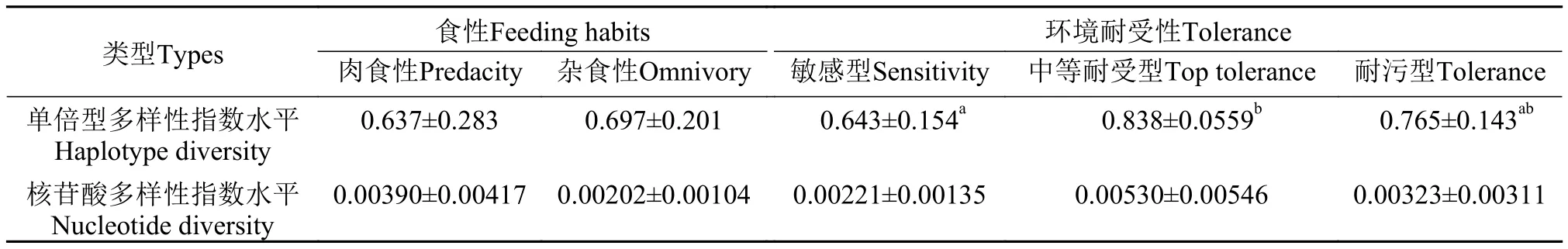
表4 基于Cyt b基因序列不同食性类型、环境耐受性类型的曹娥江鱼类遗传多样性差异比较Tab. 4 The difference of genetic diversity based on Cyt b gene in fishes from Cao’e River with different types of food habit, environmental tolerance
我们在采样调查中发现曹娥江上游镜岭江段存在不少电捕鱼的违法行为, 可能导致该江段鱼类资源被过度捕捞。为比较过度捕捞对曹娥江鱼类遗传多样性水平的影响, 本研究比较了麦穗鱼、光泽黄颡鱼和刺鳅3种鱼类在上游的镜岭和中游的仙岩两个地点种群间的遗传多样性差异。结果表明, 这3种鱼的镜岭群体的线粒体Cytb基因单倍型多样性指数和核苷酸多样性指数均低于仙岩群体(表3)。研究表明, 过度捕捞可能导致了水域鱼类资源的急剧减少, 促使种群内近交繁殖, 加速群体遗传漂变, 从而使流域内鱼类遗传多样性普遍降低[34]。因此, 上述结果提示, 过度捕捞可能是导致目前曹娥江上游鱼类种群遗传多样性水平较低的重要原因。
3 结论
本研究以中国东部沿海地区中小型河流代表曹娥江为例, 基于线粒体细胞色素b基因(Cytb)分子标记对其鱼类的整体遗传多样性进行了系统分析。结果表明, 与长江等大型河流相比, 曹娥江鱼类的整体遗传多样性处于中等偏下水平, 其生物多样性相对较为脆弱。进一步分析人为扰动因素对曹娥江鱼类遗传多样性水平的影响发现, 水体污染、过度捕捞可能是造成目前曹娥江鱼类遗传多样性水平较低的主要原因, 鱼类资源亟需通过水污染控制、全面禁渔和栖息地生态修复等有效措施进行保护。本研究结果将为曹娥江乃至东部中小河流的鱼类资源的管理、保护和开发利用提供了重要的理论依据。

