斑马鱼ftr56基因克隆表达及功能研究
邝 鸣 刘晥蒙 姚 健 霍诗天 刘学芹
(1. 华中农业大学水产学院, 武汉 430070; 2. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070; 3. 湖北省水生动物病害防控工程技术研究中心, 武汉 430070; 4. 水产养殖国家级实验教学示范中心, 武汉 430070)
天然免疫在机体抵抗病原体感染中发挥重要作用。细胞中天然免疫信号转导途径的激活受各种转录或翻译修饰以及翻译后修饰(包括磷酸化、乙酰化和泛素化)的调节[1]。TRIM蛋白参与许多细胞过程, 如发育过程, 肿瘤抑制和细胞周期调节。一些TRIM蛋白通过不同的机制与抗病毒防御相关,通常由I型IFN诱导或作为调节剂和增强剂对病毒感染作出反应[2]。在哺乳动物中, TRIM25在p53/Mdm2环中具有双重功能: TRIM25可增强p53/Mdm2的丰度, 也可抑制p53的转录活性并抑制对DNA损伤的反应[3]。人(Homo sapiens)TRIM11在肺癌中发挥重要作用, 其过表达促进肺癌细胞增殖、迁移和侵袭[4]。人TRIM56通过阻止病毒RNA合成来限制A型和B型流感病毒增殖[5]。除哺乳动物外,许多研究表明TRIM蛋白在鱼类抗病毒免疫系统中发挥重要作用。大黄鱼TRIM8通过调节促炎因子和干扰素信号传导发挥抗病毒作用[6]。石斑鱼TRIM 32和TRIM39可以抑制虹彩病毒和诺达病毒的复制[7,8], 并且一些鱼类TRIM蛋白在抗病毒信号传导途径中发挥负调节作用, 例如石斑鱼TRIM16负调控干扰素免疫反应并促进DNA病毒的复制[9]。石斑鱼TRIM62促进单股正链RNA (ssRNA)病毒石斑鱼神经坏死病毒(RGNNV)的复制[10]。
TRIM家族蛋白包含3个结构域, 1个RING结构域, 1个或2个B-box结构域和1个卷曲螺旋(Coiledcoil)结构域。此外还具有1个高度可变的C末端, 含有PRY / SPRY结构域, 也称为B30.2结构域或NHL结构域[11,12]。FinTRIM是在硬骨鱼类中发现的一个新的TRIM亚家族, 在病毒感染的虹鳟中被最先鉴定[13]。目前对于finTRIM在鱼类免疫系统中的作用研究较少。最近的研究表明, FTR36可以通过IFN途径激活免疫反应从而抑制SVCV的复制[14]。ftr83的过表达可以抑制IHNV、VHSV、SVCV的复制[15]。
鲤春病毒血症(Spring viremia of carp, SVC)是由SVCV引起的高死亡率的严重疾病, 属于弹状病毒科的鲤春病毒属的成员。SVCV是一种单股负链RNA(ssRNA)病毒, 编码五种病毒蛋白并导致水产养殖严重损失[16—18]。尽管SVCV在水产养殖中造成严重损害, 但对该病毒的致病机制还了解甚少,且目前尚无针对SVCV的疫苗[19]。
本研究克隆了斑马鱼ftr56, 对其进行生物信息学分析和真核表达载体的构建, 过表达后检测其对SVCV复制的影响, 为研究FinTRIM在天然免疫中的作用及机制提供依据。
1 材料与方法
1.1 主要试剂及仪器
主要试剂: M199和DMEM细胞基础培养液购自Hyclone, OPTI-MEM、青霉素-链霉素溶液、0.25% Trypsin-EDTA、胎牛血清(FBS)均购自Gibco公司, 结晶紫购自BIOSHARP公司, 甲基纤维素购自Sigma-Alrich公司, 转染试剂Fugene HD regeant购自Promega, ECL化学发光显色液购自武汉聚能译通生物有限公司, SVCV-G单克隆抗体为本实验室制备, 鼠源His单抗、兔源Actin多抗、HRP标记山羊抗鼠IgG、HRP标记山羊抗兔IgG购自于爱博泰克生物科技有限公司, 真核表达载体pcDNA4.0-His由本实验室保存, 2×TaqPCR Mix、反转录酶、限制性内切酶、DNA Marker、RNAiso Plus及PrimeScriptTMRT Reagent Kit with gDNA Eraser等购自Takara公司, 蛋白Marker及T4 DNA连接酶购自Thermo公司, DNA纯化回收试剂盒、质粒小量提取试剂盒购自OMEGA公司。
主要仪器: 核酸及蛋白凝胶电泳仪、凝胶成像仪为BioRad公司生产, 台式冷冻离心机(Eppendorf);Nanodrop 2000浓度定量仪、-80℃超低温冰箱为Thermo生产, 超净工作台、生物安全柜、生化培养箱(北京东联哈尔仪器制造有限公司), 二氧化碳恒温培养箱(日本三洋公司), 实时荧光定量PCR仪(Roche LightCycler® 480II), ECL化学发光仪(美国通用电器), 转膜仪(京六一仪器长), 恒温水浴锅(精宏), 二氧化碳恒温培养箱(日本三洋公司)。
1.2 细胞和病毒
SVCV毒株及FHM、ZF4细胞均为本实验室保存, 分别使用含有10%胎牛血清、和1%双抗(青霉素-链霉素各100 μg/mL)的M199、DMEM培养基中置于28℃, 5% CO2的恒温培养箱中培养。
1.3 克隆斑马鱼ftr 56 CDS区全长
根据实验说明书, 使用RNAiso Plus试剂提取斑马鱼脾的总RNA, 使用PrimeScript RT™试剂盒反转录获得相应cDNA。根据NCBI中斑马鱼ftr56 (序列号: XM_003200557.5)CDS序列设计引物ftr56-F和ftr56-R, 将PCR产物插入pcDNA4.0-His载体中,构建pcDNA4.0-FTR56-His质粒。KpnⅠ和XbaⅠ分别加入到上游引物和下游引物中。引物序列见表1。
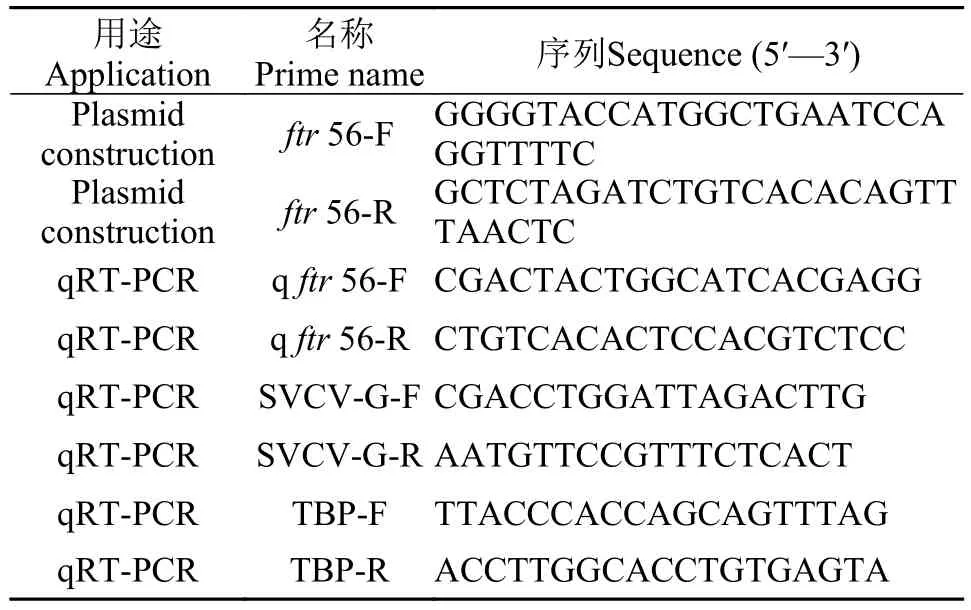
表1 引物列表Tab. 1 Primers list
1.4 序列分析
使用ClustalX2进行序列比对, 并使用ESPript 3.0(http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)呈现。所述系统进化树是基于FTR56的氨基酸序列使用邻接法(NJ)算法(MEGA版本5.1)构成。使用SMART(http://smart.embl-heidelberg.de/)对FTR56结构域的示意结构进行预测。
1.5 实时荧光定量PCR(qRT-PCR)
通过qRT-PCR检测FTR56 mRNA的表达变化,将长满单层的ZF4细胞按照106个/孔(6孔板)的密度均匀传代, 待细胞长至80%—90%时, 吸弃原培养基, 然后用PBS溶液轻微洗涤细胞1次, 按照5MOI SVCV感染剂量感染ZF4细胞, 28℃孵育1h后更换成细胞维持培养基, 置于细胞培养箱中继续培养,于6h、12h和24h用PBS洗三次, 收取细胞样, 提取RNA并反转录获得cDNA。根据SYBR Green Realtime PCR Master Mix试剂盒标准操作说明设置反应条件, 通过Light Cycler/Light Cycler 480 System(Roche)分析荧光信号。PCR条件如下: 95℃ 5min,然后40个循环的95℃ 15s, 60℃ 20s和72℃ 20s。qRT-PCR的所有引物如表1所示。通过使用2-ΔΔCt(其中Ct是阈值循环)方法将它们与相应的对照进行比较来计算相对倍数变化。进行三次独立实验以进行统计分析。
1.6 质粒转染和病毒感染
将培养的FHM细胞转接到6孔板。24h后显微镜下观察, 当细胞量铺满板底的80%—90%时使用FuGENE HD转染试剂转染。用2 μg的pcDNA4.0-FTR56质粒或pcDNA4.0质粒转染FHM细胞。在转染24h后, 吸弃原培养基, 然后用PBS溶液轻微洗涤细1次, 按照0.05MOI SVCV感染剂量感染FHM细胞, 28℃孵育1h后更换成细胞维持培养基, 置于细胞培养箱中继续培养。在感染后6h、12h和24h后收集上清液用于测定病毒滴度, 收取细胞用于qRTPCR和蛋白免疫印记。
1.7 蛋白免疫印记(Western blot)
用RIPA裂解缓冲液处理细胞, 之后进行SDSPAGE电泳后将样品转移到聚偏二氟乙烯膜(PVDF)上。在室温下用5%脱脂乳封闭1h后, 将膜与小鼠抗His抗体(1:1000稀释)或小鼠抗SVCV-G (实验室制备和保存)2h, 兔抗-β-Actin抗体(1:10000稀释)用作对照, 用TBST洗涤三次后, 然后用辣根过氧化物酶(HRP)偶联的二抗(1:2000稀释)孵育45min, 使用化学发光底物和ECL化学发光仪进行检测。
1.8 空斑实验
将FHM细胞接入12孔板, 20h后单层细胞铺满底壁。用无血清DMEM洗涤两遍。10倍梯度稀释病毒, 每孔加入500 μL已稀释的病毒液, 每个浓度级做三孔重复。病毒吸附1h后, 除去感染培养基,在28℃下用含有5%FBS和1.5%羧甲基纤维素的M199培养基覆盖。在第60h, 将细胞用10%甲醛固定过夜(10—12h)并用0.5%结晶紫染色3h时, 读数并计算。
1.9 统计学处理
所有相关实验至少进行三次, 结果相似。使用Prism 6(GraphPad软件)展示统计数据。结果表示为平均值±SDM。使用双向ANOVA比较数据。对于所有比对,P<0.05被认为是显着的并且用*标记,P<0.01用**标记,P<0.001用***标记并且P<0.0001用****标记。
2 结果
2.1 FTR56的序列特征
系统进化树显示FTR56的进化关系于黑猩猩、牛、鼠的TRIM56分开, 单独聚为一簇(图1)。FTR56具有finTRIM系列典型域结构, 包含RING结构域, B-box结构域和PRY / SPRY(B30.2)结构域(图2)。FTR56的全长CDS长度为1686 bp并编码了561个氨基酸。比对结果表明, 斑马鱼FTR56与其他物种TRIM56的同源性较低, 与人、鼠、牛、黑猩猩TRIM56氨基酸序列相似性为13.57%, 13.61%,14.10%和13.68%。
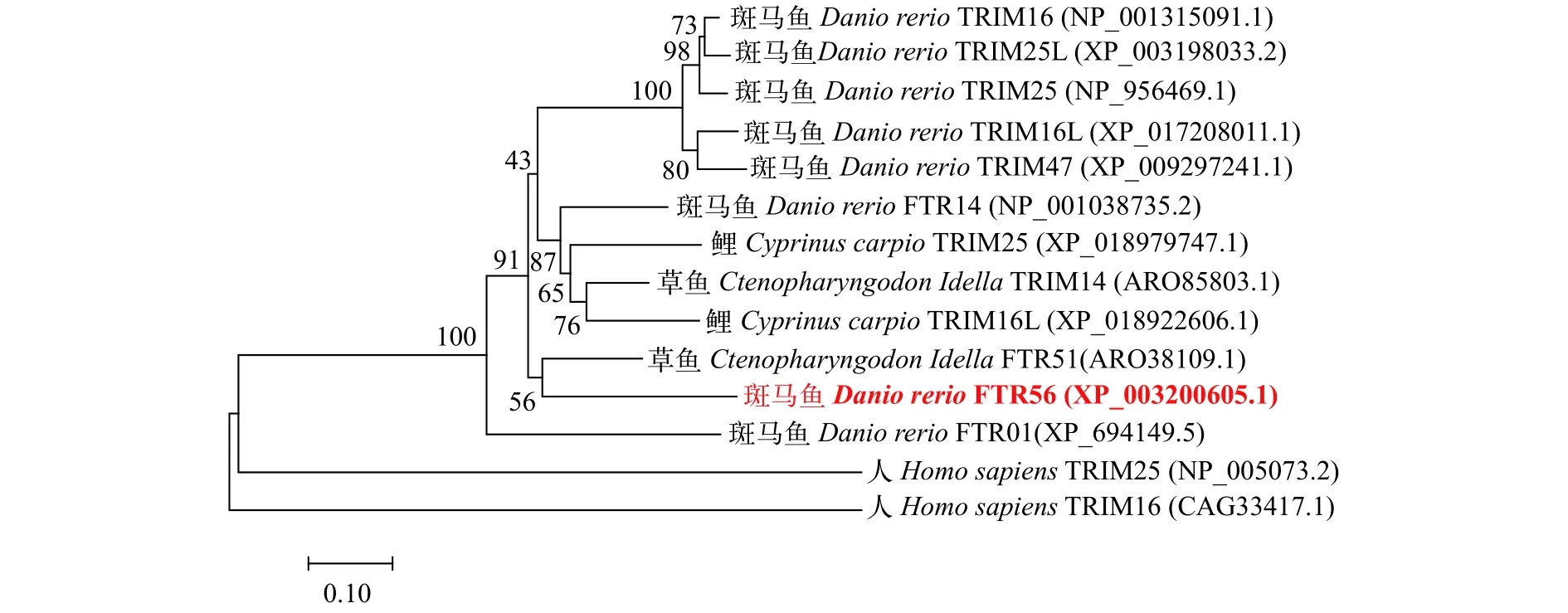
图1 Neighbor-joining法建立斑马鱼FTR56系统进化树Fig. 1 The phylogenetic tree of zebrafish FTR56 using neighbor-joining methods
2.2 FTR56在FHM细胞中的过表达检测
将FHM细胞接入12孔板, 20h后单层细胞铺满底壁后, 将pcDNA4.0-His或pcDNA4.0-FTR56-His转染到细胞中。转染后36h, 用RIPA裂解缓冲液处理细胞, 使用western blot测定法验证FTR56在FHM细胞中成功过表达(图3)。
2.3 SVCV感染对ftr56 mRNA水平的影响
使用qRT-PCR在6h、12h和24h的时间点检测SVCV感染组ZF4细胞中FTR56的转录水平并和未感染组进行比较, MOI为5, TBP (TATA box binding protein)用作内参。与对照组相比, FTR56的转录水平6h和12h无显著变化, SVCV感染后24h显著上调(图4)。
2.4 FTR56过表达抑制SVCV的增殖
为了研究FTR56是否具有抵御病毒感染的能力, 我们检测了FTR56过表达对SVCV复制的影响。将pcDNA4.0-FTR56-His质粒转染FHM细胞,同时设转染pcDNA4.0-His空载体做为对照。在转染24h后, 以MOI为0.05的剂量, 接种SVCV病毒, 在感染后6h、12h和24h收集细胞, 通过qRT-PCR检测SVCV G基因mRNA的表达; 以病毒G蛋白的单抗作为一抗, 通过Western blot检测SVCV G基因蛋白表达; 收集上清, 通过空斑试验检测SVCV病毒的增殖滴度。结果显示FTR56在感染12h和24h显著抑制SVCV G mRNA的表达和蛋白合成(图5a、5b),同时在病毒感染6h、12h和24h对病毒的滴度也有显著抑制作用(图5c、5d)。结果表明FTR56对SVCV的复制具有抑制作用。

图2 FTR56是硬骨鱼类中finTRIM家族的成员Fig. 2 FTR56 is a member of the finTRIM family in teleost fish

图3 Western blot检测FTR56在FHM细胞中的过表达情况Fig. 3 Western blot assay used to detect the overexpression of FTR56 using anti-His tag mouse monoclonal antibody was used in the test
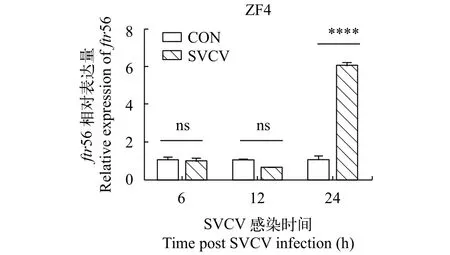
图4 ftr56 mRNA在SVCV感染ZF4细胞6h、12h和24h的相对表达水平Fig. 4 Relative mRNA expression of ftr 56 in FHM cells infected with SVCV at 6h, 12h and 24h
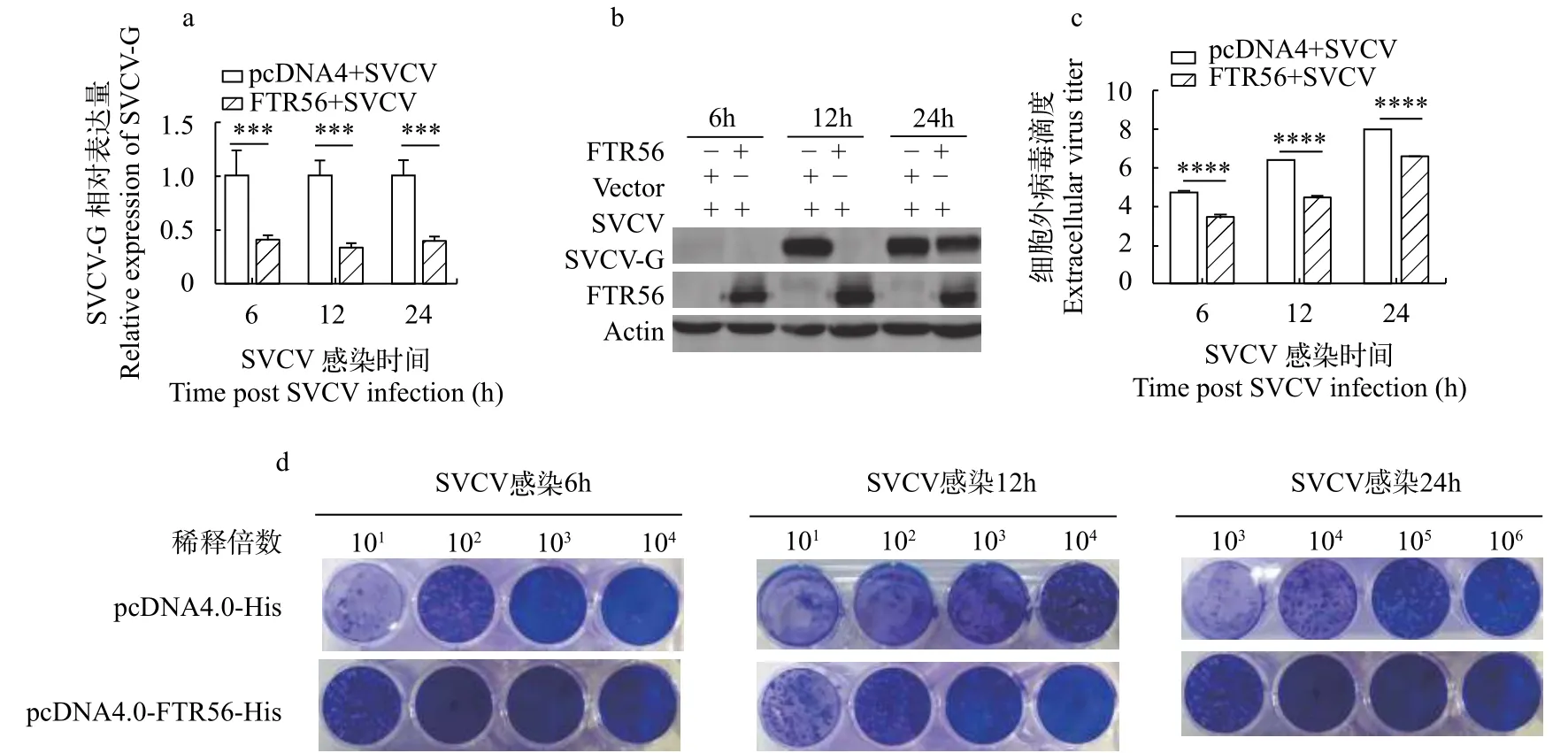
图5 过表达FTR56抑制了SVCV的复制Fig. 5 Overexpression FTR56 inhibited the replication of SVCV
3 讨论
TRIM家族具有E3泛素连接酶活性, 可以影响许多重要的细胞过程, 如细胞凋亡、细胞周期调节、分化、代谢途径和细胞对病毒感染的反应[11]。在哺乳动物中, TRIM家族成员可以调节和协调先天免疫和抗病毒反应[11,12,20,21]。最近的一些研究表明TRIM家族在鱼类天然免疫中也发挥重要作用,来自石斑鱼的TRIM8同源物通过增加干扰素调节因子3(IRF3)和IRF7的转录以及增强的IRF3/IRF7诱导的干扰素刺激的应答元件(ISRE)启动子活性来发挥其抗病毒活性[6], 鲤TRIM32和TRIM47可以抑制SVCV的复制[22,23]。目前对finTRIM研究较少, 迄今为止还没有关于鱼类FTR56分子功能的研究。本研究克隆并表达了斑马鱼FTR56, 探究其在病毒感染中的功能。
TRIM蛋白从N末端到C末端由1个RING结构域, 1个或2个B-box结构域, 卷曲螺旋结构域,PRY和SPRY结构域组成的B30.2结构域等[24]。因此, TRIM蛋白也称为RBCC蛋白。研究表明,TRIM蛋白的RING结构域和B30.2结构域在对病毒感染的反应中起重要作用[14], FTR83和FTR82含有1个RING结构域, 2个B-box结构域, 1个卷曲螺旋结构域, 以及一个B30.2结构域[15], FTR36含有1个RING结构域, 1个B-box结构域, 2个卷曲螺旋结构域和一个B30.2结构域[14]。而FTR56具有一个B-box结构域, 和一个卷曲螺旋结构域。
TRIM参与多种抗病毒反应机制, 其常作为调节因子起作用[25]。许多TRIM基因在病毒感染后上调并在鱼类免疫系统中发挥关键作用, 如TRIM8、TRIM13和TRIM25[6,26,27], 斑马鱼中的这些fin-TRIM基因可能在免疫系统中发挥重要作用。对斑马鱼finTRIM的研究表明, FTR83和FTR36显著增加IFN表达并调节ISG的表达, 在体外和体内介导对RNA病毒的有效抗病毒活性[14,15]。在本研究中FTR56在SVCV感染的ZF4细胞中mRNA水平24h显著上调, 在FHM细胞中过表达FTR56, 在SVCV感染12h和24h显著抑制SVCV G的转录水平和蛋白质水平, 进一步通过空斑实验检测, 病毒滴度相比于对照组显著降低。通过这些研究结果表明斑马鱼FTR56是一个关键的抗病毒蛋白。
本研究克隆了斑马鱼ftr56基因, 对其序列和表达谱的一系列特征进行了生物信息学分析, 并进行了真核表达。在FHM细胞中过表达FTR56, 发现其对SVCV的复制具有显著抑制作用, 本研究的结果为深入了解斑马鱼FTR56的抗病毒机制的研究提供了基础, 为加强水产养殖病毒性疾病的预防和控制提供新的信息。

