金鱼藻对盐碱胁迫的生理响应研究
龙忆年 鲁 汭 王 培 林莉莉 陈宇华 肖恩荣 吴振斌
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072;2. 中国科学院大学, 北京 100049; 3. 武汉理工大学, 武汉 430070)
莫莫格国家级自然保护区, 位于吉林省镇赉县东部, 是以白鹤等珍稀水禽栖息地为主要保护对象的内陆湿地和水域生态系统保护区[1], 其中白鹤湖(俗称鹅头泡)是白鹤迁徙途中重要的栖息场所, 也是莫莫格湿地保护区内的代表性湖泊。白鹤湖水体pH常年高于8.0, 属于HCO3-Na型水体, 呈现盐碱化特征[2], 尤其在枯水期, 沿湖带随处可见析出的白色盐分。周边的农田退水排入保护区内湿地, 进一步汇入白鹤湖中, 使得湖体盐碱化同时, 也伴随着极大的富营养化风险。根据近两年初步调查, 白鹤湖中现存的沉水植物种类稀少, 生物量相对较高的仅有篦齿眼子菜(Potamogeton pectinatus)、金鱼藻(Ceratophyllum demersum)、黄花狸藻(Utricularia aurea)等, 且主要分布在风浪较小、水流流速较小、且周围挺水植物相对较多的几个区域。
沉水植物作为主要生产者, 具有为鱼虾等水生生物提供食物及栖息地, 提高水体自净能力和透明度等生态功能, 在湖泊生态平衡及生物多样性中起着不可或缺的作用。虽然目前关于植被耐盐碱的研究已有许多, 但大部分集中在挺水植物如扁秆藨草[3]、互花米草[4]、芦苇[5], 农作物如茄子[6], 陆生植物如连翘、朱蕉[7]等, 关于沉水植物耐盐碱的研究少之又少。盐碱化过程对沉水植物的生长发育及其生态功能造成的影响是否与挺水植物相似, 还有待进一步研究。一般来说, 盐胁迫会产生渗透效应和特殊离子效应, 以渗透效应为主; 而碱胁迫除这两种效应外, 还有一个重要因素, 即高pH对植物生长的影响[8]。盐化与碱化分别以盐度和pH升高为主要特点, 这两种作用的叠加往往产生1+1>2的协同作用[9]。部分学者根据对植物的危害程度从大到小依次排序, 分别是盐碱胁迫、碱胁迫、盐胁迫[10]。那么, 在盐碱化并伴随富营养化趋势的湖泊中如何恢复沉水植物, 是亟需考虑和解决的问题。
因此, 本实验选取常作为触发浅水湖泊稳态转换的先锋种之一[11,12]、同时较能耐受盐胁迫[13]的沉水植物金鱼藻为对象, 研究碱胁迫和混合盐碱胁迫对金鱼藻生理变化的影响, 拟为盐碱化湖泊的沉水植被先锋种筛选和植被修复提供参考。
1 材料与方法
1.1 实验材料
实验用金鱼藻取自武汉东湖, 在实验室中先用自来水浸泡冲洗3次, 再用去离子水冲洗3遍去掉杂质, 接着挑选出生长状态较好的植株并去除残枝后放置营养液中驯化培养3周, 期间定期换水并移出死亡植株残体。营养液参考Hoagland’s配方并结合白鹤湖水体营养盐成分后进行改良, 以保证植物所需基本元素同时模拟白鹤湖水质(配方见表1)。从培养好的金鱼藻中挑选根茎叶完好、叶色正常的植株用于实验, 驯化培养阶段不计入实验周期。
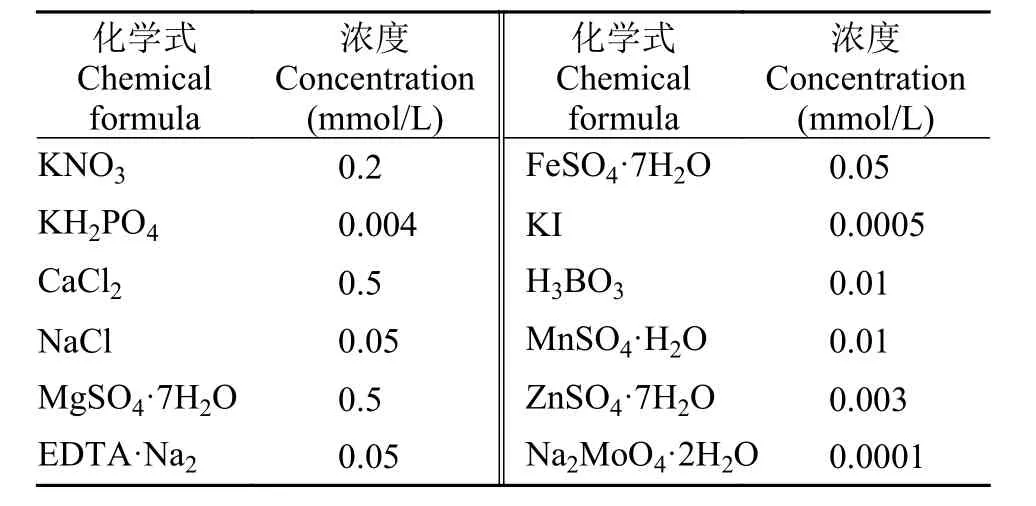
表1 金鱼藻水培营养液配方Tab. 1 Nutrient solution formula for hydroponic culture of C.demersum
1.2 实验设计
根据前期对白鹤湖水体的调查, 其全盐量在0.2—1.5 g/L; 碱度主要由和少量提供,范围在1—17 mmol/L; 混合盐碱成分以NaCl、NaHCO3、Na2CO3三种盐为主, 平均比例为NaCl :NaHCO3: Na2CO3=10 : 9 : 1。
盐度(g/L)=NaCl(g/L)+NaHCO3(g/L)+Na2CO3(g/L)。
为区分单一碱度以及混合盐碱对金鱼藻生长的影响, 同时为模拟实际水体水质条件, 实验分为碱度梯度试验和混合盐碱胁迫实验两阶段。
第一、碱度梯度实验。实验装置为2 L烧杯12个, 将相同生物量的金鱼藻引种至配好培养液的装置中, 每个装置中金鱼藻质量浓度控制在10 g/L;设置A、B、C、D 四个梯度(表2), 每组3个平行。水质TN: 2.2—2.4 mg/L; TP: 0.11—0.18 mg/L。实验持续14d, 每3—4天取一次植物样; 研究单一碱度对植物生理的影响。
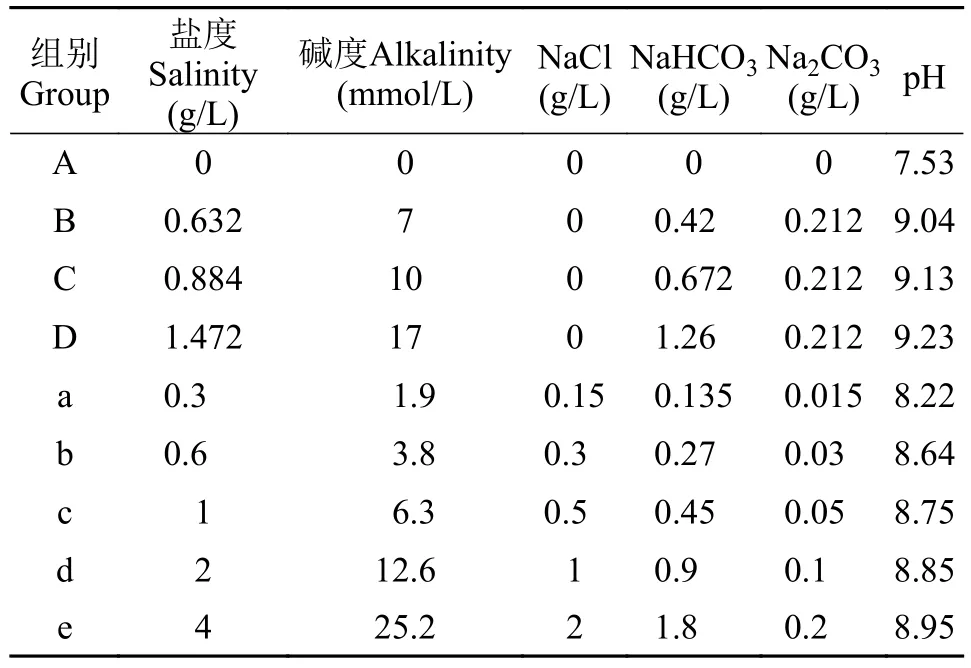
表2 两阶段实验的碱、混合盐碱成分Tab. 2 Composition of alkali and mixed salt and alkali in twostage experiments
第二、混合盐碱胁迫实验。实验装置为15 cm×20 cm×30 cm玻璃缸15个, 每个装置中金鱼藻质量浓度同样控制在10 g/L; 设置a、b、c、d、e 五个梯度(表2), 每组3个平行。水质TN: 4.9—5.1 mg/L;TP: 0.13—0.19 mg/L。实验周期35d, 每7天取一次植物样用于各生理指标的测定。
两阶段实验均在25℃恒温室内进行, 控制白天光强3000 lx、晚上光强200 lx, 光暗时间比12h :12h。实验过程中及时补充装置水分; 观察植物生长状态, 取金鱼藻顶枝测定生理指标, 取样时间为当天上午9:00—11:00; 于实验开始和结束时测定水质指标, 监测水质在线指标。
1.3 参数测定
植物主要生理生化指标测定方法参考《植物生理生化实验原理和技术》[14,15]。其中过氧化物酶(POD)采用愈创木酚法, 超氧化物歧化酶(SOD)采用氮蓝四唑法, 脯氨酸(Pro)采用酸性茚三酮比色法, 丙二醛(MDA)采用硫代巴比妥酸法, 叶绿素采用乙醇提取分光光度法。
水质理化参数总盐度、pH等采用YSI水质在线监测仪测定, 总碱度采用德国默克碱度测试盒测定, 水质指标总氮(TN)、总磷(TP)、化学需氧量(COD)的测定参见《水和废水监测分析方法》[16]。
1.4 数据统计分析
使用SPSS 22.0软件对数据进行统计分析, 用单因素方差分析(One-way ANOVA)分析组别之间的差异显著性,P<0.01时认为有极显著差异,P<0.05时认为有显著差异。用相关性分析(Pearson)检验盐碱与各指标之间有无相关性及相关性强弱, 相关系数绝对值越接近于1, 则相关性越强。
2 结果
2.1 碱度梯度实验中金鱼藻的生长和生理变化
在碱度梯度实验中, 各组别金鱼藻在形态上均生长良好, 没有表现出明显的胁迫症状; 部分生理指标上的小幅变化, 在一定程度上显示受到了碱度的影响, 其含量变化趋势如图1所示。
POD在实验开始时显示出随碱度升高而活性降低的趋势, 实验后期各处理组的POD活性都有明显降低, 且各组水平相近。
SOD能够催化植物细胞内的超氧化物发生歧化反应, 产生氧气和过氧化氢。马剑敏等[17]认为SOD变化趋势应与POD变化总趋势相同, 随胁迫浓度增加而增加。而在本实验中SOD的增长率随碱度增加而下降, 没有表现出碱度浓度越大而增长趋势越明显的现象。
膜脂过氧化产物MDA初始水平相近, 在第10天时有明显的积累。MDA积累的越多时, 标准差也相应增大, 由于植物本身植株之间MDA积累能力的不同, 随时间增长, 差异被放大。
渗透调节物质脯氨酸随时间增长而逐渐降低,在实验初期, 碱度越大脯氨酸含量越高。尽管实验结束后脯氨酸都达到相似水平, 而脯氨酸的积累速度在一定程度上与NaHCO3浓度表现出相关性, 李源等[18]研究认为脯氨酸积累的快慢能体现植物对胁迫反应的敏感程度, 表明金鱼藻对不同碱度的敏感程度不同。
在对水体碱度的监测中发现, 未添加NaHCO3的对照组和低浓度处理组的碱度在实验后期都有升高, 在实验后期金鱼藻的生理指标中也没有显示出梯度变化, 极有可能是空气中CO2的溶解造成的。在后续的研究中可采取矫正措施或升高碱度浓度至空气溶解作用可忽略不计。
2.2 混合盐碱条件下的金鱼藻生长和生理变化
在混合盐碱胁迫下, 金鱼藻的生长状态出现较为明显的差别。实验进行的第7天已有胁迫现象(图2), 不同组别金鱼藻分别表现为: 对照组植物茎叶长势一般; b处理组(0.6 g/L、3.8 mmol/L)的金鱼藻在所有组别中长势最好, 植物整体偏绿, 没有表现出胁迫症状, 推测一定的盐度能促进其生长; c处理组(1 g/L、6.3 mmol/L)处理组表现出轻微的胁迫症状, 较少的叶片发黄, 植物整体长势不如b处理组;d处理组(2 g/L、12.6 mmol/L)表现出较为明显的胁迫症状, 部分植株发黄枯萎, 叶片脱落, 整体长势不如c处理组; e处理组(4 g/L、25.2 mmol/L), 所有植物都表现出较为严重的胁迫症状, 大面积发黄发黑,表现出衰败的趋势。在实验第21天, 2 g/L处理组已有部分脱落在缸底的金鱼藻叶片, 生物量减少约1/3, 存活下来的金鱼藻都表现出较好的恢复趋势;此时e处理组金鱼藻已全部死亡(图2)。
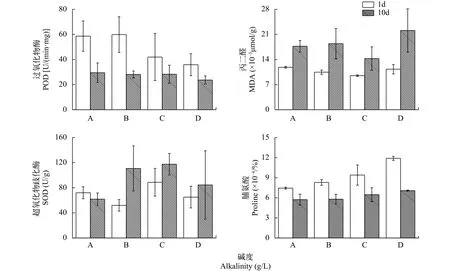
图1 碱度对金鱼藻POD、SOD、MDA、Pro的影响Fig. 1 Effects of alkalinity on POD, SOD, MDA and Pro of C. demersum
高浓度处理组胁迫特征明显, 而对照组和低浓度处理组都没有表现出较为明显的胁迫症状。在混合盐碱胁迫下金鱼藻的生理指标变化见图3, 对POD数据进行单因素方差分析, 结果显示组别之间差异显著(P<0.05)。在第7天时, 各处理组POD活性已经表现出差异, 在第14天后趋于相同, 差异减小。d处理组的金鱼藻, 在第21天时POD达到最大,此时标准差也较大, 植株间的生长状态发生了较大的差异, 金鱼藻表现为有部分叶片变黄、脱落、枯萎死亡, 而部分存活。存活下来的金鱼藻, POD逐渐降低, 在实验第35天与低浓度处理组的POD含量趋于一致。而e处理组的金鱼藻, POD活性一路升高, 表现出较为严重的胁迫症状, 第21天后全部死亡。金鱼藻的POD活性变化与生长状态变化趋势完全一致。
在混合盐碱胁迫下(图3), 金鱼藻SOD活性变化均有一个先升高再下降, 后趋于稳定的变化趋势,有明显的胁迫特征。21d后SOD趋于稳定, 金鱼藻在生理形态上也基本恢复正常, 也说明了金鱼藻已适应了盐碱条件。从图3中可以看出, 第7天时e处理组的SOD活性最高, 与POD活性变化趋势一致。第二周开始各组SOD活性普遍下降, 只有e处理组金鱼藻濒临死亡, SOD异常升高, 表明4 g/L盐碱已经超出了金鱼藻耐盐界限。

图2 不同盐碱条件下金鱼藻生长趋势Fig. 2 The growth trend of C. demersum under different saline and alkaline conditions
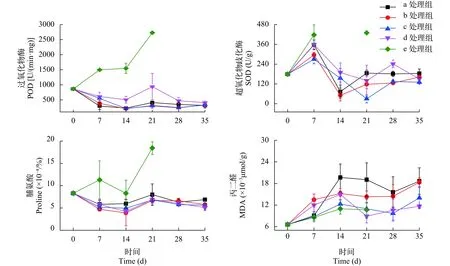
图3 混合盐碱对金鱼藻POD、SOD、MDA、Pro的影响Fig. 3 Effects of salinity on POD, SOD, MDA and Pro of C. demersum
MDA含量随胁迫时间增长有一定的积累, 2周后趋于平稳, 统计检验分析表明组别之间无明显差异(P>0.05)。脯氨酸含量e处理组明显较其他组别高, 其余组别脯氨酸含量差异不大, 统计检验分析结果表明, 组别之间无明显差异(P>0.05)。赵勇[19]研究认为, 脯氨酸含量不能作为植物的耐盐性指标,而可能是一种迫害指标, 表明e处理组的金鱼藻受到盐碱的迫害较严重。
在盐胁迫条件下, 叶绿体是最敏感的细胞器之一。盐胁迫破坏叶绿体结构, 使叶绿素含量下降,引起植株光合能力减弱[20]。叶绿素含量不仅直接关系着植物光合同化作用, 也是衡量植物耐盐性的重要生理指标之一[21]。如图4所示, 金鱼藻叶绿素含量有先减后增的趋势, 可体现出盐碱对金鱼藻的胁迫使叶绿素含量降低, 但1周后便能逐渐恢复。叶绿素的统计检验分析结果表明, 组别之间无明显差异(P>0.05)。
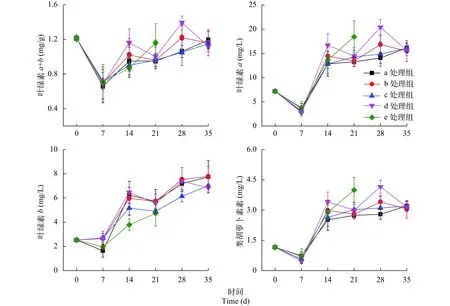
图4 混合盐碱对金鱼藻叶绿素的影响Fig. 4 The effect of mixed salinity on chlorophyll of C. demersum
由表3可知, 在不同盐碱胁迫下金鱼藻对水中氮磷吸收不同, 去除率有随盐碱浓度升高而降低的趋势。程宪伟[22]提出, 当盐度过高时, 植物的生长将受到抑制、根际微生物的活动受到较大影响, 从而影响了植物对氮的吸收。e处理组混合盐碱浓度过高, 氮去除率最低, 且总磷有不减反增的现象, 与植株大量死亡有关; COD在实验开始时未添加, 在实验结束后表现出盐碱浓度越低COD越高的现象,COD含量与植物自身合成有机物的量有关, 这在一定程度上反映出盐碱限制了植物自身的生长合成过程。
3 讨论
盐碱浓度越高, 金鱼藻所受到的生长抑制越严重。王卫红等[23]研究结果表明, 金鱼藻可耐受7.6 g/L以下的盐度, 远远高出本实验结果, 主要差异在于盐碱的成分以NaCl为主。可以看出, 在同一水平下混合盐碱对金鱼藻的叠加伤害要远远大于单一盐或碱胁迫。
3.1 抗氧化酶系统分析
植物在逆境胁迫下会产生活性氧, 损伤细胞蛋白质结构及功能, POD、CAT、SOD等抗氧化酶在逆境条件下会升高, 清除植物细胞内的活性氧, 保护膜结构, 是植物重要的抗逆防御系统[24]。相对于生长指标, 抗氧化酶系统对外界胁迫的表征更迅速敏感, 其响应随胁迫等级及物种的不同而不同; 由于其指标的可重复性不强, 所以一般通过对胁迫等级的响应规律来辨别沉水植物的抗胁迫本质[25]。
在碱度条件下金鱼藻的抗氧化酶应对策略以POD为主, 而对无机氮升高的响应中以CAT为主[26]。刘燕等[27]对狐尾藻、黑藻、金鱼藻三种沉水植物的研究发现, 富营养条件下植物POD活性变化幅度大, MDA在胁迫后期升高, 与本研究中盐碱条件下金鱼藻的生理响应趋势一致。
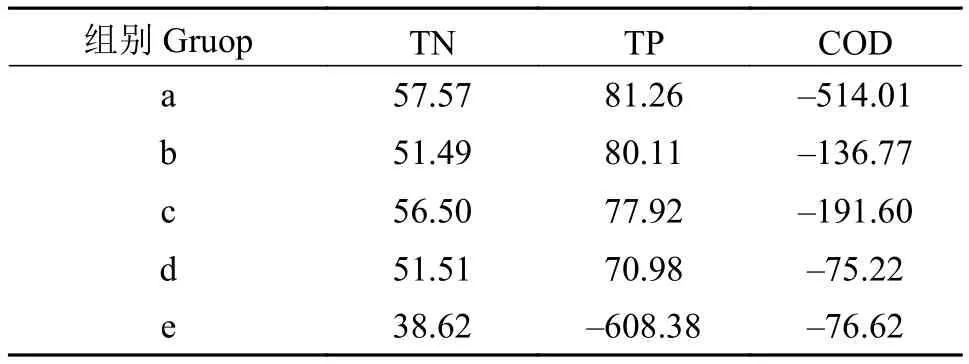
表3 不同盐碱胁迫下水质指标去除率Tab. 3 The removal rate of water quality index under different salinities and alkali stress (%)
在混合盐碱胁迫下, c组(碱度: 6.3 mmol/L, 盐度1 g/L)盐碱条件下的POD活性值较D组(碱度:17 mmol/L, 盐度: 1.472 g/L)高出近10倍, 更加说明了混合盐碱对金鱼藻的生理胁迫伤害要远远大于单一碱度。稍高浓度处理组(b组)的金鱼藻比低浓度处理组(a组)长势更好, 而更高浓度处理组(c、d、e组)则表现出胁迫症状, 植物对盐度表现出低促高抑的效应[28], 低浓度的盐碱可以为植物提供生长所需元素离子, 早有研究表明沉水植物可利用水体中的无机碳(、等), 因此低浓度的盐碱对金鱼藻的生长起到的促进作用要远远大于它的胁迫抑制作用, 而高浓度盐碱的效果则反之。金鱼藻的POD活性在碱度条件下并无升高, 其脯氨酸含量对碱度变化的响应更为明显。
本实验中在混合盐碱下金鱼藻SOD值大都在100 U/g以上, 最高达到400 U/g, 远高于刘燕等[27]研究富营养胁迫下金鱼藻SOD值(几乎在100 U/g以下, 最高不超过300 U/g)。可见, 混合盐碱对金鱼藻造成的直接伤害要远大于富营养化。
3.2 膜脂过氧化程度变化
过高的盐、碱胁迫都能影响植物细胞膜的结构和功能, 引起膜透性增大、膜结构破坏等, 通过测量MDA的含量可以反应质膜的破坏程度[29]。也有研究表明, 丙二醛积累越多表明组织的保护能力越弱[30]。抗氧化系统保护酶的调节能力有限, 当细胞膜的损坏超过防御系统能力时, 体内的超氧化物歧化酶、过氧化物酶及过氧化氢酶活性不能维持较高水平, 膜脂过氧化加重, 进而导致丙二醛含量升高[31]。在本研究中金鱼藻MDA含量在实验前后都有明显积累, 但随盐碱的变化反而有降低趋势,因此可得出盐碱越高的实验组中金鱼藻的保护酶水平较高, 保护机制调动更明显。
3.3 渗透调节物质变化
植物在抗盐碱过程中, 除了吸收外界离子来调节细胞内外渗透压之外, 还会自身合成有机物质脯氨酸等来调节渗透压, 脯氨酸含量可作为植物对盐胁迫的敏感性指标[32]。植物耐盐性与脯氨酸含量的关系一直存在着争议, 是由于渗透调节物质除脯氨酸外还有其他有机酸、可溶性糖等。不同植物的耐盐机理不一样, 不可单用脯氨酸的含量变化来对比评估植物的耐盐性。在本实验中脯氨酸含量对碱、盐碱的响应较大, 与抗氧化酶系统的关系较符合协同调控作用。
3.4 光合能力变化
王旭明等[33]研究表明, 光合速率与丙二醛及脯氨酸都有相关性, 而叶绿素是植物光合能力的重要条件。在本实验结果中, 发现叶绿素与丙二醛及脯氨酸都没有明显相关性(P>0.05), 说明盐碱胁迫可能不会直接影响金鱼藻的光合色素, 而间接影响光合作用过程使光合速率下降, 其胁迫机理有待进一步探索。肖雯等[34]研究认为, 叶绿素含量并不能直接反映植物的耐盐性, 但能表示植物在盐碱条件下光合能力强弱, 可与其他指标综合分析, 作为植物耐盐性判断的参考指标。
窦艳艳等[35]研究发现, 水中能大大减少和缓解苦草所受富营养胁迫作用。Kahara等[36]表明许多沉水植物具有利用水中和CO2的能力;张彦辉等[37]也研究证明, 金鱼藻能利用作为光合无机碳源, 在1.5 mmol/L(盐度0.915 g/L)外源浓度下能促进金鱼藻的生长。根据实验结果及前人研究所得, 可得出实验中的NaHCO3对金鱼藻的生长是促进作用。浓度低时促进生长作用占主导, 浓度过高时胁迫作用占主导, 胁迫与促进作用是彼此交互还是各有浓度范围, 机理有待进一步研究。
3.5 盐碱条件对金鱼藻吸收水中氮磷的影响
张永亮等[38]研究表明, 盐胁迫会影响植物吸收营养盐的能力。本研究中混合盐碱与各指标的相关性分析见表4, TN、TP去除率与盐碱浓度呈现显著负相关性。体现出盐碱胁迫越高, 对金鱼藻吸收利用水中N、P营养盐的影响越大。

表4 各项指标与混合盐碱相关性分析Tab. 4 Correlation analysis of each index and mixed salinity
4 结论
在本研究中, POD是金鱼藻应对盐碱胁迫的主要抗氧化防御酶, 当外界盐碱条件升高时, POD最先做出响应且活性较高; 当碱度17 mmol/L、盐度1.472 g/L以下时, 金鱼藻主要积累脯氨酸来应对,是主要的渗透调节物质, 这些可作为评估金鱼藻耐盐碱的综合指标。

