恶性胶质瘤溶瘤病毒治疗进展
刘鸿宇 余新光 陈凌
恶性胶质瘤是临床最为常见的原发性脑肿瘤,患者预后不良[1],尤以胶质母细胞瘤预后最差,目前的标准治疗方案是通过手术最大程度切除肿瘤并辅以同步放化疗和替莫唑胺辅助化疗,但治疗后中位生存期仅14.6个月[2]。尽管近年在胶质瘤分子机制方面不断获得新的认识并为分子靶向治疗付出巨大努力,但治疗效果并无明显改善,因此,迫切需要探索新的有效治疗方法。恶性胶质瘤预后不良的主要原因包括:(1)对传统放化疗的抵抗性。(2)血⁃脑屏障的存在。(3)肿瘤浸润性较强。(4)大脑的相对免疫豁免状态。(5)存在具有自我更新能力和对常规治疗抵抗的肿瘤干细胞(TSCs)[3⁃5]。随着对恶性胶质瘤研究的不断深入,涌现出针对此类肿瘤基本发病机制及其免疫微环境的治疗方法,可能是对现有标准治疗方案的较好补充[3,6]。
病毒治疗恶性肿瘤最早可追溯到一个多世纪以前,De Pace[7]在 1912年的病例报告中描述 1 例宫颈癌患者被犬咬伤接种巴斯德减毒狂犬病疫苗后,病情出现好转;在随后开展的治疗中,有30例接种狂犬病疫苗的黑色素瘤患者病情明显好转[8⁃9]。感染天然病毒如麻疹病毒的临床研究也证实,病毒可使伯基特淋巴瘤和霍奇金淋巴瘤患者的肿瘤细胞消失[10⁃11]。随着治疗中出现的严重不良事件和药物化疗的兴起,阻碍了病毒疗法早期研究的进一步开展[6]。既往30年重燃对经基因工程改造的病毒治疗恶性胶质瘤的兴趣,分子生物学和遗传学领域的研究进展使对病毒进行合理修饰再治疗肿瘤成为可能。病毒疗法分为两种类型,即复制能力较强的溶瘤病毒(OVs)和缺乏复制能力的病毒载体进行治疗基因的传递[6]。溶瘤病毒通过病毒特异性感染肿瘤细胞,以及释放病毒后代诱导肿瘤细胞溶解。1991年,Martuza等[12]发现一种 1型单纯疱疹病毒(HSV⁃1)⁃胸苷激酶(tk)缺失突变体(dlsptk),其在静止细胞(如神经元)中复制能力较弱,由于tk基因缺失,该病毒需依靠旺盛分裂的细胞为DNA复制提供胸苷激酶,在恶性胶质瘤动物模型中显示出令人振奋的疗效。但是,由于tk基因缺失,该病毒对以胸苷激酶为靶点的抗病毒药物(如阿昔洛韦和更昔洛韦)产生耐药性,考虑其缺乏安全性,故至今未能进入临床试验[1]。尽管如此,该项溶瘤病毒治疗胶质瘤的动物实验仍是一件里程碑事件。此后10年,有两项经基因工程改造的HSV⁃1病毒治疗恶性胶质瘤的Ⅰ期临床试验结果发表[13⁃14],恶性胶质瘤的病毒疗法逐渐被证实是安全的。上述研究均证实经基因改造的病毒治疗肿瘤的可行性和实用性,为临床应用提供了良好的理论依据。本文拟重点介绍几种已进入临床试验的溶瘤病毒疗法(表 1)[13⁃29]。
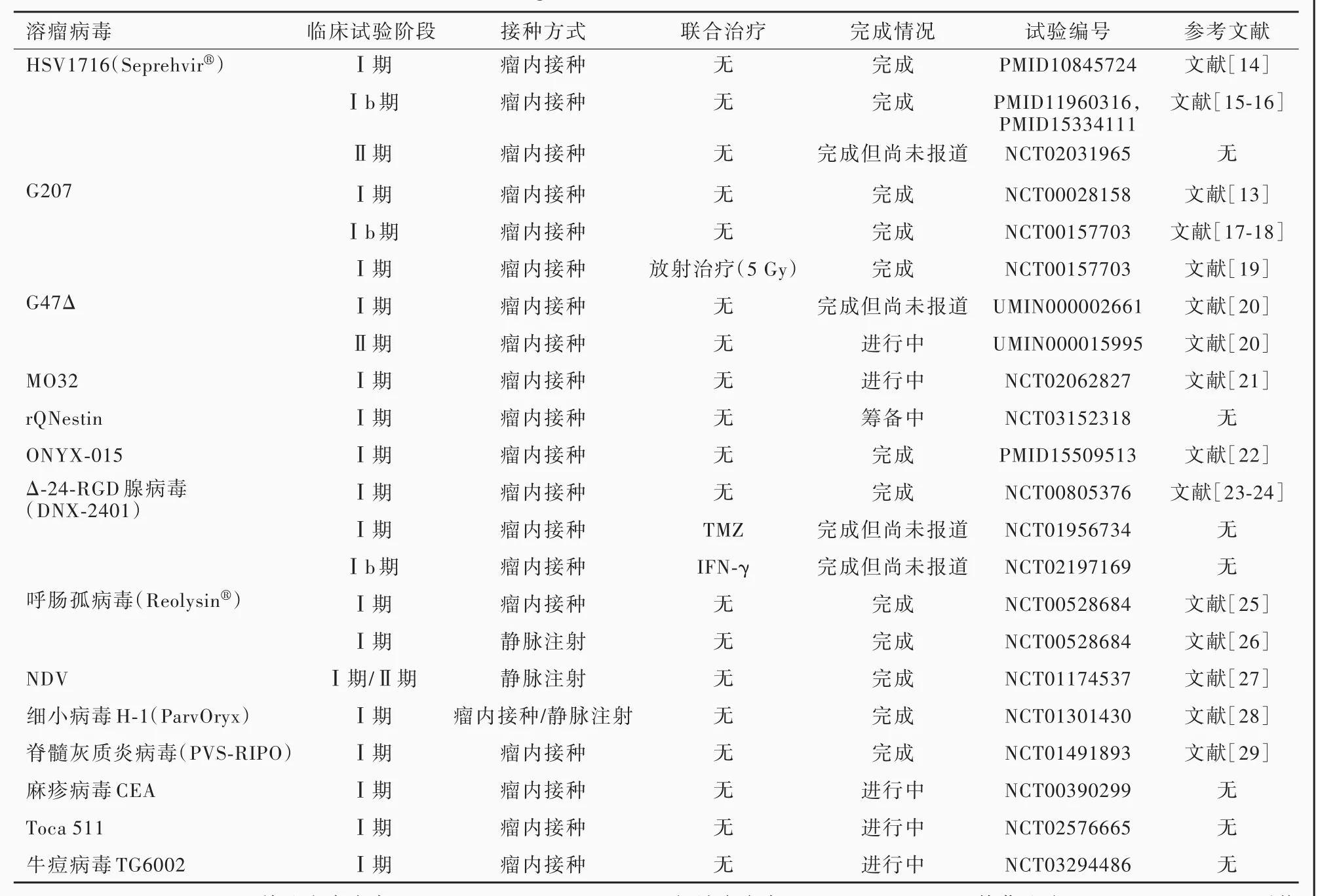
表1 溶瘤病毒治疗胶质瘤的相关临床试验Table 1. Clinical trails of OVs in the treatment of glioma
一、1型单纯疱疹病毒
HSV⁃1为大型双链DNA病毒,是常见的人类病原体,长期潜伏于人体内并有终身感染的可能[30]。HSV⁃1病毒是嗜神经病毒,参与溶瘤的基因与神经毒性基因不同,允许肿瘤细胞有条件地复制和操纵溶瘤基因[1]。HSV⁃1病毒的附加安全特性是当tk基因完整时,其对阿昔洛韦和更昔洛韦敏感,从而提高该病毒用于临床试验的安全性。
自1991年dlsptk病毒在恶性胶质瘤动物模型中取得一定成果后[12],又设计出多种HSV⁃1病毒突变体并用于降低神经毒性,同时保留其感染和裂解分裂活跃的肿瘤细胞的能力[21,31⁃34]。这些减毒突变体包括删除双拷贝的γ134.5基因或将外源基因lacZ插入UL39基因,γ134.5基因编码受感染细胞蛋白34.5(ICP34.5),激活磷酸酶,再去磷酸化真核翻译起始因子 2α(eIF2α),恢复受感染细胞蛋白(ICP)的合成,发挥神经毒性作用[1,31];删除γ134.5基因可移除部分延迟激活的转录本,预防病毒在最初感染后建立潜伏期[1,32]。UL39基因编码核糖核苷酸还原酶的大亚基ICP6,是神经元等有丝分裂后细胞复制所必需的[1]。但在分裂旺盛的细胞中,UL39基因突变体在一些特殊细胞状态下(如不分裂细胞或39.5℃以上高温)严重影响病毒复制[33],从而允许病毒有条件地持续进行复制[1]。这种核糖核苷酸还原酶突变不仅能够限制病毒复制至分裂旺盛的细胞,同时可以增加病毒对阿昔洛韦的敏感性,进而提高药物的安全性[34]。
目前,已有3种HSV⁃1型溶瘤病毒株(包括HSV1716、G207、G47Δ)在胶质瘤患者中完成Ⅰ期临床试验,评价另2种HSV⁃1型溶瘤病毒株(包括M032和QNestin34.5)有效性和安全性的临床试验正在进行中[21]。
1.HSV1716 HSV1716(Seprehvir®,美 国 Virttu Biologics公司)是双拷贝神经毒性基因γ134.5缺失的第1代溶瘤性HSV,可在旺盛分裂的细胞中选择性复制。最早的一项关于HSV1716的Ⅰ期临床试验纳入9例复发胶质瘤患者,于瘤内接种噬菌斑形成单位(PFU)高达100×103的HSV1716,治疗期间耐受性良好,未诱发单纯疱疹病毒性脑炎;4例患者治疗后生存24个月[14]。另一项针对HSV1716的Ⅰ期临床试验纳入12例恶性胶质瘤患者,予单次瘤内接种HSV1716(100×103PFU),治疗4~9天后于10例患者的肿瘤远隔部位检测到病毒DNA;5例检测到明显的HSV特异性IgG和IgM水平升高,表现出特异性免疫应答;3例经手术切除联合HSV1716治疗后达到平均 2 年的临床稳定期[15⁃16]。
2.G207 G207为双拷贝γ134.5基因缺失并将外源性基因lacZ插入UL39基因从而使ICP6失活的HSV⁃1病毒突变体,支持病毒在旺盛分裂的细胞中有条件地复制,有效性在小鼠和非人类灵长类动物实验中得到较好的验证[35⁃37]。2000 年,Markert等[13]首次报告G207治疗恶性胶质瘤的Ⅰ期临床试验结果,21例复发或进展期胶质瘤患者在标准治疗方案(最大程度手术切除辅以术后放射治疗)后接种G207,最低剂量为1×106PFU接种于单个肿瘤位点、最大剂量为3×109PFU接种于5个肿瘤位点,未见明显神经毒性反应和严重不良事件,8例治疗后1个月MRI增强扫描可见肿瘤体积缩小。2009年,该项研究团队发表另一项Ⅰb期临床试验结果,6例胶质瘤患者共接种2次总剂量为1.15×109PFU的G207,治疗1个月内病情稳定,无明显不良事件和单纯疱疹病毒性脑炎,中位生存期为6.6个月;并在所有患者肿瘤样本中检测到编码HSV DNA聚合酶的病毒RNA,但未在血液或唾液中检测到病毒[17]。2014年,该项研究团队又公布一项最新的Ⅰ期临床试验,旨在探讨G207与放射治疗联合治疗复发胶质瘤的有效性,9例患者于放射治疗(5 Gy)前24小时瘤内接种 G207(1×109PFU),均耐受良好,治疗后中位生存期为 7.5 个月[18]。
3.G47Δ G47Δ是在G207中删除α47基因而构建的病毒突变体[19]。目前已完成其治疗胶质瘤的Ⅰ期临床试验,但试验结果尚未见诸报道。此外,日本的一项关于G47Δ治疗残留或复发胶质母细胞瘤患者的Ⅱ期临床试验正在进行中[38]。
二、溶瘤腺病毒
腺病毒是一种双链、无包膜的DNA病毒,是常见的人类病原体,通常可引起轻度上呼吸道感染症状[30]。人腺病毒5型是研究最多的溶瘤腺病毒之一,是多基因工程病毒制剂的关键角色。通过E1A和E1B基因缺失可以构建条件复制型溶瘤腺病毒。Δ⁃24⁃RGD腺病毒(DNX⁃2401)是在E1A基因中删除24个碱基对,并且将RGD⁃motif插入腺病毒Fiber的H⁃loop区段中,使病毒可以通过整合素αvβ3或αvβ5(富集于肿瘤细胞)进入肿瘤细胞,从而增强病毒的选择性复制[20,39]。
ONYX⁃015是一种E1B基因缺失产物,可以有条件地通过失调的P53信号转导通路在肿瘤细胞中复 制[40⁃41]。 2004 年,Chiocca 等[42]首 次 发 表 一 项ONYX⁃015治疗胶质瘤的Ⅰ期临床试验,纳入24例恶性胶质瘤患者,通过在10个肿瘤位点接种不同剂量的ONYX⁃015随机分为4组,即10×106PFU组、100×106PFU组、1×109PFU组、10×109PFU组,均未发现严重不良事件,但亦未观察到明显抗肿瘤效应,中位生存期仅为 6.2 个月。此后,Lang等[22⁃23]发表一项DNX⁃2401治疗复发胶质瘤的Ⅰ期临床试验结果,25例单次瘤内接种DNX⁃2401[(10~30000)×106VP,A组],12例经永久性植入导管在多个肿瘤位点接种DNX⁃2401[(10~30000)×106VP,B组],治疗后14天行手术切除肿瘤并移除导管,再次接种相同剂量的DNX⁃2401。其结果显示,A组有5例患者生存期>3年,其中3例肿瘤体积缩小95%;B组伴随CD8+T细胞浸润和跨膜T细胞免疫球蛋白黏蛋白分子⁃3(TIM⁃3)的表达下调,DNX⁃2401在肿瘤中很好地复制并诱导肿瘤细胞裂解,表明DNX⁃2401可在部分胶质瘤患者中实现持久的免疫应答,从而证实DNX⁃2401通过直接细胞裂解和增强免疫应答而发挥溶瘤作用,并有望未来与其他免疫调节治疗联合应用。目前,有两项有关DNX⁃2401联合治疗的Ⅰ期临床试验正在进行中:一项为DNX⁃2401与替莫唑胺联合治疗胶质瘤(试验编号:NCT01956734),另一项为 DNX⁃2401单纯或与干扰素⁃γ(IFN⁃γ)联合治疗复发胶质母细胞瘤的Ⅰb期临床试验(试验编号:NCT02197169)。
三、呼肠孤病毒
呼 肠 孤 病 毒(pelareorep,Reolysin®,加 拿 大Oncolytics Biotech公司)是无包膜的双链RNA病毒,通常与人类轻度或亚临床呼吸道或肠道感染症状有关[30]。该病毒具有独特的双链RNA基因组,通过与蛋白激酶R途径相互作用,使其对Ras信号上调的肿瘤具有自然选择性[24]。在生理状态下,病毒的双链RNA激活蛋白激酶R,阻止蛋白质合成,促进细胞凋亡;而在多种肿瘤细胞中通过表皮生长因子受体(EGFR)基因突变上调Ras信号而抑制这一作用[43]。尽管激活的Ras信号对呼肠孤病毒的复制很重要,但其溶瘤机制尚不明确[44]。2008年,Forsyth等[45]首次发表呼肠孤病毒治疗胶质瘤的Ⅰ期临床试验结果,纳入12例复发胶质瘤(WHOⅢ~Ⅳ级)患者,通过立体定向方式将呼肠孤病毒(剂量自10×106TCID50增至1×109TCID50)接种于3个肿瘤位点,治疗过程中观察到Ⅰ~Ⅱ级不良事件,主要为与肿瘤进展相关的运动强度下降,但未达到最大耐受剂量,治疗后6周,10例肿瘤进展、1例病情稳定,其中位生存期达21周,其中1例甚至生存54个月。2014年,Kicielinski等[25]的多中心临床试验共纳入15例复发胶质瘤患者,采用“对流增强输送”的方法即持续低压下将病毒经导管注射至肿瘤部位,并于瘤内接种5种剂量的呼肠孤病毒(0.10×109、0.30×109、1×109、3×109和10×109TCID50),治疗期间5例出现Ⅰ~Ⅱ级不良事件如癫发作,1例出现Ⅲ级不良事件如抽搐发作;仅在少数患者中观察到抗肿瘤效应:2例病情稳定、1例达到部分缓解、12例疾病进展,中位生存期为20周。呼肠孤病毒对胶质瘤的治疗效果可能通过与其他药物如贝伐单抗等的联合应用而改善。
四、副黏病毒
副黏病毒(paramyxovirus)是一种包括麻疹病毒(measles virus)和新城疫病毒(NDV)在内的负链RNA病毒家族。麻疹病毒是一种具有高度传染性的人类病原体,可以引起特征性红斑的斑丘疹,在罕见情况下还可以导致亚急性硬化性全脑炎。NDV病毒主要是一种禽类病原体,在人类中仅引起轻微症状[26]。
早在 1955年,Flanagan等[46]即提出,NDV 病毒进入艾氏腹水癌细胞时具有复制和裂解肿瘤细胞的能力。随后,在各类肿瘤动物模型中开展早期研究,其中在神经母细胞瘤和纤维肉瘤中取得令人振奋的疗效[47⁃48]。目前,针对 NDV 病毒的两种减毒菌株(包括MTH⁃68/H和NDV⁃HUJ)均已进入胶质瘤的早期临床试验阶段。(1)MTH⁃68/H 病毒:1999年,Csatary和 Bakács[49]详细报告 1 例 14 岁男性复发胶质母细胞瘤患儿的治疗过程,2年内多次静脉注射MTH⁃68/H病毒,肿瘤体积明显缩小。2004年,该研究团队采用相同方法治疗4例难治性高级别胶质瘤病例(3例儿童、1例成人),生存期达5~9年;至结果发表时,所有患者仍生存并继续接受MTH⁃68/H病毒治疗,生活质量明显改善,几乎未见肿瘤进展相关症状与体征[50]。2006 年,Wagner等[51]联合应用MTH⁃68/H病毒和丙戊酸钠治疗1例难治性间变性星形细胞瘤患儿,并首次提供MTH⁃68/H病毒诱导胶质瘤细胞体内凋亡的组织病理学证据,表明溶瘤病毒与丙戊酸钠联合应用可能产生协同抗肿瘤作用。(2)NDV⁃HUJ病毒:2006 年,Freeman 等[52]开展NDV⁃HUJ病毒治疗复发胶质母细胞瘤的Ⅰ期/Ⅱ期临床试验,共纳入11例患者,第1组每周静脉注射剂量为(0.10~11.00)×109EID50%的NDV⁃HUJ病毒,第2组每周静脉注射11×109EID50%的NDV⁃HUJ病毒,治疗3周,治疗期间耐受性良好,5例出现发热、癫发作、昏迷、晕厥、头痛、腹痛以及高血压等Ⅰ~Ⅱ级不良事件;中位生存期为33.2周,1例完全缓解。然而,迄今尚无其他研究评价NDV⁃HUJ病毒在胶质母细胞瘤治疗中的作用。
五、细小病毒
细小病毒(parvovirus)是包括细小病毒B19(一种人类病原体和传染性红斑的病原体)在内的小的无包膜单链DNA病毒[30]。细小病毒科包括腺相关病毒(细小病毒属,需辅助病毒才能复制)和自主细小病毒(为细小病毒属,可以在特定细胞中独立复制)[27]。自主细小病毒具有在恶性肿瘤细胞中有效复制的特点,其抑制肿瘤的机制可能由直接溶瘤作用和间接免疫反应两个相互关联的作用产生[53⁃54],并已为胶质瘤动物模型所证实,为早期临床试验铺平了道路[55⁃56],使细小病毒在抗肿瘤策略中具有较强的吸引力。Geletneky等[57]进行细小病毒 H⁃1(ParvOryx)治疗恶性胶质瘤的Ⅰ期临床试验,纳入18例恶性胶质瘤患者,第1组术前单次瘤内注射总剂量50%的ParvOryx,术后第10天再于瘤壁注射剩余 50%的 ParvOryx(总剂量分别为 1×106、50×106、1×109和5×109PFU);第2组术前分5次静脉注射总剂量50%的ParvOryx,术后第10天再于瘤壁注射剩余50%的ParvOryx(总剂量分别为50×106和1×109PFU),结果显示,治疗期间所有患者均耐受良好,无剂量依赖性毒性。该项研究的重要性在于,首次证实了ParvOryx可以双向穿越血⁃脑屏障和肿瘤屏障;此外,ParvOryx诱导瘤内T细胞、小胶质细胞、巨噬细胞和少量调节性T细胞(Treg)浸润,是首个通过检测Treg细胞和免疫细胞激活标志物(如穿孔素、颗粒酶B、IFN、IL⁃2、CD40L 和 CD25),详细阐述溶瘤病毒治疗后胶质瘤患者肿瘤免疫应答反应的临床试验[28]。
六、脊髓灰质炎病毒
脊髓灰质炎病毒(PV)是具有单股正链RNA基因组的人类肠道病毒,是脊髓灰质炎的病原体[30]。PV病毒的神经毒性可通过内部核糖体进入位点突变(IRES)而 减 弱 。Gromeier等[28,58]以 鼻 病 毒 的IRES取代正常PV病毒的IRES,生成PV⁃1⁃RIPO病毒,可选择性杀伤肿瘤细胞且不影响正常细胞,其安全性已经胶质瘤动物模型证实。PV⁃1⁃RIPO病毒重组体保留了对PV病毒受体CD155的天然亲和力,该受体通常在高级别胶质瘤细胞中过表达[59]。PVS⁃RIPO病毒是经减毒的1型PV病毒(Sabin),主要与PV病毒受体CD155结合。2018年,Desjardins等[60]发表于N Engl J Med的一项Ⅰ期临床试验共纳入61例复发胶质母细胞瘤患者,分别接种5种剂量的 PVS⁃RIPO 病毒(0.10×109、0.33×109、1×109、3.30×109和 10×109TCID50),10×109TCID50组 1例出现颅内出血的Ⅳ级不良事件;该项研究有52例患者参加了之后的剂量扩增试验,其中6例接种剂量为0.33×109TCID50、31例为50×106TCID50、15例为10×106TCID50,均未观察到 PVS⁃RIPO 病毒的神经毒性反应,36.54%(19/52)观察到PVS⁃RIPO病毒相关Ⅲ级或更高级别不良事件;治疗后24和36个月总生存率为 21%(95%CI:11.000~33.000),高于历史对照组;且0.10×109TCID50组有1例20岁女性患者经治疗后肿瘤彻底消失[60]。该项研究证实PV病毒治疗胶质瘤的有效性和安全性,并为即将开展的Ⅱ期临床试验确定了剂量水平(50×106TCID50)。此外,还有应用麻疹病毒CEA(试验编号:NCT00390299)、Toca 511(试验编号:NCT02576665)和牛痘病毒TG6002(试验编号:NCT03294486)等溶瘤病毒的临床试验正在进行中。
七、展望
胶质瘤的溶瘤病毒治疗仍有诸多需要探索的问题,包括作用机制、剂量、接种方式等。溶瘤病毒与传统标准治疗方案及其他药物如免疫检查点抑制剂的联合应用也将是进一步研究的热点。Martinez⁃Velez等[29]近期公布的研究在弥漫性脑桥胶质瘤小鼠模型和儿童高级别胶质瘤小鼠模型中联合应用Δ⁃24⁃RGD腺病毒与放射治疗,小鼠存活率显著增加,表明Δ⁃24⁃RGD腺病毒与放射治疗联合应用可以产生协同抗肿瘤作用,推测Δ⁃24⁃RGD腺病毒可以导致相关DNA损伤修复蛋白表达下调,使肿瘤细胞对放射治疗更加敏感;这种联合治疗方法尚具有明显促进免疫细胞(CD3+T细胞、CD4+T细胞和CD8+T细胞)向肿瘤微环境(TME)浸润的作用。该研究团队与Manzano团队在后续公布的研究结果中,再次证实Δ⁃24⁃RGD腺病毒可以通过溶瘤作用和提高抗肿瘤免疫反应提高疗效,为即将开展的Ⅰ期/Ⅱ期临床试验(试验编号:NCT03178032)提供了理论依据[61]。
此外,溶瘤病毒还可以作为多用途的先天佐剂以增强获得性抗肿瘤免疫反应,与其他形式的免疫治疗方法联合应用共同改善肿瘤免疫抑制微环境。Saha等[62]的研究显示,G47Δ⁃mIL⁃12[表达小鼠IL⁃12,可以促进辅助性T细胞1(Th1)的促炎症反应作用,以及促进自然杀伤(NK)细胞和T细胞产生IFN⁃γ]与细胞程序性死亡蛋白 1(PD1)/细胞程序性死亡蛋白配体1(PDL1)单克隆抗体相结合,在胶质瘤小鼠模型中疗效显著,减少FoxP3+Treg细胞数目并增加CD8+T细胞和M1型肿瘤相关巨噬细胞(TAMs)数目。Jiang等[63]研究发现,联合应用包含OX40配体的Δ⁃24⁃RGD腺病毒与抗PD1抗体可以促进抗肿瘤CD8+T细胞增殖,进而促进抗肿瘤特异性免疫反应,增加胶质瘤小鼠模型存活率。类似研究在呼肠孤病毒和麻疹病毒的动物实验中也取得了一定成果[64⁃65],均证实溶瘤病毒是联合免疫治疗的理想药物。未来,溶瘤病毒及相关联合治疗策略对提高胶质瘤治疗效果充满希望。
利益冲突无

