脑胶质瘤免疫检查点抑制剂及其临床研究进展
丁骁杰 陈弟 唐超 姚瑜
脑胶质瘤是临床最为常见的原发性颅内恶性肿瘤,具有生存期短、复发率高、病残率高和病死率高等特点[1]。目前胶质瘤的治疗方法主要是通过手术最大程度安全切除,术后辅助放射治疗联合同步化疗或单纯辅以化疗,但绝大多数患者仍不可避免复发,其中以胶质母细胞瘤患者预后最差,为5年生存率最低的肿瘤之一,中位生存期仅14.7个月[2]。多项研究显示,胶质瘤发病率呈逐渐升高趋势,因此更有效的抗肿瘤治疗方法是临床医师和科研工作者致力追求的目标[3⁃4]。近年来,关于免疫检查点及其抑制剂的研究日益增多,为恶性肿瘤的治疗提供一条新的思路[5]。免疫检查点对自身反应性T淋巴细胞(以下简称T细胞)的抑制是生理状态下机体对自身免疫的防御措施,而在病理状态下,免疫检查点则通过类似方式保护肿瘤细胞免于机体的免疫反应。不同于传统化疗药物的细胞毒性作用和传统靶向治疗,免疫检查点靶向治疗旨在调节检查点分子,改变其功能,从而诱导肿瘤细胞死亡[6]。本文拟对主要免疫检查点分子及其抑制剂的研究进展以及在胶质瘤领域的应用进行回顾(图1),并简要介绍部分免疫检查点抑制剂相关临床试验。
一、主要免疫检查点分子
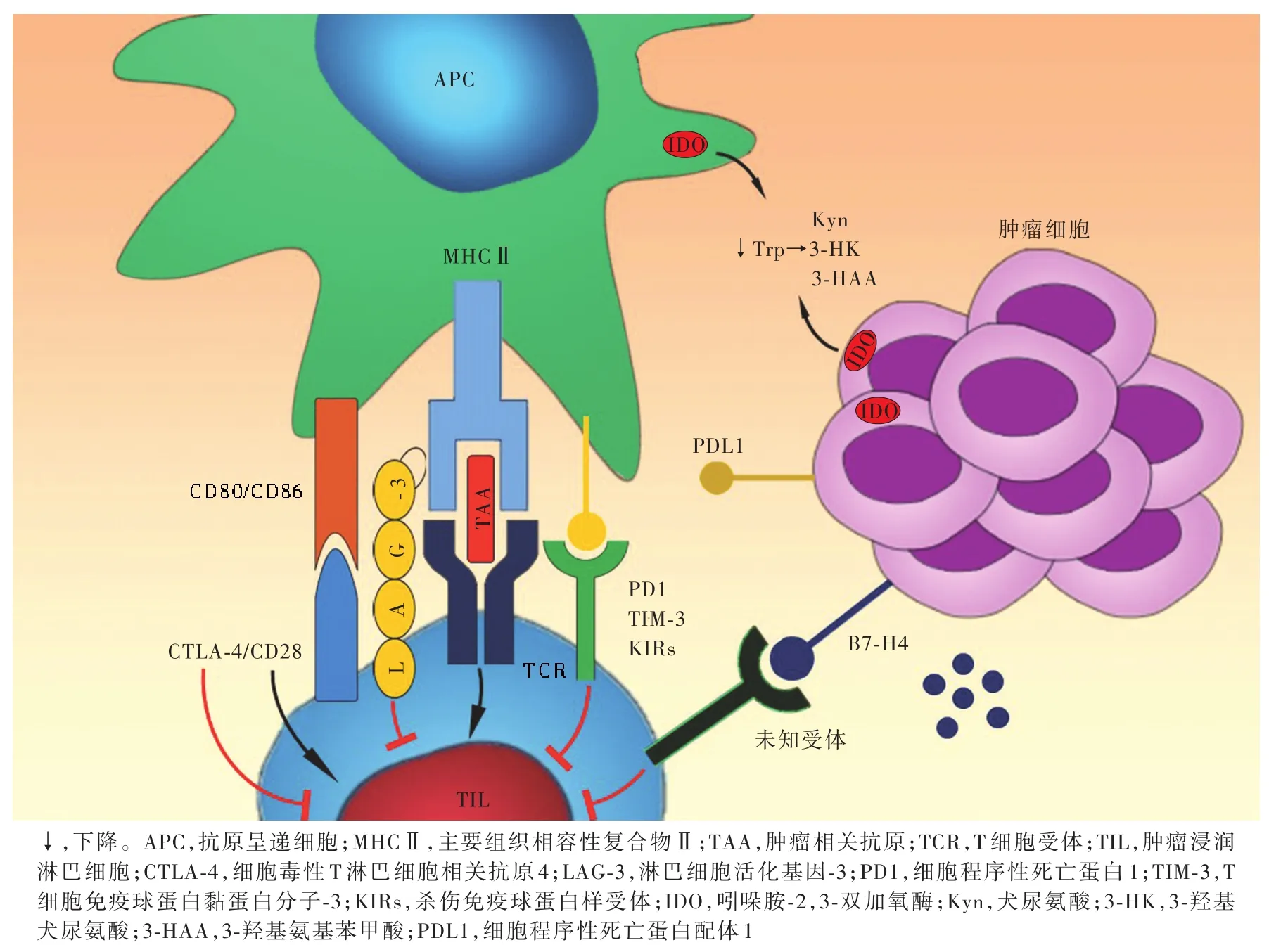
图1 免疫检查点分子在肿瘤微环境中的作用机制Figure 1 Schema of the interactions within immune checkpoint molecules and tumor microenvironment.
1.细胞程序性死亡蛋白1/细胞程序性死亡蛋白配体1 细胞程序性死亡蛋白1(PD1)是一种通过淋巴细胞和单核细胞激活而表达但与细胞凋亡无关的蛋白质,由Honjo教授团队于1992年发现,因其通常表达于死亡的胸腺细胞故而得名[7]。其后,Freeman 等[8]和 Latchman 等[9]相继发现编码细胞程序性死亡蛋白配体(PDL)的基因,属于B7家族,这些配体绝大多数是PDL1,小部分是PDL2。T细胞表面的PD1及其抗原呈递细胞(APC)和肿瘤细胞表面的PDL1,是目前研究最透彻的免疫检查点分子。PDL1/2与PD1结合可下调由T细胞受体(TCR)介导的信号转导通路,抑制早期T细胞激活,阻止其细胞毒性作用,并阻碍炎性因子的生成,导致T细胞在功能上无应答。PDL1表达于肿瘤细胞,既可由某些内源性机制所致,如同源性磷酸酶⁃张力蛋白(PTEN)缺失激活磷脂酰肌醇3⁃激酶(PI3K)信号转导通路,也可由外源性机制引起,如周围激活T细胞分泌的干扰素⁃γ(IFN⁃γ)[10⁃11]。肿瘤细胞表面的 PDL1 可使肿瘤浸润淋巴细胞(TIL)不再具有免疫功能,而PD1/PDL1信号转导通路则使肿瘤细胞对T细胞介导的细胞凋亡不再敏感,提示PDL1是肿瘤细胞中普遍存在的抗凋亡分子[12],故靶向PD1/PDL1的抗体可增强肿瘤浸润淋巴细胞的细胞毒性作用[13⁃15]。目 前,有 2种抗 PD1抗 体(Nivolumab、Pembrolizumab)和 3种抗 PDL1抗体(Atezolizumab、Avelumab、Durvalumab)应用于临床。转移性黑色素瘤患者的肿瘤浸润淋巴细胞常高表达PD1,尤其是肿瘤反应性 T 细胞[16⁃17],故在此类患者中 PD1 可以作为生物学标志物标记肿瘤反应性T细胞[18]。在胶质瘤研究领域,PDL1主要表达于胶质瘤细胞和小胶质细胞、PD1表达于肿瘤浸润淋巴细胞,PDL1表达变化与胶质瘤病理级别有关,研究显示,胶质母细胞瘤中的IDH野生型患者PDL1表达水平明显高于IDH突变型患者[19],而且PDL1表达变化与胶质瘤患者预后呈负相关[20],更多的功能学研究尚待深入探讨。对其他肿瘤患者的研究,PDL1表达变化与预后间的关系尚不能确定,有待进一步研究[21⁃23]。
2.细胞毒性T淋巴细胞相关抗原4 细胞毒性T淋巴细胞相关抗原4(CTLA⁃4)是首个被发现的免疫球蛋白超家族成员,也是首个应用于靶向治疗的免疫调节分子,表达于T细胞[激活T细胞或调节性T细胞(Treg)],主要表达于激活T细胞[24],与抗原呈递细胞表面的CTLA⁃4配体CD80和CD86结合,抑制T细胞的共刺激信号转导通路[25]。胶质母细胞瘤患者外周血CD4+和CD8+T细胞表面的CTLA⁃4表达变化与预后呈负相关[26]。与CD28类似,CTLA⁃4与B细胞和抗原呈递细胞表面相同的蛋白配体结合,但不引起T细胞的激活,而是参与T细胞介导的抑制性抗体生成,具有抗移植物免疫的功能[27⁃28]。PD1和CTLA⁃4均为免疫检查点分子,参与机体预防自身免疫反应的过程,但各自的作用机制和作用部位有所不同。CTLA⁃4信号转导通路发生于T细胞激活的早期,且主要分布于淋巴结T细胞区;PD1信号转导通路则发生于效应器官,如慢性炎症区域和肿瘤;临床前研究业已证实,二者对B16黑色素瘤动物模型的治疗具有协同效应,二者联合治疗可使肿瘤浸润淋巴细胞数目增加,导致效应性T细胞(Teff)与Treg细胞比例发生变化,进而增强Teff细胞之功能[29]。2013 年,Wolchok 等[30]首次报告 Ipilimumab联合Nivolumab治疗恶性黑色素瘤的Ⅰ期临床试验结果,客观缓解率(ORR)为40.33%(21/52),且大部分缓解发生于联合治疗早期;然而,治疗相关不良反应发生率也较高,其中黑色素瘤Ⅲ级和Ⅳ级患者的不良反应发生率为52.83%(28/53),主要包括血清脂肪酶(13.21%,7/53)、天冬氨酸转氨酶(13.21%,7/53)和丙氨酸转氨酶(11.32%,6/53)水平升高。
3.B7⁃H4 近年来,关于B7家族免疫检查点的研究日益增多,除 PDL1(B7⁃H1)外,其他主要研究还包括 B7⁃H3、B7⁃H4、B7⁃H5(VISTA)等。B7⁃H4 在正常组织中几乎不表达,而在多种恶性肿瘤如胶质瘤、肾癌、前列腺癌、乳腺癌中呈高表达[31⁃34],可抑制T细胞增殖、细胞因子分泌和激活T细胞的细胞毒性作用[35⁃36]。我们课题组通过对 B7⁃H4 的长期研究发现,胶质瘤干细胞(GSCs)样细胞可以通过白细胞介素⁃6(IL⁃6)/Janus激酶(JAK)和信号传导与转录激活因子3(STAT3)信号转导通路,诱导胶质瘤相关小胶质细胞表达B7⁃H4,而表达B7⁃H4的巨噬细胞和小胶质细胞是通过抑制T细胞功能和降低自身吞噬能力,形成免疫抑制的肿瘤微环境(TME)[37]。Jeon等[38]的研究显示,阻断B7⁃H4可阻止结肠和直肠肿瘤的生长,减少肺转移,并可增加CD8+T细胞的浸润。我们课题组的前期研究显示,低表达B7⁃H4的胶质母细胞瘤患者更容易从免疫治疗中获益,提示B7⁃H4对胶质瘤患者的预后具有预测作用[37]。目前仅有一种抗B7⁃H4抗体药物FPA150获得美国食品与药品管理局(FDA)批准用于乳腺癌等肿瘤的临床试验(试验编号:NCT03514121),尚无该药用于胶质瘤的临床试验。
4.吲哚胺⁃2,3⁃双加氧酶 吲哚胺⁃2,3⁃双加氧酶(IDO)是一种色氨酸分解代谢酶,主要表达于多种肿瘤细胞和树突状细胞(DC),虽非典型的免疫检查点分子,但具有抑制T细胞激活和抑制自然杀伤(NK)细胞功能的特点[39]。IDO通过犬尿氨酸(Kyn)信号转导通路参与色氨酸的降解[40⁃42],可在不同肿瘤中介导多种抑制性信号转导通路并抑制抗肿瘤免疫反应[39]。肿瘤细胞表面的IDO可将色氨酸分解为大量代谢产物,包括犬尿氨酸、3⁃羟基犬尿氨酸(3⁃HK)和3⁃羟基氨基苯甲酸(3⁃HAA),而T细胞发挥功能需色氨酸的参与,因此,由IDO介导的色氨酸降解机制可间接抑制T细胞激活;色氨酸的代谢产物也可诱导T细胞凋亡[43];此外,犬尿氨酸与转化生长因子⁃β(TGF⁃β)联合作用,可诱导T细胞表达FoxP3 蛋白,从而导致 Treg 细胞生成[44⁃46];同时,肿瘤细胞表面的IDO也具有诱导Treg细胞在肿瘤微环境中浸润的作用。研究结果显示,IDO尚在抑制胶质瘤患者T细胞功能和Treg细胞聚集中扮演重要角色[47⁃48]。在生理状态下,脑实质不表达 IDO[49],而大多数胶质母细胞瘤和低级别胶质瘤患者均表达IDO[47,50],IDO 表达变化与胶质母细胞瘤患者预后呈负相关[47]。动物模型观察显示,靶向IDO药物治疗胶质瘤有效[51]。
5.T细胞免疫球蛋白和黏蛋白分子⁃3 T细胞免疫球蛋白和黏蛋白分子⁃3(TIM⁃3)既表达于CD4+和CD8+T细胞,也表达于巨噬细胞和单核细胞,通过与其配体半乳凝素⁃9(Gal⁃9)结合,耗竭T细胞,从而参与肿瘤的免疫抑制和免疫逃逸[52];此外,TIM⁃3还存在其他配体,如磷脂酰丝氨酸(PS)[53]和高迁移率族蛋白 1(HMGB1)[54]。TIM⁃3 在包括胶质母细胞瘤在内的多种恶性肿瘤细胞中均呈高表达,抗TIM⁃3抗体可以降低Treg细胞比例,并增强CD8+T细胞分泌干扰素的能力。临床研究显示,过表达TIM⁃3的胶质母细胞瘤患者,肿瘤恶性程度更高、生活质量更低(KPS 评分)、预后更差[55⁃56]。
6.淋巴细胞活化基因⁃3 淋巴细胞活化基因⁃3(LAG⁃3)主要表达于CD4+T细胞、CD8+T细胞、自然杀伤T细胞(NKT)、NK细胞、树突状细胞和Treg细胞[57⁃58],但在树突状细胞和 Treg细胞中呈持续表达,而在其他细胞中经激活后方表达[59⁃60]。与 CD4 类似,LAG⁃3具有4个细胞外免疫球蛋白超家族样结构域,与主要组织相容性复合物Ⅱ(MHCⅡ)结合,传递抑制信号,但具体信号转导机制尚不十分清楚。LAG⁃3细胞内部分由多个结构域组成,其中KIEELE结构域与下调T细胞功能有关[61]。肿瘤微环境的持续抗原刺激可导致LAG⁃3表达,并与CD8+肿瘤浸润淋巴细胞的耗竭有关[62]。小鼠肿瘤模型研究显示,LAG⁃3和PD1共表达于肿瘤组织T细胞,可通过双重阻断机制限制肿瘤细胞的生长,这一抑制作用明显优于单一阻断机制[63⁃64]。除MHCⅡ外,Gal⁃3也是LAG⁃3的配体,参与CD8+T细胞的抑制过程[65]。目前关于LAG⁃3的研究尚处于动物实验阶段,仅有少量临床研究正在进行中,如Relatimab联合Nivolumab治疗多种实体肿瘤(试验编号:NCT01968109),已在黑色素瘤患者中显示出较好的治疗效果[66]。
7.杀伤免疫球蛋白样受体 杀伤免疫球蛋白样受体(KIR)是减弱NK细胞毒性且抑制其分泌细胞因子的抑制性受体[67],表达于T细胞和抗原呈递细胞。KIR可表达于各种肿瘤细胞,并且提示预后不良[68⁃69],其中,CD94/NKG2A 表达于大多数星形细胞瘤T细胞[70],T细胞KIR的激活可以抑制其细胞毒性作用。目前多种抗KIR抗体正处于临床试验阶段( 试 验 编 号 :NCT02331875,NCT01714739,NCT01750580),主要通过同步抗KIR抗体的固有免疫和抗PD1或CTLA⁃4等抗体的获得性免疫以综合评价其抗肿瘤效应。
二、免疫检查点抑制剂临床研究进展
在生理状态下,免疫检查点分子作为一种免疫调节机制具有抑制细胞毒性T细胞功能的作用;在肿瘤微环境中,变异的免疫检查点信号转导通路则是一种重要的免疫逃逸机制。目前,针对免疫检查点的单克隆抗体已获得较好的临床前期结果,如PD1、CTLA⁃4;关于免疫检查点抑制剂治疗胶质母细胞瘤的临床试验正在进行。免疫检查点抑制剂临床试验主要分为以下几类:免疫检查点抑制剂单药治疗、联合用药,以及免疫检查点抑制剂联合化疗、立体定向放射外科(SRS)治疗、靶向其他免疫靶点。
胶质瘤免疫检查点抑制剂的临床试验尚处于早期阶段,大多数试验尚在招募或进行中(表1),仅少量试验公布初步结果。Schalper等[71]对30例胶质母细胞瘤患者(3例原发、27例复发)术前和术后均施以Nivolumab治疗(试验编号:NCT02550249),对这些患者肿瘤微环境的观察结果显示,辅助Nivolumab治疗可使趋化因子转录增强、免疫细胞浸润增多、肿瘤微环境中T细胞受体克隆多样性增加。然而,该项试验在27例复发胶质母细胞瘤患者中未获得显著的生存获益,但3例原发患者中2例生存期达33和28个月,随访至今仍生存[71]。
在常春藤基金会早期临床试验联盟开展的一项多中心随机对照临床试验中,观察免疫治疗对复发胶质母细胞瘤患者的疗效,所纳入的35例患者被随机分为两组,一组手术切除+术前和术后Pembrolizumab辅助治疗,另一组手术切除+术后Pembrolizumab辅助治疗。结果显示,手术前后均接受Pembrolizumab免疫治疗者总生存期(OS)明显优于仅术后接受Pembrolizumab免疫治疗者[72]。
CheckMate⁃143试验(试验编号:NCT02017717)Ⅰ期阶段共纳入40例复发胶质母细胞瘤患者,随机分为Nivolumab组和Nivolumab+Ipilimumab组,结果显示,Nivolumab组患者耐受性良好,而Nivolumab+Ipilimumab组因Ipilimumab剂量过大而影响患者的耐受性[73]。随后的 CheckMate⁃143Ⅲ期试验显示,Nivolumab并未较贝伐单抗显示出更显著的生存获益(中位总生存期9.8个月对10个月)[74],推测该项试验的失败原因可能与所纳入的胶质瘤病列PDL1表达水平过低有关[75]。晚近开展的两项针对原发胶质母细胞瘤患者的临床试验分别为CheckMate⁃498( 试 验 编 号 :NCT02617589)和CheckMate⁃548(试验编号:NCT02667587)。与放射治疗联合替莫唑胺化疗相比,CheckMate⁃498试验所纳入的MGMT非甲基化胶质母细胞瘤患者经放射治疗联合Nivolumab免疫治疗后,并未获得更长的总生存期[76];而与术后同步放化疗继而辅助化疗相比,CheckMate⁃548试验中的MGMT甲基化胶质母细胞瘤患者在Nivolumab辅助治疗后无进展生存期(PFS)并未明显延长,总生存期未到达观察终点[77]。
Lukas等[78]进行的抗 PDL1抗体 Atezolizumab 临床试验(试验编号:NCT01375842)共纳入16例复发胶质母细胞瘤患者,结果显示,Atezolizumab安全性和耐受性均较好;进一步研究显示,外周CD4+T细胞增多和IDH基因突变等可能提示更好的疗效。
三、免疫检查点抑制剂治疗过程中的难点
术后同步放化疗继而辅助化疗可以显著减少外周CD4+T细胞数目,且与总生存期缩短有关[79],从而减少肿瘤Teff细胞,导致免疫治疗的失败。针对胶质瘤小鼠模型的研究显示,抗PD1抗体联合全身替莫唑胺或卡莫司汀(BCNU)化疗组总生存期并未优于单纯替莫唑胺或卡莫司汀化疗组[80]。值得注意的是,局部应用化疗药物联合抗PD1抗体可以有效避免全身免疫抑制。提示在联合免疫治疗的情况下,局部化疗可能优于全身化疗。放射治疗同样可以引起全身淋巴细胞减少,因此,低分割放射治疗和立体定向放射治疗(SRT)是潜在的可以联合免疫治疗的手段[81]。晚近研究显示,低照射剂量的放射治疗或立体定向放射治疗可以导致免疫系统的应答和激活,改善肿瘤微环境,为放射治疗联合免疫治疗建立了基础并值得进一步探索[82⁃83]。此外,血⁃脑屏障也是造成胶质瘤免疫治疗效果欠佳的原因之一,改变给药方式(如对流增强给药)或新型治疗方式[如肿瘤治疗电场(TTF)]均为潜在方法,这些方法是否对免疫系统有影响,能否将“冷肿瘤”转变为“热肿瘤”,能否改善免疫检查点抑制剂的疗效,尚待进一步研究。

表1 近年开展的免疫检查点抑制剂相关临床试验*Table 1. Currently ongoing clinical trials concerning immune checkpoint inhibitors*

续表1
免疫治疗后的影像学改变可能有别于传统的实体瘤疗效评价标准(RECIST)和神经肿瘤反应评价(RANO)标准。研究显示,某些进展性恶性黑色素瘤患者接受Ipilimumab治疗后肿瘤负荷短暂性增加(原发肿瘤灶体积增加或新发肿瘤灶)后再病情缓解[84]。为了避免将此类改变评价为“肿瘤进展”,神经肿瘤免疫治疗反应评价(iRANO)标准在RANO标准基础上增加了对“肿瘤进展”的进一步鉴别,以资与“治疗反应”相鉴别。如果影像学提示肿瘤进展而临床症状6个月内无恶化,则建议继续免疫治疗,3个月后复查MRI,若仍提示肿瘤进展,则3个月前的评价即定义为“肿瘤进展”;如果提示疾病稳定或疾病缓解,则建议继续免疫治疗。
综上所述,免疫检查点抑制剂的问世改善了许多既往预后不良的实体肿瘤患者,如恶性黑色素瘤、非小细胞肺癌、肾癌等,但在胶质母细胞瘤治疗方面尚未显示出显著疗效。本文对免疫检查点分子及其抑制剂相关研究进展进行回顾,相信现有的临床前研究和临床试验能够积累大量的免疫治疗经验,为后续的治疗研究提供借鉴和参考。
利益冲突无

