流式细胞术检测HLA-B27阴阳性判读标准的建立及灰区样本的基因型分析
吴蓓颖, 顾燕英, 范臻佳, 蔡 刚
(上海交通大学医学院附属瑞金医院检验科,上海 200025)
流式细胞术(flow cytometry,FCM)是目前检测人类白细胞抗原(human leukocyte antigen,HLA)-B27最常用的方法,其检测速度较快、通量较大。然而,在实际工作中,许多实验室发现以试剂盒推荐的临界值判断患者HLA-B27的阴、阳性,与患者基因型相对照,会漏检相当一部分HLA-B27阳性的患者[1]。流式反向序列特异性寡核苷酸探针(flow reverse sequence specific oligonucleotide,Flow-rSSO)法分型的错误率为0.159%,低于聚合酶链反应(polymerase chain reaction,PCR)的分型错误率(0.684%)[2]。因此,本研究拟结合FlowrSSO的分型结果来设定FCM检测HLA-B27的阴、阳性判读规则,以及对灰区样本的进一步处理方式,并探讨灰区样本的特性。
1 材料和方法
1.1 研究对象
选取2015年8月—2018年5月上海交通大学医学院附属瑞金医院骨科、伤科、康复科门诊就诊的腰背关节痛患者132例,其中男69例、女63例,年龄17~82岁。
1.2 仪器与试剂
FACSCanto Ⅱ流式细胞仪(美国BD公司)及配套HLA-B27(HLA-B27 FITC/CD3 PE)检测试剂。Luminex 200多功能流式点阵仪(美国One Lambda公司)及配套HLA-B分型试剂。ABI 9700 PCR扩增仪(美国ABI公司)。
1.3 方法
1.3.1 样本采集 采集所有对象静脉血3 mL,乙二胺四乙酸二钾抗凝。抗凝全血2~8 ℃保存不超过1周。分离的样本DNA -18 ℃保存不超过2年,-70 ℃可长期保存,避免反复冻融。
1.3.2 流式细胞术检测 取50 μL抗凝血,加入30 μL HLA-B27荧光抗体,室温孵育30 min,加入2 mL溶血素,室温放置15 min以裂解红细胞,300×g离心5 min,弃上清,用2 mL磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤细胞2遍,加500 μL PBS重悬细胞,上机检测,以CD3-藻红蛋白(phycoerythrin,PE)标记的T淋巴细胞设门,获取10 000个细胞,采用配套软件进行分析,计算细胞HLA-B27的平均荧光强度,与试剂盒提供的临界值进行比较,以低于临界值判定为阴性,高于临界值10以上为阳性,高于临界值0~10判定为灰区。以d值(荧光强度的均值与校准磁珠中位值的差值)大小来判断样本的阴、阳性。
1.3.3 Flow-rSSO法检测 提取每份样本的全血基因组DNA,采用多重PCR进行扩增,将产物与包被了特异性寡核苷酸探针的磁珠杂交,洗脱非特异性结合的DNA,重悬磁珠,采用Luminex 200多功能流式点阵仪检测,并用配套软件分析患者HLA-B位点的基因分型。
1.4 统计学方法
采用Excel 2016及SAS 9.0软件进行统计分析。用GLM相关性分析评估不同型别B27与荧光强度的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 FCM与Flow-rSSO法检测结果的比较
132例患者按FCM试剂盒推荐的阴阳性判读规则得出的HLA-B27结果分别为阴性(d<0)63例(47.74%)、灰区(d值为0~10)45例(34.09%)、阳性(d>10)24例(18.18%)。采用Flow-rSSO法检测132例患者的基因型,结果显示,63例FCM阴性样本中有28例(44.4%)基因型为B27,其余35例均为其他型别的HLA-B基因型;45例FCM灰区样本基因型均为B27,24例阳性样本2种方法检测结果一致,因此FlowrSSO法的阳性率为73.48%(97/132)。
2.2 FCM判读规则的拟定
以Flow-rSSO法检测结果为HLA-B27××作为HLA-B27阳性的判断标准。FCM以可以判定全部结果为非B27的道数为阴性,以可以判定全部结果为B27的道数为阳性,不能明确结果的道数范围拟定为灰区。见表1。
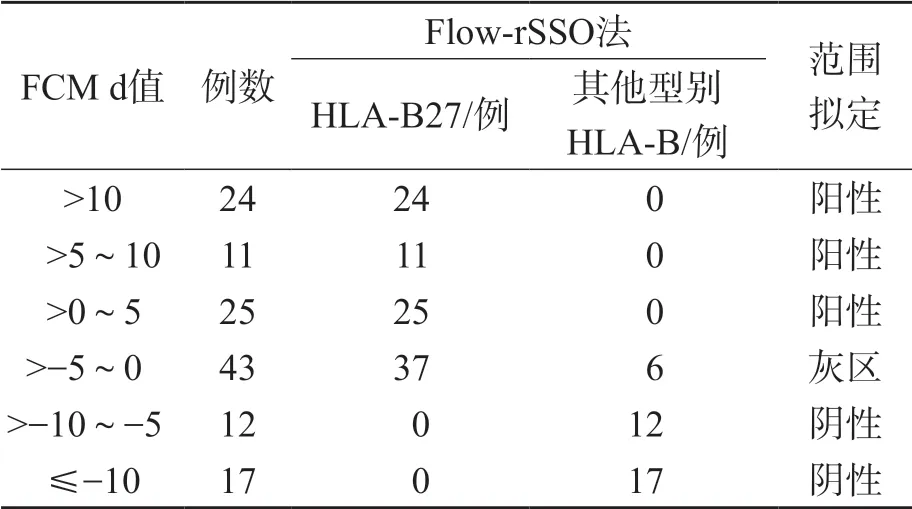
表1 FCM不同d值结果与Flow-rSSO法结果的比较及灰区拟定
2.3 d值重复性实验
选取20个FCM道数分布在83~186范围内的样本进行d值重复性实验,所有样本的检测d值的差值均≤2,故将灰区的d值上、下界限各扩大2。见图1。

图1 重复性实验结果
2.4 3种判定规则判定效能的比较
以Flow-rSSO法基因分型检测的结果作为判读标准,比较FCM试剂盒推荐的阴阳性判定值(0≤d≤10)、拟定灰区判读规则(-5<d≤0)及扩大拟定灰区判读规则(-7<d≤2),以低于灰区的判读规则为阴性,以高于灰区的判读规则为阳性。结果显示,拟定灰区和扩大拟定灰区判定阴、阳性结果的准确性为100%。列入扩大拟定灰区的样本数比拟定灰区增加了19例(14.4%),以HLA-B7、HLA-B37及HLA-B27为主。见表2、表3。

表2 FCM试剂盒推荐判定值与拟定灰区及扩大拟定灰区判定效能的比较 例

表3 拟定灰区与扩大拟定灰区样本的基因型分析例(%)
2.5 HLA-B27各型别d值的比较
采用FCM检测基因型为HLA-B27的样本,其HLA-B27抗原强度并不相同,但按基因分型进行比较,不同基因型别之间的d值差异无统计学意义(P>0.05)。携带的B27的个数不同,其荧光强度的d值差异有统计学意义(P<0.05)。见表4。

表4 HLA-B27不同基因型别d值的差异
3 讨论
强直性脊柱炎(ankylosing spondylitis,AS)是一种慢性炎性脊椎关节病,主要累及骶髂关节及中轴关节,典型的临床表现为炎性腰背痛,致残率较高。由于早期发病隐匿,症状不特异,当确诊时往往已错过最佳治疗时机[3]。有研究结果显示,HLA-B27与AS密切相关,AS患者HLA-B27的阳性率>94%,而正常人的阳性率<10%,因此HLA-B27已成为临床上AS的早期诊断和鉴别诊断的重要辅助指标[4-6]。在国际脊柱关节炎(spondyloarthritis,SpA)评价工作组2009年6月发布的标准中,再次强调了HLA-B27的重要性,相对于传统的AS标准,SpA分类标准将诊断敏感性提升至82.9%,特异性为84.4%[7]。
HLA-B27是目前腰背痛患者的常规检测项目,虽然FCM因操作简单、检测快速、敏感性高及特异性高等优点而被各临床实验室广泛用于检测HLA-B27,但许多实验室发现,FCM检测AS患者的HLA-B27阳性率偏低,与国外文献报道[8]有一定差距。除去影像学错判导致临床误诊为AS外,另一个主要原因可能是HLA-B27 FCM检测结果的判读临界值不合适我国人群,从而导致阳性结果被错判为阴性。本研究结果显示,由于进口试剂盒设置的临界值偏高,导致有44.4%的阴性样本B27结果判定有误,且灰区的设立对阴、阳性的判定帮助不大。
按照FCM试剂盒的使用说明书要求,所有低于试剂盒推荐临界值的样本判定为阴性,高于临界值10的确定为阳性,高于临界值0~10判定为灰区,推荐采用备用方案重新检测[9-11]。本研究发现如果采用FCM试剂盒提供的阴、阳性判断标准,虽然24例阳性样本的Flow-rSSO法结果均为B27,45例灰区样本也均为B27,但在63例阴性样本中有28例(44.4%)Flow-rSSO法检测结果为HLA-B27,此28例患者中有20例未能被明确诊断,有4例虽然FCM检测HLA-B27的结果为阴性,但临床依然作出了AS的诊断,仅有4例患者有其他与AS无关的明确诊断,与SpA分类标准中HLA-B27诊断AS的特异性(84.4%)相近。由此可见,准确的HLA-B27检测结果有助于临床的诊断,错误的结果往往会使临床医生对诊断产生疑惑。基因检测可以说是HLA-B27判定的金标准。采用实时荧光定量PCR对HLA-B27位点进行扩增,可以得出阴、阳性的结论,但是会漏检一些少见型别的B27,如果要囊括全部型别,则会使PCR检测数明显增多,工作量成倍增加[12-13]。Flow-rSSO法可对HLA-B位点进行分型,通过计算机进行大量的数据分析,将不确定度降低至1%,与实时荧光PCR相比,不但准确度有所提高,而且可以对B27阳性的样本作更深入的分型确认,对非B27的样本也能给出具体的型别鉴定结果,因此被不少研究中心作为HLA-B27基因分型的参考标准[14]。
Flow-rSSO法可以对HLA-B位点进行明确分型,但会导致常规HLA-B27检测成本增加。因此,对FCM试剂盒推荐的阴、阳性判读范围进行调整,得到适合本地区患者的判定临界值,采用分型的方法对灰区样本进一步检测,更为经济、高效。
本研究对132例样本的FCM结果进行分析,并以Flow-rSSO法的分型结果作为参考标准,结果显示,将灰区范围定在-5<d≤0时,假阴性与假阳性率都为0,灰区样本HLA-B27的检出率为86.06%。收集20例FCM检测荧光强度分布在各区间的样本,每份样本检测3次,进行重复性试验,结果显示样本d值的最大值与最小值的差值≤2。因此本研究扩大了拟定灰区的范围,上、下界限各扩大2,将其定为-7<d≤2,虽然灰区的样本数增加了9.8%,B27的检出率降至80.65%,但本研究认为这种判定方式可以更好地避免假阴性和假阳性。
本研究中临床未明确诊断为AS,但有AS相关症状的患者共90例。依据FCM试剂盒推荐值判定为阳性的患者有19例;依据FCM试剂盒推荐值判定为灰区的,用扩大拟定灰区直接判定为阳性的有23例,其基因型均为B27;2种方法都判定为灰区而基因型为B27的有9例;依据FCM试剂盒推荐值判定为阴性而本研究判定为灰区,通过进一步检测基因型为B27的有28例。这些相关症状包括但不仅限于腰痛、背痛、胸椎退行性变、骶髂关节炎、膝关节炎、膝关节退行性病变等。由此可见,准确的HLA-B27检测结果对于临床诊断有相当大的辅助作用。另外,有20例临床患者初诊为AS,其样本依据FCM试剂盒推荐的阴阳性判读标准,只有8例为阳性,按本实验室自建扩大灰区标准判读,新增5例灰区样本,基因型检测结果均为B27。
据文献报道,目前已发现HLA-B27亚型160种,依次命名为HLA-B27:01至161(无HLA-B27:22),分别由213个等位基因编码[15]。最常见的亚型为B2705、B2704及B2702,其中B2705是目前所知的所有亚型的原型,存在于所有种族中,而B2704在亚洲人群中为优势亚型[16-17]。本研究对样本的HLA-B位点分型结果作进一步分析,结果显示基因型为B27的样本共97例,检测到的型别有B2702、B2704、B2705、B2707、B2715,杂合子中最多的是B2704 [55例(56.70%)],其次为B2705[34例(35.05%)]。通过分析不同基因型别的HLA-B27抗原的荧光强度,发现杂合子之间的d值差异无统计学意义(P>0.05),而2例B2704纯合子的d值明显高于杂合子(F=6.01,P<0.01)。由此推测影响FCM检测HLA-B27抗原强度的因素是位点个数而非种类。
本研究对在灰区范围内的样本进行基因型分析,结果显示,除HLA-B27外,还有HLA-B7和HLA-B37,这3个型别占灰区样本的96.77%。HLA-B7和HLA-B37的影响均属于交叉反应,其中HLA-B7隶属于交叉反应组[18-19],而HLA-B37则属于非交叉反应组抗原,且与HLA-B27有交叉反应[20-23]。
FCM检测HLA-B27抗原的荧光强度与样本T细胞表面HLA-B27抗原表达量有关,去除基因型的因素后,推测这可能与人种差异有关。因此,进口试剂盒设定的临界值是否适用于我国人群还有待研究,其临界值设定过高,可能会漏诊相当一部分AS患者。不合适的灰区范围可能会造成过多的假阴性,过大的灰区范围又会对导致检测成本和工作量增加。因此,不同地域的实验室在确定HLA-B27的临界值时,可以以检测试剂盒提供的数据为参考,建立合适而准确的灰区范围判断体系,以便在最合理的条件下提高检测准确率。

