肺炎支原体肺炎患儿免疫球蛋白、补体检测的临床意义
陆茹
江苏省兴化市人民医院儿内科,江苏兴化 225700
肺炎支原体(MP)是儿童时期最常见的致病菌,各年龄段儿童均会感染,据不完全统计[1],≥40%的患儿易发展成肺炎支原体肺炎,发病机制尚不明确,可能与呼吸道上皮吸附、炎症损害、免疫系统紊乱等因素有关,且儿童肺部尚未完全发育,感染后常久治难愈、易复发,严重影响患儿的身心发育,病情加重甚至危及生命。近年来研究表明[2-3],MP穿过宿主呼吸道黏膜表面的黏液纤毛层,附着于上皮细胞表面,有毒代谢产物释放、削弱纤毛运动,对呼吸道黏膜上皮细胞造成损害,由此得出MPP疾病进展中,免疫球蛋白发挥着重要作用,因此研究免疫功能、补体指标,利于为临床诊断提供有力的帮助[4],基于上述研究背景,该研究便利选择2019年1—12月该院收治的40例MPP患儿为研究对象,分析肺炎支原体肺炎患儿采用免疫球蛋白、补体检测的临床价值,现报道如下。
1资料与方法
1.1 一般资料
研究对象为便利选取该院收治的40例MPP患儿,设为观察组,男女比例是21∶19;年龄2~5岁,平均(3.58±1.17)岁;病程4 d~2周,平均(1.32±0.14)周;临床表现:发热23例,阵发性刺激性咳嗽17例。另择取同期健康儿童40名设为对照组,男女比例是22:18;年龄2~5岁,平均(3.51±1.12)岁。两组比较,差异无统计学意义(P>0.05)。具有可比性。
观察组纳入标准:符合《实用儿科学(第7版)》[5]中“MPP”的诊断标准;家属签署“知情同意书”;医院伦理委员会审核。排除标准:肺结核、支气管哮喘及其他感染性疾病;溶血性贫血肺外并发症;免疫功能低下者;先天遗传代谢障碍性疾病。
1.2 方法
①采集标本:观察组患儿入院后,急性期(当天未接受抗生素治疗前)、恢复期:晨间、空腹时抽取静脉血各3 mL;对照组体检当天,抽取晨间空腹时静脉血3 mL,按照3 000 r/min速率行离心操作,分离血清、留取标本,放置于零下80℃冰箱内保存,等待检测。
②检测方法及仪器:特定蛋白分析仪(型号IMMAGE 800),免疫散射比浊法(INA)测定血清免疫球蛋白水平、血清补体水平,所用试剂盒由美国贝克曼库尔特有限公司提供,按照试剂盒说明书进行。
1.3 判定标准
急性期:MPP发病≤10 d;恢复期:MPP发病>10 d,影像学检查显示,症状消退、体征平稳且病情明显改善。
判定MPP标准:①患者接受大环内酯类药物治疗≥7 d、症状未有缓解迹象;②患者仍有心动过速、气喘等表现[6];③胸片示,肺段呈大范围片状阴影;④伴有心衰、严重低氧血症等肺外并发症;⑤伴有肺不张、胸腔积液等肺内并发症。重型的判定标准:符合1~3项中的其中2项,符合4~5项的1项。
1.4 统计方法
采用SPSS 22.0统计学软件对数据进行分析,计量资料用(±s)表示,进行t检验,计数资料采用[n(%)]表示,进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同分期MPP与对照组的免疫指标
该研究显示,与急性期比较,恢复期、对照组IgA值较高,恢复期低于对照组;与恢复期比较,急性期、对照组的IgG值较低;与急性期比较,恢复期、对照组的IgM、C3及C4较低,差异有统计学意义(P<0.05),见表1。
表1 不同分期MPP与对照组的免疫指标比较[(±s),g/L]

表1 不同分期MPP与对照组的免疫指标比较[(±s),g/L]
注:t1值、P1值:急性期、对照组比较;t2值、P2值:恢复期、对照组比较;t3值、P3值:急性期、恢复期比较
观察组(n=40)对照组(n=40)t1值P1值t2值P2值t3值P3值组别急性期恢复期0.72±0.24 1.01±0.35 1.58±0.37 12.333<0.01 7.078<0.01 4.322<0.01 IgA 7.37±0.03 10.04±3.47 7.42±0.04 6.324<0.01 4.775<0.01 4.866<0.01 IgG 1.75±0.64 1.37±0.51 1.12±0.59 4.577<0.01 2.027 0.046 2.937 0.004 IgM 1.91±0.42 1.35±0.12 1.26±0.14 9.286<0.01 3.087<0.01 8.108<0.01 0.45±0.17 0.37±0.14 0.32±0.15 3.626<0.01 2.037<0.01 2.297 0.024 C3 C4
2.2 不同病情MPP与对照组的免疫指标比较
该研究发现,观察组重型有12例,轻型有28例,与重型比较,轻型、对照组的IgA值较高,轻型较对照组低;与重型比较,轻型、对照组的IgM值较低,轻型较对照组高;重型IgG、C3及C4值高于轻型、对照组,差异有统计学意义(P<0.05),见表2。
表2 不同病情MPP与对照组的免疫指标比较[(±s),g/L]
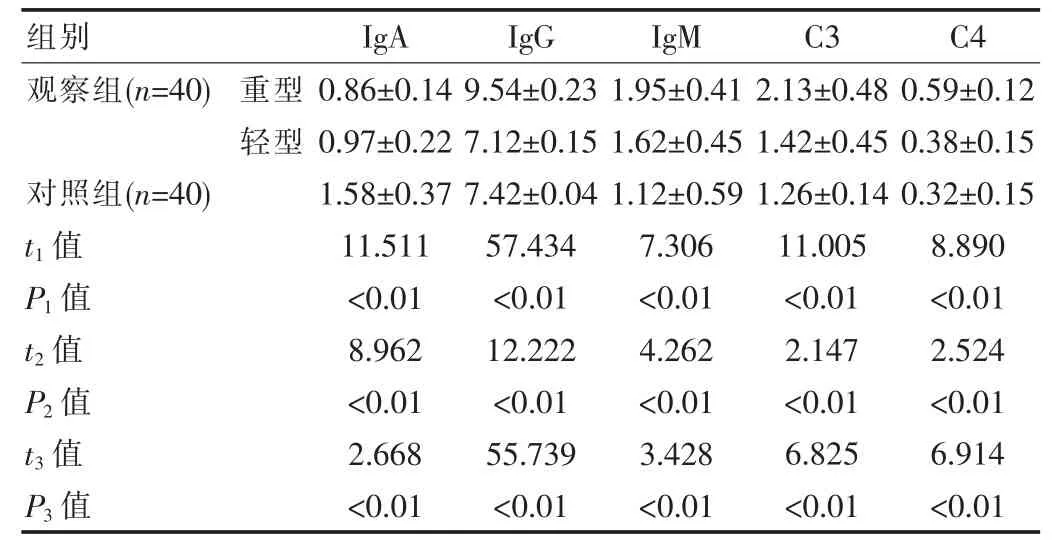
表2 不同病情MPP与对照组的免疫指标比较[(±s),g/L]
注:t1值、P1值:重型、对照组比较;t2值、P2值:轻型、对照组比较;t3值、P3值:重型、轻型比较
观察组(n=40)对照组(n=40)t1值P1值t2值P2值t3值P3值组别重型轻型0.86±0.14 0.97±0.22 1.58±0.37 11.511<0.01 8.962<0.01 2.668<0.01 IgA 9.54±0.23 7.12±0.15 7.42±0.04 57.434<0.01 12.222<0.01 55.739<0.01 IgG 1.95±0.41 1.62±0.45 1.12±0.59 7.306<0.01 4.262<0.01 3.428<0.01 IgM 2.13±0.48 1.42±0.45 1.26±0.14 11.005<0.01 2.147<0.01 6.825<0.01 0.59±0.12 0.38±0.15 0.32±0.15 8.890<0.01 2.524<0.01 6.914<0.01 C3 C4
3 讨论
近年来研究表明[7],MPP患儿受免疫系统发育不全、组织器官功能不成熟、早期无典型症状等因素影响,易发生肺外并发症,甚至危及生命。既往研究显示[8],MPP的发病机制较复杂,与局部肺组织中MP定植、炎症反应有关,随着医疗事业发展,更多研究倾向于免疫学发病机制。郭飞波等[9]学者认为,机体感染MP后,经历免疫逃逸、调节、抑制剂蓄积等过程,细胞因子、免疫之间互相诱导、制约,形成复杂的免疫调节、细胞因子网络,最终诱导疾病发展。
该研究示:①不同分期:与急性期比较,恢复期、对照组IgA值较高,恢复期低于对照组;与恢复期比较,急性期、对照组的IgG值较低;与急性期比较,恢复期、对照组的IgM、C3及C4较低(P<0.05)。②不同病情:与重型比较,轻型、对照组的IgA值较高,轻型较对照组低;与重型比较,轻型、对照组的IgM值较低,轻型较对照组高;重型IgG、C3及C4值高于轻型、对照组(P<0.05),说明该文重型IgA值(0.86±0.14)g/L低于轻型(0.97±0.32)g/L与李晓娟等[10]文献报道中重型IgA值(0.72±0.20)g/L低于轻型(0.89±0.19)g/L结果基本接近,分析如下:①机体感染MP后,出现IgM,其是最早出现的体液免疫抗体,持续升高3~4周后达到峰值,病情逐渐发展,恢复到正常值;②与IgM比较,机体感染MP后出现炎症反应较晚,MP诱导机体发生肺炎支原体肺炎(MPP)疾病后,IgG值在2周左右逐渐升高,5周左右达到峰值;③据不完全统计,血清IgA占免疫球蛋白含量的10%~20%,通常感染2周左右呈升高趋势,因儿童感染MP的重要原因是免疫功能降低,因此多数MPP患儿的IgA值比正常水平更低,使体液免疫功能缺陷加重,且黏膜局部免疫抗体是IgA,呼吸道抗病毒能力下降、感染几率明显增加,进一步证实MPP患儿普遍有免疫功能紊乱状态,主要表现为:过度合成IgM、IgG,缺乏IgA合成,病情加重,机体表现为明显的免疫功能紊乱;④部分研究结果表明,机体感染MP后,通过分泌免疫球蛋白、细胞因子、激活补体系统等形式,发挥免疫应答作用,但持续感染MP后,补体系统的中性粒细胞趋化因子激活,病变部位大量聚集白细胞,释放水解酶,引起局部增生、损害同时大量C3及C4生成,发挥对抗、清除病原体功效,病情达到恢复期,血清C3及C4水平逐渐恢复正常。该文显示患儿病情严重程度与IgA、IgM、IgG及补体水平呈现显著相关,因此对疾病早期诊断、病情评估及治疗,免疫球蛋白、补体的检测具有重要的临床价值。
综上所述,MPP患儿行免疫球蛋白、补体检测可作为参考指标,为病情评估、治疗提供参考数据,具临床可应用性。

