SHP2抑制剂PHPS1对 ApoE基因敲除小鼠动脉粥样硬化斑块及巨噬细胞的影响
于芳 马香书 霍丽静 赵培 马倩 于悦卿 路永刚 帖彦清
心血管疾病由于发病人数多并且逐渐年轻化,危险因素广泛,病程时间长,并发症多,缩短人类的寿命和降低人民生活质量。动脉粥样硬化(Atherosclerosis,AS)是导致心血管疾病的主要病理学基础[1]。巨噬细胞摄取脂蛋白,在细胞内聚积脂质,形成泡沫细胞,释放不同的酶、催化剂、抑制剂和生物活性介质,在动脉粥样硬化的发生发展过程中具有重要作用[2]。在众多细胞胞内信号通路的调节中,蛋白酪氨酸磷酸化与去磷酸化是其中的一种重要方式,其中SHP2(Src homology2 domain-containg protein tyrosine phosphatase 2,SHP2)是蛋白酪氨酸磷酸酶的重要组成部分[3]。在树突细胞及巨噬细胞中,激活dectin-1、dectin-2/3和Mincle受体后,SHP2能被高度磷酸化。在巨噬细胞敲除SHP2基因后,dectin诱导的Syk磷酸化程度明显减弱,进一步与之对应的是它们所诱导的细胞因子和趋化因子的表达下调[4]。已有研究显示,酪氨酸家族在肝脏,肌肉和脂肪组织中参与血管平滑肌细胞(vascular smooth muscle cell,VSMC)的增殖与迁移,SHP2在VSMC中大量增殖[5]。PHPS1作为SHP2的渗透性抑制剂,能够抑制SHP2的磷酸化水平和SHP2介导的细胞功能和多种人肿瘤的细胞系生长[6]。PHPS1是治疗SHP2相关肿瘤及其他疾病的新的突破点,PHPS1的亚硫酸部分可能形成七个格子的氢键连接在SHP2-PTP的环状结构上,破坏SHP2的结构从而抑制SHP2的磷酸化水平[1]。使用SHP2抑制剂PHPS1对于动脉粥样硬化斑块的影响笔者未知,PHPS1能否减少泡沫细胞的产生?本实验通过建立ApoE基因敲除小鼠动脉粥样硬化动物模型,探讨SHP2抑制剂PHPS1在动脉粥样硬化中的发展及其作用机制。通过体外培养RAW246.7,观察使用了PHPS1后,SHP2的表达水平与巨噬细胞的增殖情况。
1 材料与方法
1.1 主要试剂与仪器 p-Shp2抗体(货号:ab62322),p-Syk抗体(货号:ab192587),CD36抗体(货号:133625),显微镜显微镜(型号:ECLIPSE E100)购于尼康仪器(上海)有限公司;PBS缓冲液购自BI生物公司;组织包埋机(型号:EG11508)、石蜡切片机(型号:RM2135)均购自Leica公司;Western Blot电泳槽(型号:DYCZ-24DN型)、转移电泳仪(型号:DYY-7B型)及恒温循环器(型号:WD-9412A型)均购自北京六一生物科技有限公司;制冰机(型号:SIM-F124型)购自日本5ANY0有限公司;实时荧光定量PCR仪器;RAW246.7。
1.2 体内实验方法
1.2.1 动物分组与造模处理:将ApoE基因敲除(ApoE-/-)小鼠给予高脂饲料喂养5周,建立动脉粥样硬化模型并将其随机分为模型组与PHPS1组,每组10只。PHPS1组腹腔注射SHP2抑制剂PHPS1 3 mg·kg-1·d-1,模型组腹腔注射0.9%氯化钠溶液3 mg·kg-1·d-1。注射1次/d,注射20 d。
1.2.2 标本取材与处理:20 d后,在无菌条件、生理压力下,使用异戊巴比妥麻醉小鼠,小心分离主动脉及心脏。4%多聚甲醛固定后石蜡包埋,连续切片。
1.2.3 通过Movat染色分析斑块面积:石蜡切片脱蜡至水,5%硫代硫酸钠 5 min,蒸馏水洗;滴加1%阿尔辛蓝水溶液30 min,蒸馏水洗;预热氨水乙醇中20 min,蒸馏水洗;滴加Weigert苏木精溶液工作液20 min,蒸馏水洗;滴加藏红花/酸性品红工作液15 min,蒸馏水洗;5%磷钨酸水溶液5 min;直接转入1%冰醋酸,蒸馏水洗;95%乙醇;无水乙醇5 min;乙醇藏红花溶液3 min;无水乙醇2 min;常规脱水、透明后中性树胶封片,显微镜下拍照及图像统计分析。
1.2.4 通过天狼星红染色分析胶原所占比例:石蜡切片脱蜡至水,滴加天狼星红染色液3 h,自来水冲洗1 min,常规脱水、透明后中性树胶封片,显微镜下拍照及图像统计分析。
1.2.5 通过免疫组化分别分析巨噬细胞与平滑肌细胞的表达量:切片常规脱蜡至水后用PH 6.0柠檬酸修复液高压修复3 min,保温30 min,H2O2孵育30 min,取出组织的过氧化物酶,山羊血清封闭30 min,封闭天然抗体非特异性表达,滴加一抗Galectin3(abcam 货号1∶200)/SMA(abcam 货号1∶200),4℃过夜,第2天洗涤后滴加辣根过氧化物酶标记的抗兔二抗与抗鼠二抗30 min后DAB显色,苏木素复染细胞核,常规脱水、透明后中性树胶封片,显微镜下拍照及图像统计分析。
1.3 通过Western Blotting检测p-SHP2、p-Syk、CD36蛋白磷酸化水平 小鼠主动脉匀浆后,提取总蛋白,BCA法进行蛋白定量。按照每孔20 μg蛋白量进行加样,SDS-PAGE凝胶电泳初始电压为80 V,待溴酚蓝至分离胶后,加大电压至120 V,继续电泳至溴酚兰达到胶底部位置时结束电泳,分离的蛋白转至PVDF膜,以50 g/L脱脂奶粉进行封闭,分别加入p-SHP2(1∶1 000),p-Syk(1∶500),CD36(1∶1 000)抗体,4℃过夜。第2天洗膜后加入辣根过氧化物酶标记的二抗,室温孵育1 h后洗膜,ECL显影系统定影显色,扫描分析条带灰度值,数目以目的条带灰度值与内参GAPDH(1∶1 000)灰度值的比值代表检测p-SHP2、p-Syk及CD36各蛋白磷酸化水平。
1.4 体外实验方法
1.4.1 通过免疫荧光检测细胞内CD36的表达量:4%的多聚甲醛固定15 min。爬片,首先将贴壁的RAW246.7胰酶消化后制成细胞悬液,将无菌细胞爬片放置于六孔板底部后滴加500 μl细胞悬液,置于5%CO2细胞培养箱孵育2 h使RAW246.7贴于细胞爬片上;培养基加1 200 μl 2%FBS,继续孵育8 h。0.1%Triton进行细胞打孔,双氧水孵育30 min(去除过氧化物酶),含有Tween-20的3%牛血清白蛋白/TBS缓冲液封闭2 h,一抗过夜孵育。第2天,用TBS缓冲液清洗2次,二抗孵育30 min,用TBS缓冲液清洗2次,再用1 μg/mlDAPI复染。在100×的油镜下使用Zeiss显微镜及运用Axio Vision4.8软件对图像进行观测和获取。所有操作步骤都在室温下进行。每次至少检验100个形态学完整的细胞。
1.4.2 荧光微球吞噬实验检测巨噬细胞的内吞能力:①细胞培养与处理:每孔接种细胞7.0×104个/cm2的平板,37℃5%CO2孵育24 h,最佳孵育至50%~70%汇合。取出培养基,将细胞暴露于试验材料中。37℃,5%CO2孵育24 h。②乳胶珠的制备:用蒸馏水和10 000 g的颗粒在室温下洗涤乳胶珠8 min。将乳胶珠重新悬浮于含25 mm Na3PO4(pH值6.0)的3%BSA中,在室温下用浴声法孵育15 min。用含5%胎牛血清的培养基清洗1次。将珠子在浓度为2.0%的培养基中继续培养,4℃避光保存。③化验:实验用6孔板,每孔用15 μl珠料加1 ml培养基。将珠子充分搅拌,取出105 μl,加入7 ml培养基中。在黑暗中,在室温下浸泡10 min(珠子工作液)。每孔用PBS洗2次,换成珠状工作液,6孔板1 ml/孔,12孔板0.4 ml/孔。在37℃黑暗中培养80~120 min。去除珠子工作液,用PBS清洗3次,去除多余的珠子。用刮刀或胰蛋白酶法将细胞提起,并按PBS的要求清洗细胞。用PI(4 μg/ml最终浓度)染色并进行FACS。
1.4.3 通过Western Blotting检测各组细胞中p-SHP2、p-Syk、CD36蛋白磷酸化水平:将细胞制成单细胞悬液,待细胞贴壁后换液,给予ox-LDL刺激。24 h后终止反应,用刮匙将细胞刮下(尤其是培养瓶边缘),加入细胞裂解液,震荡离解细胞,离心后提取上清。BCA测浓度,进行Western blot检测。按照每孔20 μg蛋白量进行加样,SDS-PAGE凝胶电泳初始电压为80 V,待溴酚蓝至分离胶后,加大电压至120 V,继续电泳至溴酚蓝达到胶底部位置时结束电泳,分离的蛋白转至PVDF膜,以50 g/L脱脂奶粉进行封闭,分别加入p-SHP2(1∶1 000),p-Syk(1∶500),CD36(1∶1 000)抗体,4℃过夜。第2天洗膜后加入辣根过氧化物酶标记的二抗,室温孵育1 h后洗膜,ECL显影系统定影显色,扫描分析条带灰度值,数目以目的条带灰度值与内参GAPDH(1∶1 000)灰度值的比值代表检测p-SHP2、p-Syk及CD36中各蛋白磷酸化水平改变。
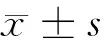
2 结果
2.1 体内实验结果
2.1.1 通过Movat染色分析斑块面积:Movat染色显示PHPS1组动脉粥样硬化斑块面积明显小于模型组,差异有统计学意义(P<0.05)。见图1,表1。
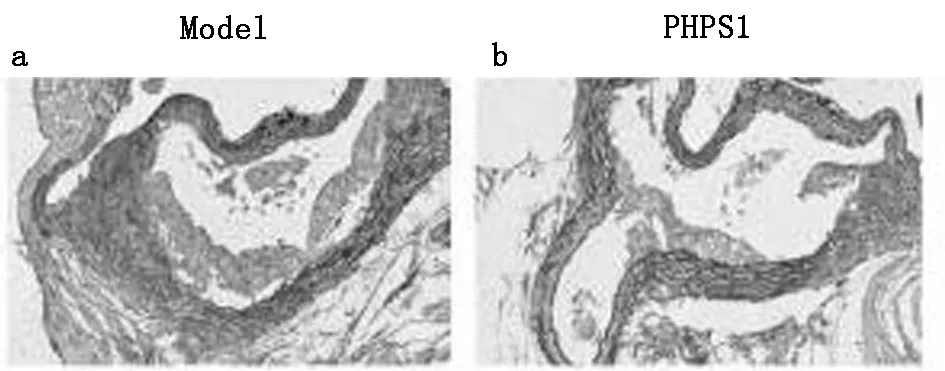
图1 Movat染色分别评估斑块面积、胶原所占比例(×40)
表1 Movat染色分析斑块面积与天狼星红染色分析胶原所占比例

表1 Movat染色分析斑块面积与天狼星红染色分析胶原所占比例
染色方法模型组PHPS1组Movat染色 541 700±36 580 293 200±33 520*天狼星红染色118 600±11 36071 360±5 138*
注:与模型组比较,*P<0.01
2.1.2 通过天狼星红染色分析胶原所占比例:天狼星红染色显示,PHPS1组动脉粥样硬化斑块内胶原纤维的含量较模型组明显减少,差异有统计学意义(P<0.05)。见图2。
2.1.3 通过免疫组化分别分析巨噬细胞与平滑肌细胞的表达量:免疫组化结果显示PHPS1组平滑肌细胞与巨噬细胞较模型组明显减少,差异有统计学意义(P<0.05)。见图3,表2。
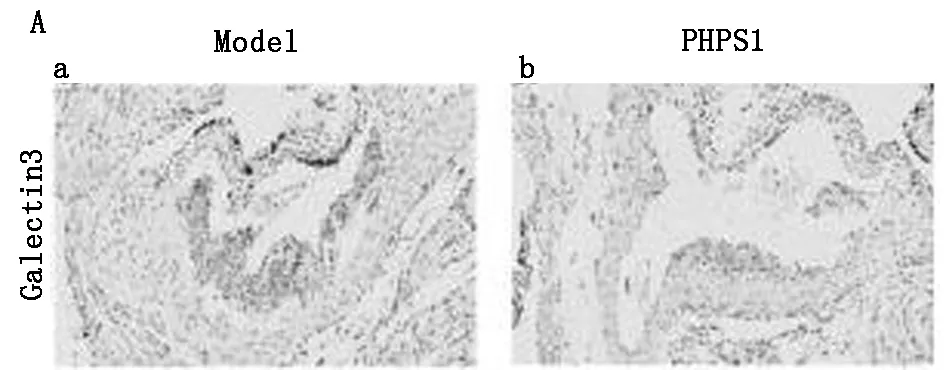
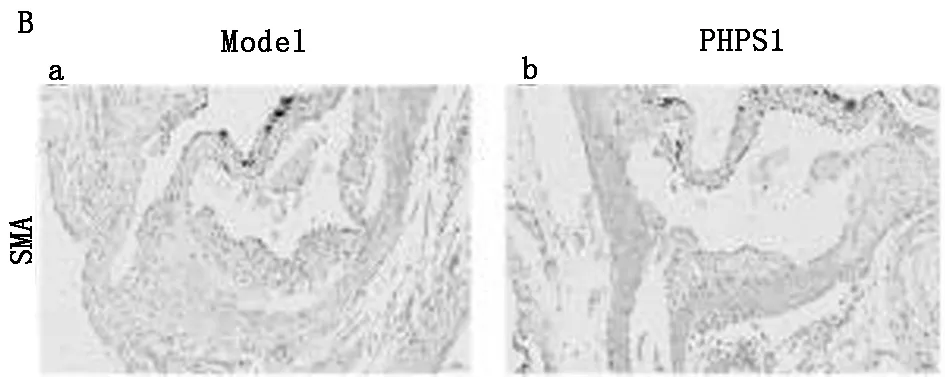
图3 免疫组化分别分析巨噬细胞与平滑肌细胞的表达量(×40)
表2 2组不同染色方法巨噬细胞与平滑肌细胞表达量比较

表2 2组不同染色方法巨噬细胞与平滑肌细胞表达量比较
染色方法模型组PHPS1组Galectin-3染色1 653±238723±72*α-SMA染色 850±68424±61*
注:与模型组比较,*P<0.01
2.1.4 通过Western Blotting检测p-SHP2、p-Syk、CD36蛋白磷酸化水平:Western Blotting检测结果显示,PHPS1组p-SHP2、p-Syk、CD36蛋白的磷酸化水平较模型组均明显降低,差异有统计学意义(P<0.05)。见图4,表3。
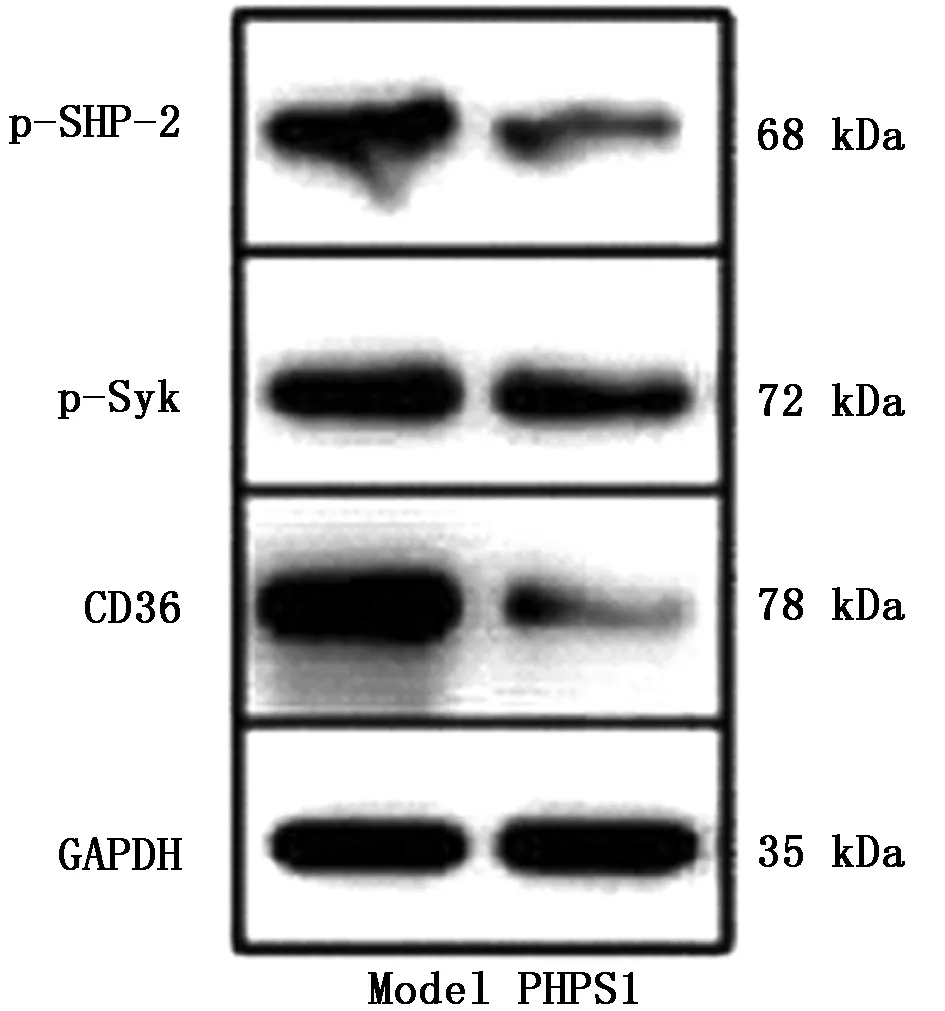
图4 Western Blotting检测p-SHP2、p-Syk、CD36蛋白磷酸化水平
表3 p-SHP2、p-Syk及CD36蛋白的表达水平
2.2 体外实验结果
2.2.1 通过免疫荧光检测细胞内CD36的表达量:PHPS1组巨噬细胞内CD36的荧光强度明显低于ox-LDL组,差异有统计学意义(P<0.05)。见表4,图5。

表4 各组CD36的荧光强度比较
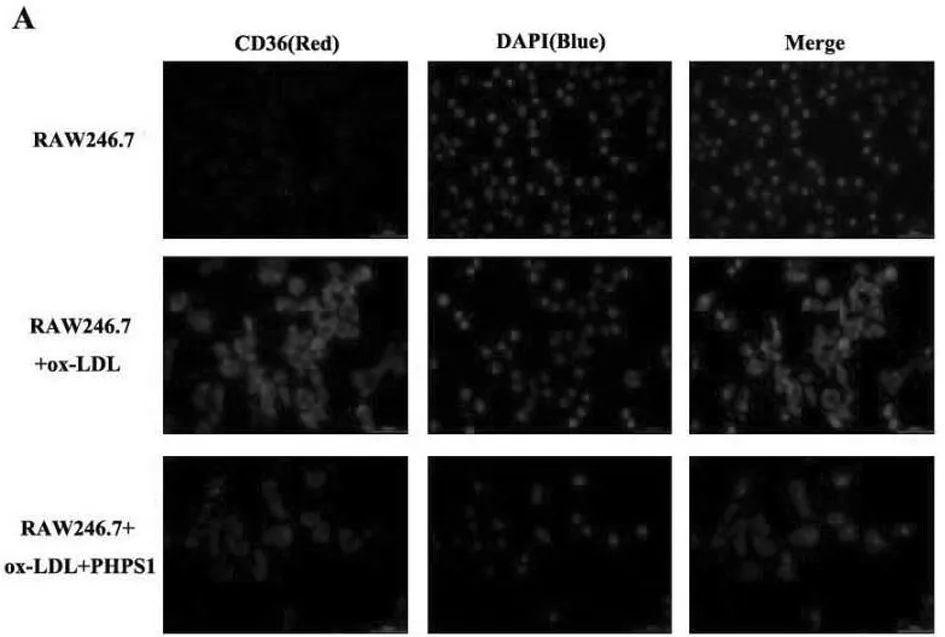
图5 免疫荧光检测细胞内CD36的表达量
2.2.2 通过荧光微球吞噬实验检测巨噬细胞的内吞能力:荧光微球吞噬实验结果显示PHPS1组巨噬细胞荧光强度明显低于ox-LDL组,差异有统计学意义(P<0.05)。见图6,表5。
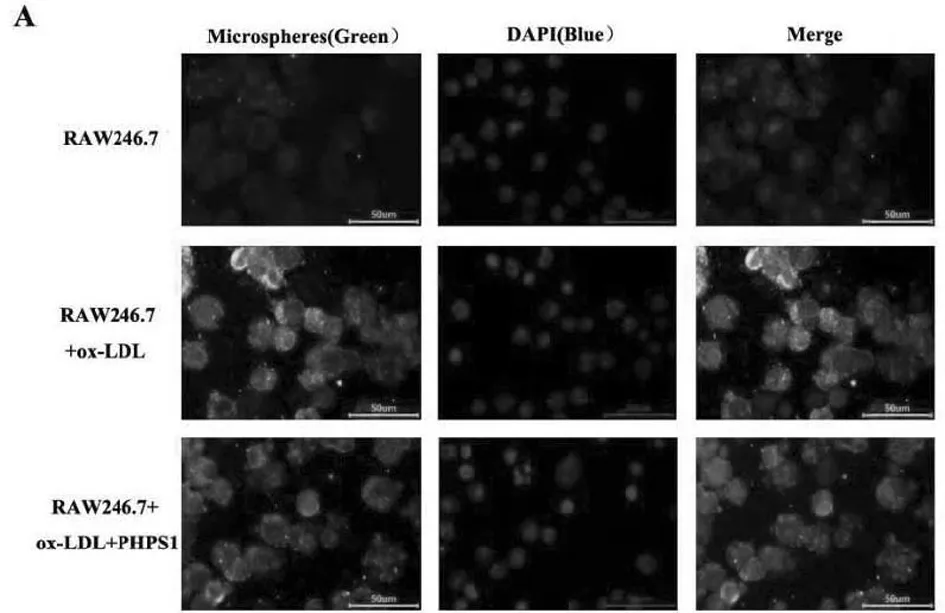
图6 荧光微球吞噬实验检测巨噬细胞的内吞能力
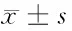
表5 巨噬细胞吞噬荧光微球的含量
2.2.3 通过Western Blotting检测对各组细胞中p-SHP2、p-Syk、CD36蛋白磷酸化水平:Western Blotting检测结果显示,RAW246.7+ox-LDL+PHPS1组p-SHP、p-Syk、CD36蛋白磷酸化水平较RAW246.7+ox-LDL组明显降低,差异有统计学意义(P<0.05)。见表6,图7。
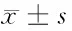
表6 各组p-SHP、p-Syk、CD36蛋白的表达水平
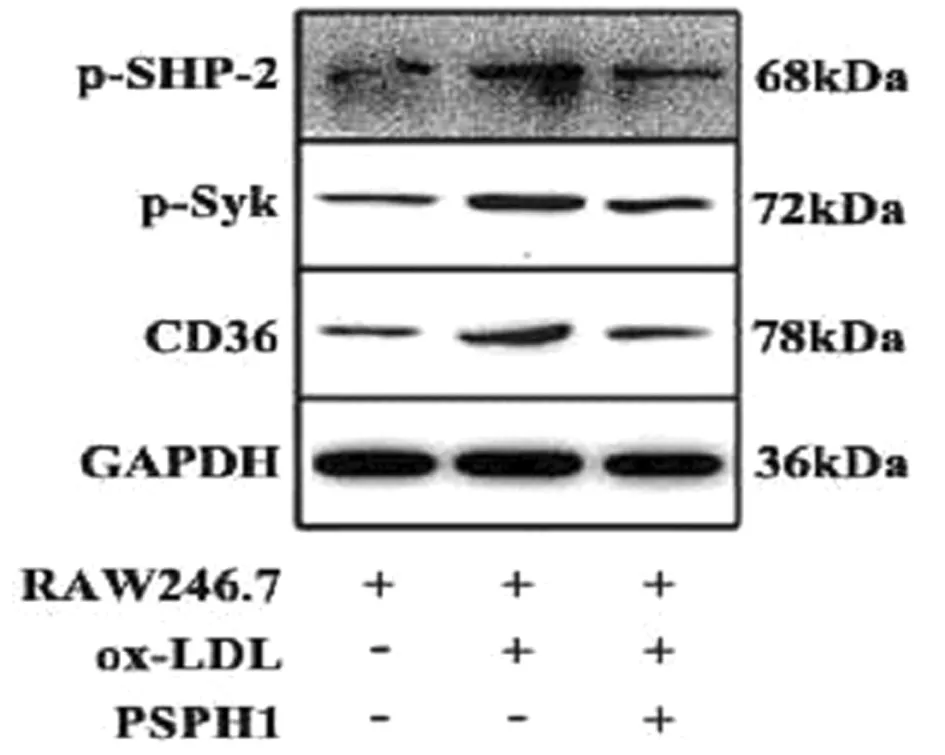
图7 Western Blotting检测3组细胞中p-SHP2、p-Syk、CD36蛋白磷酸化水平
3 讨论
易损斑块是指动脉粥样硬化斑块中发展迅速、具有血栓形成倾向的不稳定性高危斑块,易发生临床不良事件的罪犯病变[7]。在粥样斑块形成的过程中,大量活化的巨噬细胞会产生蛋白水解酶,降解胶原,破坏纤维帽结构,使斑块稳定性下降,更容易发生破裂[8]。SHP2作为酪氨酸磷酸酶之一,对其功能的研究及其在疾病中的作用的研究越发激烈。Chepelenko等[9,10]报告VSMC参与并促进AS的发生发展。实验发现SHP2能够促进VSMC增殖[11,12]。因此本实验以SHP2作为研究靶点,探讨SHP2抑制剂PHPS1对AS及巨噬细胞的影响,已证实SHP2对AS及巨噬细胞的发展进程密切相关,抑制剂PHPS1对于高脂诱导的AS形成及巨噬细胞的吞噬功能有明显的抑制作用。 本实验首先进行造模处理,小鼠高脂饲料喂养,AS发病率高且实验费用低,易于操作,为后续步骤做准备。ApoE能够调控LDL的胞吞作用,其敲除必然会导致AS,乳糜微粒代谢紊乱和清除障碍,从而导致游离胆固醇堆积,脂质代谢紊乱[13]。氧化低密度脂蛋白(oxLDL-C)具有细胞毒性,能够上调巨噬细胞数量并被过度摄取,导致胞内大量胆固醇聚集进而形成泡沫细胞,大量泡沫细胞停留在血管壁内,使AS斑块形成[14]。 蛋白磷酸化与去磷酸化是细胞信号转导的基本事件之一,他们分别受蛋白激酶与蛋白磷酸酶调控,与细胞分化、增殖、移动等过程有关。SHP2是蛋白磷酸酶家族成员之一[15]。SHP2 受到ROS的调控,通过正向调控Syk的磷酸化水平,促进VSMC迁移与内膜增生[16]。刺激因素作用于SHP2后,使得SHP2被磷酸化,激活Syk,巨噬细胞内吞脂质增多,生成大量泡沫细胞。 应用PHPS1后的病理结果:斑块是动脉内膜上积聚的呈黄色粥样的脂质,主要累及大中型动脉。应用PHPS1可抑制粥样斑块形成。血管内皮层存在大量的VSMCs,形成纤维帽起到稳定斑块的作用,在AS形成早期大量存在,PHPS1可抑制VSMCs形成。胶原纤维由VSMCs分泌,PHPS1可抑制胶原纤维形成。AS病理改变的一个重要特点是巨噬细胞在内皮损害部位的聚集,吞噬了脂质的巨噬细胞成为泡沫细胞[17]。应用PHPS1可降低巨噬细胞的内吞功能。巨噬细胞通过CD36摄取大量的OX-LDL形成泡沫细胞,PHPS1可降低巨噬细胞的内吞功能,CD36量也会下降。刺激因素作用于SHP2后,使得SHP2被磷酸化,激活Syk,巨噬细胞内吞脂质增多,生成大量泡沫细胞。应用PHPS1后p-SHP2,p-Syk,CD36表达水平降低。 因此PHPS1通过抑制p-SHP2,影响p-Syk表达从而抑制巨噬细胞内吞脂质形成泡沫细胞,减小斑块面积,减少VSMCs及胶原纤维形成,阻止动脉粥样硬化斑块的形成。本实验证实PHPS1能够起到抗动脉粥样硬化作用。

