健康成人23项常规检验项目的生物学变异分析*
王瑛 蒋筠斐 钟政荣
人体内许多生物学指标在整个个体的生存期内存在变化或波动,有些变化存在可预测的生物学节律,如各种特殊的生理阶段或特殊时间点如儿童期、青春期、老年期的变化,或是白天和夜间等生理变化[1,2],这种由于个体的内环境稳态不同导致的差异被称为个体内生物学变异(CVI)。此外,还有一些变化发生在不同个体之间,这种个体间的生物学差异被称为个体间生物学变异(CVG)。通常认为检测结果的随机变异由个体生物学变异、分析前变异和分析变异(CVA)三部分组成,而生物学变异(BV)又分为个体间生物学变异和个体内生物学变异。最近,欧洲临床化学和检验医学生物学变异联合会(EuBIVAS)发表了生物学变异相关研究的评价标准[3,4],也报道了一系列常规项目的生物学变异评估[5-7],然而这些报道均为个体短期和中期内的生物学变异(多为10周内),而长期跨年度的生物学变异未见报道。本研究拟对健康成人连续五年的个体内和个体间生物学变异进行分析,以期为实验室质量目标的制定提供重要的实验室依据[8]。
材料与方法
1 研究对象 选取连续5年、每年一次定期在本院进行健康体检人员100名,其中男性56名,中位年龄48岁;女性44名,中位年龄39岁。其中部分人员因未连续5年测定某项指标,故部分指标不足100例。纳入标准:根据5年体检中心主检记录显示,所选择个体生活方式基本稳定且固定,平日身体健康,无慢性或复发疾病,无长期用药史;女性处于非妊娠期或哺乳期;所有对象的临床和实验室体检指标均正常。
2 检验项目 包括血液分析项目中的白细胞总数(WBC)、红细胞总数(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、平均红细胞体积(MCV)、平均血红蛋白浓度(MCH)、平均血红蛋白量(MCHC)和血小板计数(PLT)和生化常规项目中的总胆红素(TBIL)、总蛋白(TP)、白蛋白(ALB)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、谷氨酞转肤酶(GGT)、碱性磷酸酶(ALP)、尿酸(URIC)、尿素(UREA)、肌酐(CREA)、葡萄糖(GLU)、甘油三酯(TG)、总胆固醇(CH)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)共23项。
3 主要仪器和试剂 XE-2100/XE-5000血液分析仪及配套试剂、质控品、定标品均为日本Sysmex公司生产;AU5821生化分析仪为美国Beckman Coulter公司生产,生化常规项目使用的检测试剂、标准物和质控物来源见表1。
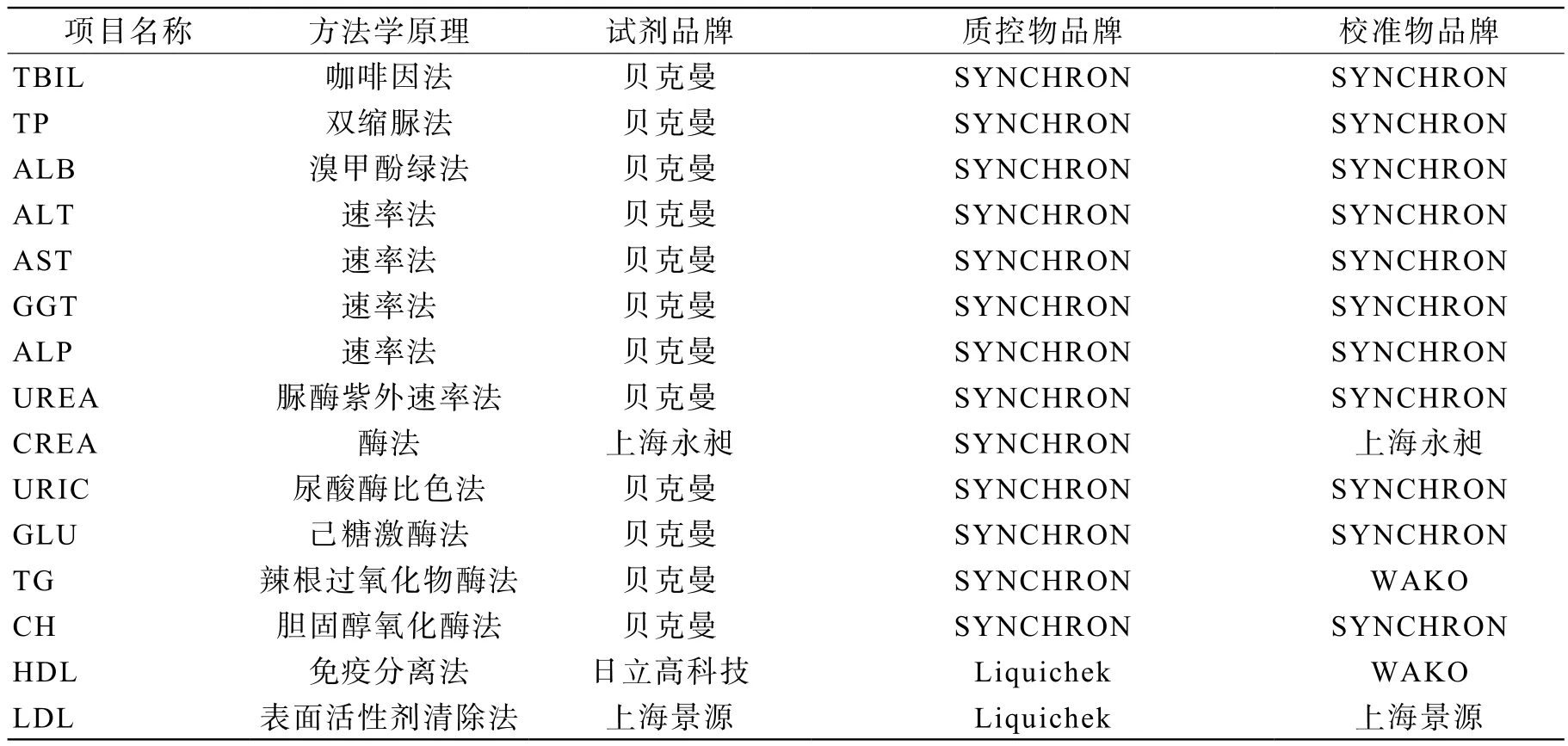
表1 生化常规项目方法学原理、主要检测试剂、质控物和校准物来源
4 标本采集及检测 按照《临床检验操作规程(第4版)》的要求执行。所有体检者统一于清晨7:00~8:00空腹采集静脉血,采集血液后第1管注入含惰性分离胶促凝管,第2管注入EDTA-K2负压采血管,并立即颠倒混匀8次。惰性分离胶促凝管静置30 min,血清分离采用3 000 r/min,离心10 min,在AU-5821生化分析仪上检测相关指标;EDTA-K2抗凝血在XE-2100/XE-5000型血液分析仪上检测血液学参数。所有标本均在4 h内完成检测。
5 统计学处理 应用GraphPad Prism 6.0和SPSS 20.0软件进行数据分析;离群值的识别和剔除为超过±3倍标准差(>±3s),直至全部数据允许接受;分析变异(CVA)为笔者实验室当月该项目室内质控的累计变异系数(CV),CVI和CVG分析参照文献统计[5],均值间比较采用独立样本t检验,P<0.05表示差异有统计学意义。
结 果
1 血液学指标的连续五年生物变异度 8项血液学指标的CVI和CVG与在线Westgard网站的趋势基本一致,且较接近,其中CVI只有WBC大于10%,PLT为8.39%,其余均小于5%;CVG中WBC和PLT超过20%,其余均小于10%;具体结果见表2。图1的均值结果显示,RBC、HGB和HCT有明显的性别差异,男性高于女性(前半为女性,后半为男性),但图2生物学变异(CV)却显示男女几乎无差异,但个别个体某项指标五年的生物变异度较大。在8项血液学指标中,RBC、MCH、PLT的CVI和MCV、MCH、PLT的CVG均小于在线Westgard网站的生物变异度。
2 生化学指标的连续五年生物变异度 表3和图4结果表明,绝大多数生化学指标的五年生物变异明显高于血液学指标,与在线报道基本一致;除了ALT、ALP、TG、CH、HDL、LDL的CVG低于在线数据,其余项目的CVG和所有指标的CVI均高于Westgard报道,而且GGT、ALP、CREA、TG、HDL、LDL的CVI均超出明显。CVI中TBIL、ALT、GGT和TG高于20%,AST、ALP、CREA、UREA、HDL、LDL的高于10%,仅有TP和ALB小于5%;CVG生物变异更大,GGT大于50%,TG和ALT接近40%,GLU、TP和ALB最低,也在5%~10%。图3显示,ALT、AST、GGT、ALP、UREA、CREA、URIC、TG的均值存在着性别差异,有统计学意义;且图4结果表明CREA的生物学变异也存在着明显的性别差异。

表2 8项血液学指标的五年生物变异度

表3 15项生化项目生物学变异分析
讨 论
在临床工作中,经常会遇到患者拿着自己两张不同时间段,不同结果的检验报告要求工作人员解释。为了能给患者一个客观、科学的解释,对检验人员来说,有必要了解常规检验项目中存在的生物学变异。该变异在分析前就已存在,是造成实验结果总变异的一个重要来源。个体内生物学变异是决定实验室指标检测结果准确性和可靠性的重要因素之一,临床检验分析质量目标设定中标本的生物学变异是临床检验质量管理中的重要问题。国际专家近年已就此问题达成共识,提出目前主要检验分析质量指标设定方式,并根据与临床需要关系密切程度做出排序。其中,根据生物学变异设定检验分析质量指标,在客观性和实用性等方面具有明显特点,受到广泛重视或被广泛接受,已越来越多地用于内部或外部质量控制或评价等临床检验质量管理工作中。临床医生在判断检验结果时,不单纯要考虑检验项目的参考范围和分析变异,更应该考虑项目的生物学变异,这样才能对检验结果有客观的分析。
个体间检测结果随机波动包括分析前变异、分析变异和个体生物学变异三部分。本次研究对象均来自体检中心,采血前的注意事项交流充分、采血时间和采血人员恒定,因此视分析前变异为恒定或最小,即假设分析前不确定度为零,仅考虑存在分析变异和个体生物学变异;此外,体检中心所有对象的临床和实验室检测结果获取方便,且多数为健康者,为本研究结果的可靠性提供了保证。目前生物变异分析方案并没有统一的规范,但现有的文献报道[6,9-11],个体生物变异分析多来源于30例个体,人数偏少,为此,笔者收集了100例的正常体检人群(排除了临床和实验室检查指标异常者),其中HDL和LDL因部分人员连续五年的数据不完整而不足100例。
本研究结果显示,不同检验项目生物学变异各不相同,CVI从MCH的1.26%到TG的26.42%、CVG从MCHC的2.49%到GGT的52.98%,多数生化学指标的生物学变异明显高于血液学指标,与Westgard数据库公布的数据比较,本研究的全部血液学指标和大多数生化学指标的趋势一致和接近,但多数指标的CVI和CVG均高于在线数据,尤其生化指标中的GGT、ALP、CREA、TG、HDL、LDL的CVI均明显高出Westgard数据库在线数据,本研究血液学指标的生物变异也高于Buoro[12]和Cokun[11]等的报道,生化酶学指标也高于Carobene等的报道[10,13]。这可能与本研究的数据是收集连续五年的健康体检者的长期研究,而目前报道的均为短期和中期(多数为10周)研究,以及研究对象人数较少。当然,本研究也有一些指标的生物变异低于Westgard在线数据,如RBC、MCH、PLT的CVI和MCV、MCH、PLT、ALT、ALP、CH、HDL、LDL的CVG。由于Westgard在线数据只提供每个指标总的生物学变异,并没有性别区分,笔者的研究也提示,尽管一些指标的均值存在性别差异(如RBC、HGB、ALT、CREA等),但大多数指标的不同性别的生物学变异却无统计学意义,然而生化指标中也有少数项目在性别方面的生物学变异存在统计学意义(如ALT、GGT、UREA和CREA),尤其是CREA,差异明显(P<0.001),具体原因有待于进一步分析或验证。
总之,造成生物学变异的原因较多,有些因素如年龄、地域、生活环境等,因此,实验室在建立质量目标时,应充分考虑生物学变异的存在,在实际工作中,检验人员应充分认识生物学变异造成的检验结果波动,在进行结果解释时也应考虑生物学变异的存在。本研究从长期连续五年、100名健康成人常规23项检验指标的生物学变异进行分析,丰富了数据库中没有长期生物学变异的不足,为实验室质量目标的科学制定提供了重要的实验室依据。