老年慢性肾脏病患者外周血中性粒细胞/淋巴细胞比值与超敏C反应蛋白及心脏瓣膜钙化的相关性
王云丹,王应灯
上海交通大学医学院附属第九人民医院肾脏科,上海200011
慢性肾脏病(chronic kidney disease,CKD) 全球患病率高达11%~13%,已成为一个全球性健康问题[1]。心血管疾病是CKD 患者的最主要死因[2]。心脏瓣膜钙化(cardiac valvecalcification,CVC) 和动脉粥样硬化都是CKD 患者常见且严重的并发症,老年CKD 患者发生CVC 的风险更高,且极易导致心律失常、心肌缺血、心力衰竭和猝死等。近年众多研究表明,CKD患者体内普遍存在的微炎症状态与心血管疾病的发生密切关联。目前研究普遍认为,C-反应蛋白(C-reactive protein,CRP)尤其是超敏C 反应蛋白(high-sensitivity C-reactive protein,hsCRP)是全身动脉粥样硬化的标志物,常用于心血管疾病危险分层,hsCRP<1 mg/L、1~3 mg/L 和>3 mg/L 分别提示较低、中等或者较高的相对心血管风险[3]。中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)代表体内中性粒细胞和淋巴细胞数量之间的平衡,有研究表明在肿瘤、心脑血管疾病中NLR 可作为炎症指标,用于预测疾病的发生、发展和结果[4-6]。本研究讨论老年CKD患者NLR 与hsCRP 及CVC 的相关性,旨在探讨NLR在老年CKD 患者炎症评估及预测心脏瓣膜钙化中的作用。
1 资料与方法
1.1 一般资料 选取2017年1月—2018年4月于上海交通大学医学院附属第九人民医院肾脏科住院、年龄≥60 岁且符合2012年KDIGO 指南CKD 诊断标准[7] 的非透析患者,采用简化MDRD 公式计算肾小球滤过率(GFR)并进行CKD 分期。纳入标准:年龄≥60 岁、CKD 诊断明确;排除标准:有瓣膜置换术、恶性肿瘤、肾移植手术、血液系统恶性疾病、近3 个月内感染或使用抗生素、长期使用激素或免疫抑制剂的患者。本研究经过医院伦理学备案,研究对象均知情同意。
1.2 研究方法
1.2.1 一般资料和血液检查 收集所有患者的人口学资料,肾脏原发病及既往史、个人史,包括吸烟史、高血压、糖尿病史等。血液检查结果,包括hsCRP、血清白蛋白(Alb)、尿素(BUN)、肌酐(Scr)、尿酸(UA)、总胆固醇(TC)、三酰甘油(TG)、高密度胆固醇(HDL-C)、低密度胆固醇(LDL-C)、钙(Ca)、磷(P)、镁(Mg),均应用东芝TBA-120FR 全自动生化仪检测,全段甲状旁腺激素(intact parathyroid hormone,iPTH)应用西门子ADVIA Centaur XP 全自动免疫分析系统利用化学发光法检测,全血细胞分析应用Sysmex XT-4000i 全血细胞分析仪检测。根据中性粒细胞计数、淋巴细胞计数结果计算NLR,根据Alb、Ca 水平计算校正钙(CsCa)。
1.2.2 超声心动图检查 使用超声心动仪(GE VIVID 7 pro,2.5~4 mHZ 探头)进行超声心动图检查,CVC定义为:主动脉瓣或二尖瓣出现1 个以上强回声。根据患者超声心动图结果有无CVC 进行分组。
1.3 统计学分析 采用SPSS20.0 软件进行统计学分析。符合正态分布的计量资料采用均数±标准差(±s)表示,比较采用独立样本t 检验。非正态分布计量资料采用M(1/4,3/4)表示,比较采用非参数秩和检验。相关性检验采用Spearman 相关性分析。采用Logistic回归分析老年CKD 患者CVC 的危险因素。P<0.05 为差异有统计学意义。
2 结果
2.1 CVC组与非CVC组 共纳入134 例CKD 非透析患者,年龄60~95 岁,其中男性74 例,平均年龄(76.6±9.8)岁;女性60 例,平均年龄(78.3±9.4)岁,134 例中,CKD 3~5 期患者93 例(69.4%)。原发病包括糖尿病肾病48 例(35.8%),慢性肾小球肾炎46例(34.3%),高血压肾病22 例(16.4%),其他4 例(3.0%),不详14 例(10.4%)。CVC组NLR 高于非CVC组(2.52±0.96)vs(1.89±0.77),P<0.01。CVC组年龄、hsCRP 高于非CVC组,Alb、TC、Ca 水平低于非CVC组。见表1。
2.2 糖尿病组与非糖尿病组 糖尿病组NLR、Scr、HDL-C、P、iPTH 低于非糖尿病组,Hb、GFR、TG、Ca 高于非糖尿病组。见表2。
2.3 NLR 与hsCRP 及其他临床指标的相关性 对入组患者进行Spearman 相关分析,结果显示:NLR 与年龄、WBC、hsCRP、BUN、Scr 呈正相关,与Hb、Alb、GFR、TC、TG 呈负相关。见表3。
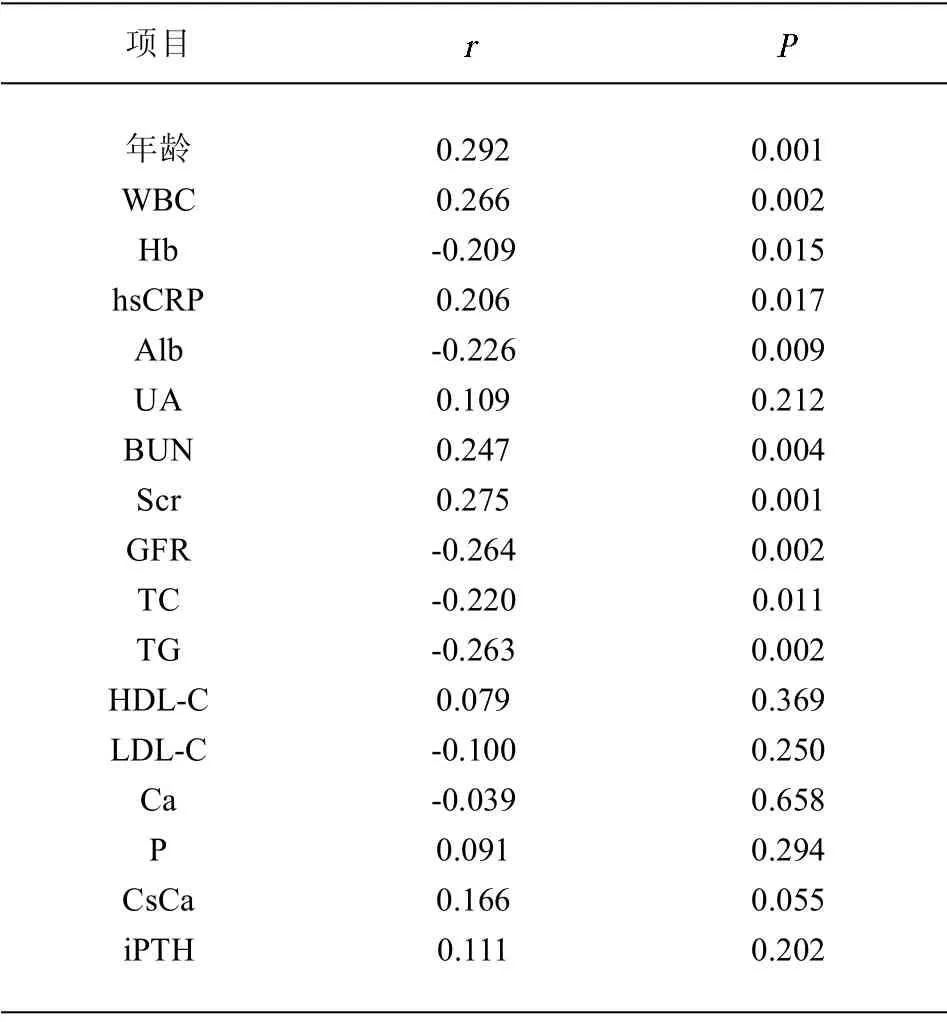
表3 老年CKD 患者NLR 与实验室及临床指标的Spearman 相关分析
2.4 CKD 患者CVC 的Logistic 回归分析 以心脏瓣膜有无钙化为因变量,性别、糖尿病、高血压、吸烟史及各临床指标为自变量,将年龄根据是否≥80 岁分层,逐个进行单因素Logistic 二元回归分析。分析显示,高龄(≥80 岁)、高NLR、低Alb、低Ca 是老年CKD 患者CVC 的危险因素(P<0.05)。见表4。
以心脏瓣膜有无钙化为因变量,采用Logistic 回归向前逐步法,引入判别标准P<0.05,剔除标准P>0.1。结果发现NLR 水平升高是CVC 的独立危险因素(OR=2.182,95%CI 1.109~4.290,P=0.024)。
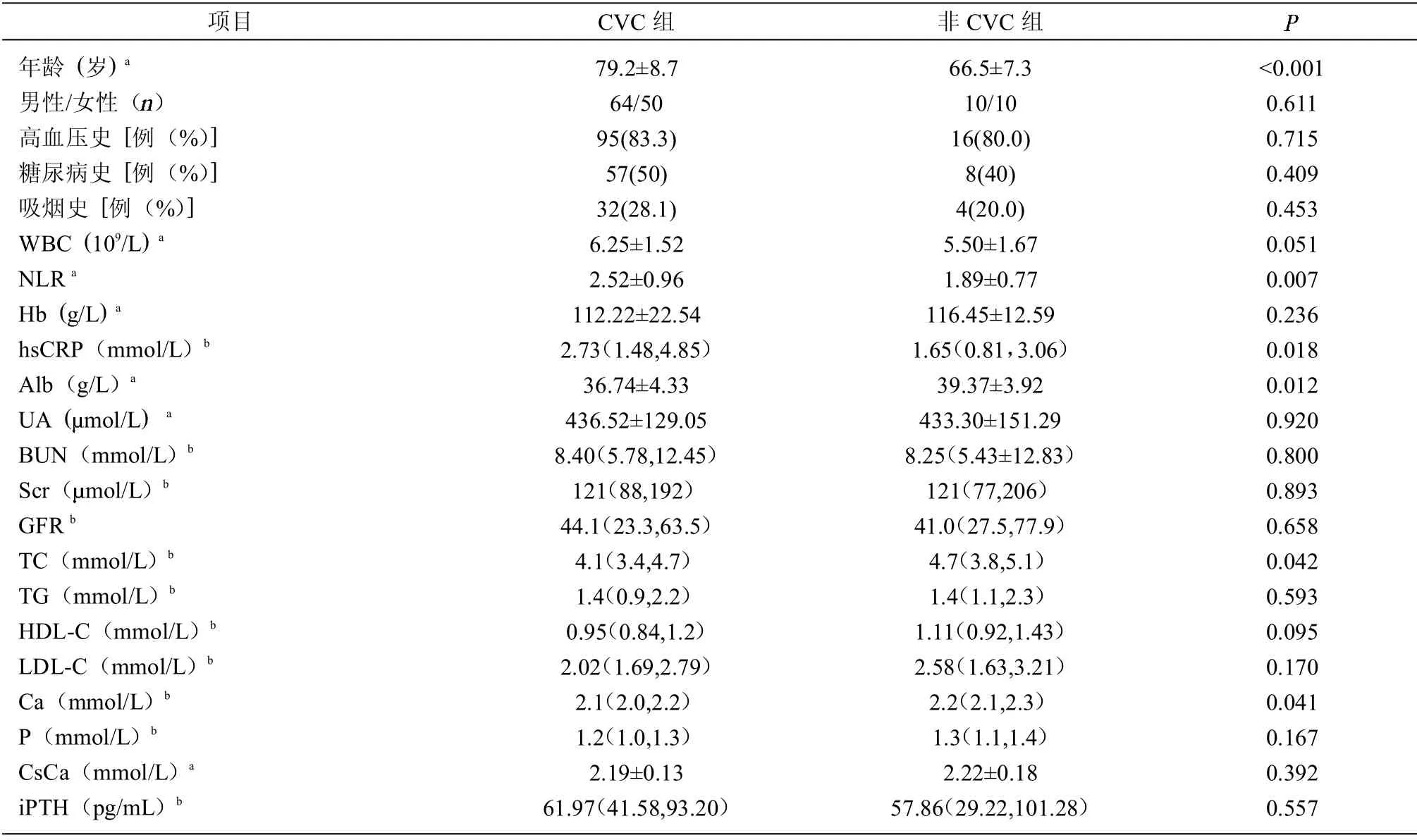
表1 老年CKD 患者CVC组与非CVC组资料比较
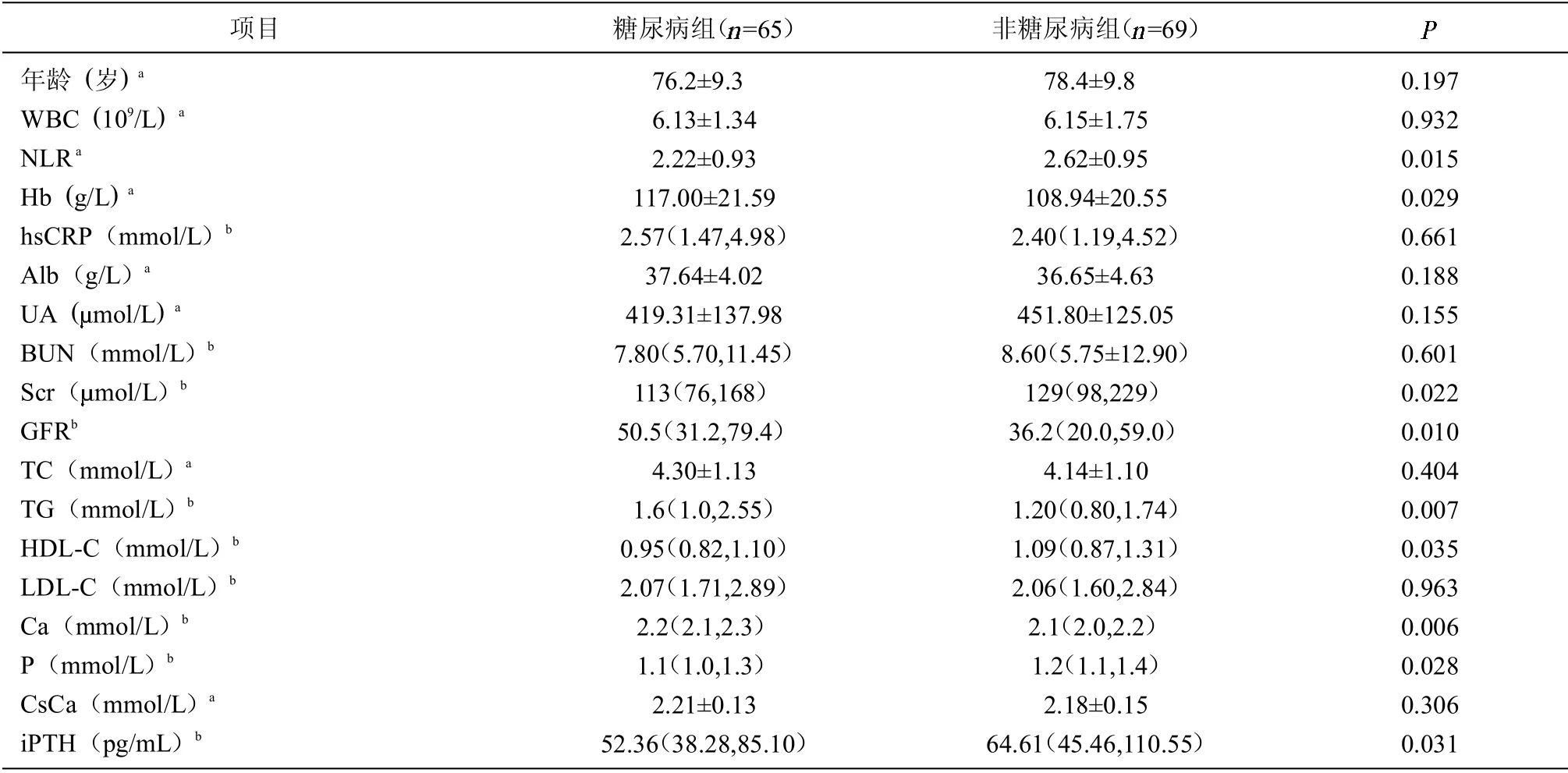
表2 老年CKD 患者糖尿病组与非糖尿病组资料比较
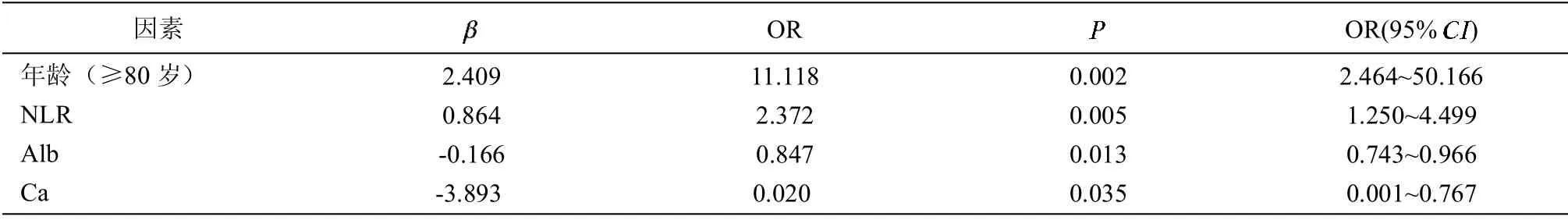
表4 老年CKD 患者CVC 的单因素Logistic 回归分析
3 讨论
多种炎症细胞因子白细胞介素1(IL-1)、白细胞介素6(IL-6)、白细胞介素8(IL-8)、肿瘤坏死因子以及hsCRP 可作为微炎症反应状态客观、敏感的指标。这些指标的轻度升高与促钙化因子呈正相关关系,从而说明微炎症状态可能具有促进钙化的作用。既往研究显示,hsCRP 在CKD 患者中升高[8]。在非透析的CKD 患者中,有CVC 者较无CVC 者冠心病的患病分析升高,CVC 与CKD 患者中冠心病的患病和严重程度相关[9]。在本研究中,CVC组患者hsCRP 水平高于非CVC组。CRP 水平受细胞因子IL-1、IL-6、TNF-a 的调节,它的升高与动脉粥样硬化等慢性炎症状态相关[10]。NLR 获取容易、计算简便,已有研究证实在普通人群中NLR 与全因死亡率、冠心病和心力衰竭相关[6]。在本研究中,CVC组患者NLR水平高于非CVC组,且NLR 水平升高是老年CKD患者CVC 的独立危险因素。NLR 升高表示中性粒细胞计数相对增多,而中性粒细胞释放的基质金属蛋白酶(matrix metalloproteinases,MMPs)可通过瓣膜间质细胞凋亡和成骨促进CVC。CVC组患者年龄显著高于非CVC组,年龄是CVC 的危险因素,特别是在年龄≥80 岁人群中CVC 患病率更高。CVC组Alb、TC 水平较低,说明营养不良是老年CKD 患者促进CVC 的因素。
在糖尿病患者中,既往研究发现NLR 是糖尿病肾病、心血管不良事件和心血管死亡率的独立预测因子[11]。近年来关于NLR 与糖尿病、糖尿病大血管和微血管并发症的发生及严重程度的关系也已引起关注。NLR 升高与早期糖尿病肾病相关,NLR 值升高可能是早期糖尿病肾病的预测指标[12]。有研究提示NLR 水平升高与2 型糖尿病患者HbA1c 升高和血糖控制不良有关[13-14]。而在本研究的患者中,糖尿病组NLR 低于非糖尿病组,而NLR 与年龄、Scr 呈正相关。本研究对象为老年CKD 患者,且以GFR 下降患者为主,所以推测在肾功能下降的老年糖尿病患者中,NLR 升高并不能很好地作为一个预测指标来提示血糖的控制情况,需同时考虑肾功能下降程度及年龄的影响。这与文献的研究结果不一致,文献研究对象为非CKD 及早期糖尿病肾病患者,可能有一定的差异。本研究同时发现糖尿病组iPTH 低于非糖尿病组,原因可能是血糖控制不佳者iPTH 分泌易受高血糖浓度抑制[15]。
hsCRP作为炎症指标评价机体的全身炎症状态已被广泛应用。本研究结果表明NLR 水平与hsCRP 水平呈正相关,提示NLR 亦可能在老年CKD 患者中作为炎症指标提示患者的炎症情况。研究表明,NLR 升高的CKD 患者GFR 下降明显,在对CKD4 期患者的研究中发现,NLR 升高者有较高的CRP 基线和较快的肾功能下降并进入终末期肾脏病[16]。在以透析或死亡的终末期肾病为终点的一项研究中,结果也提示了NLR 与肾功能下降有关,NLR 可能预测CKD 患者预后[17]。在本研究中,NLR 水平与BUN、Scr 水平呈正相关,与Hb、Alb、TC、TG 水平呈负相关,可能与肾功能下降及患者营养状况有关。
综上所述,在老年CKD 患者中NLR 与hsCRP 水平相关,NLR 水平升高可能提示机体的炎症情况,是老年CKD 患者CVC 的独立危险因素。NLR 可以通过血常规检测来计算,是临床常用的检测指标,有助于临床对于老年CKD 患者炎症状态的评估,但NLR在老年CKD 患者中评估炎症、预测CVC 的切点值及是否能更好更方便预测心血管钙化和CKD 的进展,还有待进一步研究探索。

