水溶液中离子平衡考查的主角
———二元弱酸
王开山
水溶液中的离子平衡是中学化学重要的基础理论,也是学习的重点、难点和高考考查的热点.纵观近年相关试题,笔者发现,二元弱酸及其盐成为考查的主角.其原因主要是二元弱酸及其盐既存在电离也存在水解,水溶液中离子种类多,离子浓度随外界条件的改变处于动态变化中,能够设置灵活的问题来考查学生思维的深度及变化观念和平衡思想.笔者结合相关高考试题,针对试题特点及解答突破口作简要分析.
1 试题特点
1)常见二元弱酸(H2S、H2CO3、H2C2O4等)和二元弱酸正盐或酸式盐(Na2S、NaHCO3、NaHC2O4等)是试题信息承载的主角.
2)试题信息主要以量化数据为主,呈现方式多样.有电离常数、溶液的pH、离子浓度、坐标图(直线型或曲线型)等.
3)问题设置灵活、考查角度广.主要有一定pH下离子浓度大小的比较、溶液中离子浓度之间的定量关系、平衡常数的计算、相应离子方程式的书写等.
2 解答突破口
笔者认为,抓住变化中的不变是解决水溶液中离子平衡问题的关键,是一种解决复杂问题的方法和思想,也是一种辩证关系的体现.解答水溶液中二元弱酸类离子平衡问题时,除了需要掌握扎实的电离平衡、水解平衡等相关基础知识外,更主要的是要抓住变化中的不变,能从繁杂的变化信息中看到不变的电离常数和守恒关系,做到精准施策,高效解答.
突破口1电离常数.
弱酸的电离常数是衡量弱酸电离出H+能力的尺度.二元弱酸的电离常数包括第一级电离常数Ka1和第二级电离常数Ka2.对于确定的二元弱酸,只要温度不变,其电离常数是不变的.根据电离常数的表达式可以解答以下问题.
1)依据微粒分布坐标图求算电离常数.

2)依据电离常数求算微粒分布坐标图中某点的pH.

3)依据电离常数推导酸式强碱盐溶液的酸碱性.
二元弱酸的酸式强碱盐溶液有的呈酸性,有的呈碱性.根据电离常数和水的离子积常数推导出相应离子的水解常数,可以判断二元弱酸酸式强碱盐溶液的酸碱性.
现以NaHCO3为例进行推导说明:
常温下,H2CO3的电离常数
Ka1(H2CO3)=4.45×10-7,
Ka2(H2CO3)=4.69×10-11.

常见呈酸性的溶液有NaHSO3、NaHC2O4等;呈碱性的溶液有NaHS等.
突破口2守恒式.
守恒是一种定量认识事物的方法和解决问题的思维.守恒观也是中学化学重要的化学观念之一.
水溶液离子平衡中的守恒主要有电荷守恒、元素守恒(物料守恒)和质子守恒.
电荷守恒表明了电解质溶液呈现电中性的性质.只要电解质溶液中离子种类不变,电荷守恒式就不变.守恒式中只出现离子.
元素守恒表明了电解质溶液中指定元素之间的定量关系.守恒式中离子、分子都可能出现.
质子守恒表明了电解质溶液中质子转移守恒.复杂溶液的质子守恒可以通过电荷守恒和元素守恒推导.
守恒式或守恒式之间的联立是解答电解质溶液中离子浓度大小关系以及溶液酸碱性的重要突破口.
3 典例赏析

Ka1(H2C2O4)=5.4×10-2,
Ka2(H2C2O4)=5.4×10-5.

A. 0.100 0mol·L-1H2C2O4溶液:

B. c(Na+)=c(总)的溶液:

D. c(Na+)=2c(总)的溶液:


由题意知, 0.100 0mol·L-1=
两式整理得

选项A正确;

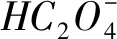

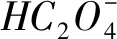
滴入NaOH溶液后,溶液中的电荷守恒式为
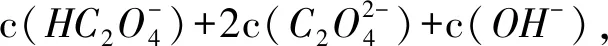
室温pH=7时,c(H+)=c(OH-),则

由于滴加溶液后体积变大,

选项C错误;
当c(Na+)=2c(总)时,溶液中的溶质为Na2C2O4,溶液中电荷守恒式为
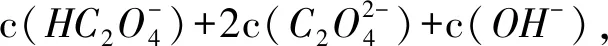
物料守恒为
两式整理得
选项D正确.答案为A、D.



图1
下列叙述错误的是( ).
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(H+)
分析本题基于图象考查一定pH下离子浓度的大小关系及相应弱电解质的电离常数.通过分析一定pH下的曲线高低可以解答离子浓度大小的问题,根据电离常数的表达式及交点的pH可以计算弱电解质的电离常数.

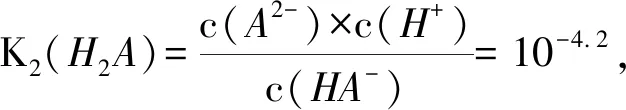
则lg[K2(H2A)]=-4.2,选项B正确;由图象可知,pH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知c(HA-)>c(H2A)=c(A2-),选项C正确;pH=4.2时,c(HA-)=c(A2-),但此时c(H2A)≈0,如体积不变,则
c(HA-)=c(A2-)=0.05mol·L-1,
c(H+)=10-4.2mol·L-1,
如体积变化,则不能确定c(HA-)、c(A2-)与c(H+)浓度大小关系,选项D错误.答案为D.

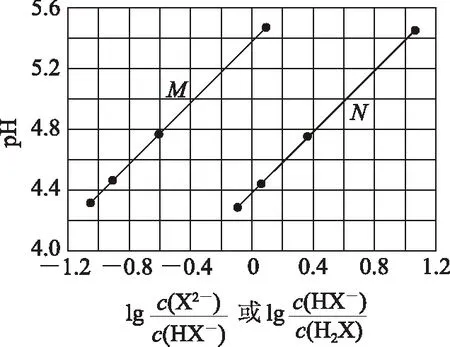
图2
A. Ka2(H2X)的数量级为10-6
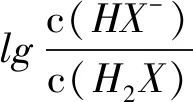
C.NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
分析该题综合性强,涉及了电离常数的计算、不同直线所表示的意义、强碱酸式盐的酸碱性,离子浓度大小关系等.解答的突破口主要是二元弱酸的分步电离特点及电离常数和水解常数的表达式.




分析一定温度下,弱电解质的电离常数是不变的,抓住电离常数表达式就可快速解答该类型试题.

可知当氨水的浓度为2.0mol·L-1时,溶液中


笔者认为,解答水溶液中与二元弱酸有关的试题时既要明晰变化,关注信息的呈现方式,也要抓住不变,围绕常数和守恒两个突破口思考,最终高效解答相关试题.

