理解滴定原理 快速定量计算
秦宗余
近年来高考试题中化学计算的考查难度有所下降,大多以真实的工业生产情境或实验情境中滴定分析的已知数据作为条件进行计算.其中,滴定型定量计算在高考中最为常见,是一种集实验、原理、计算于一体的综合性题目,要求学生在充分理解滴定原理的基础上,找出某些微粒之间的关系式,再依据相关条件和原理进行快速计算.现将近几年高考常考滴定类型计算的试题小结如下.
1 常见滴定类型的计算
1) 酸碱中和滴定:用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法.

步骤Ⅰ:移取xmL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL.
步骤Ⅱ:移取ymLBaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ中相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.BaCl2溶液的浓度为________mol·L-1.

bmol·L-1×V0×10-3L=10-3bV0mol.
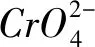
bmol·L-1×V1×10-3L=10-3bV1mol,

2) 氧化还原滴定:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质.

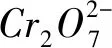
计算该样品中铁元素的质量分数(写出计算过程).

22.00×10-3L=1.100×10-3mol.
根据电子得失守恒,可得微粒的关系式:

m(Fe)=6.6×10-3mol×56g·mol-1=0.369 6g.
样品中铁元素的质量分数:
3) 沉淀滴定法:是利用沉淀反应进行滴定、测量分析的方法,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-的浓度.

Ⅰ.准备标准溶液.
a. 准确称取AgNO3基准物4.246 8g(0.025 0mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用.
b. 配制并标定100mL0.1000mol·L-1NH4SCN标准溶液,备用.
Ⅱ. 滴定的主要步骤.
a. 取待测NaI溶液25.00mL于锥形瓶中.
b. 加入25.00mL0.100 0mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀.
c. 加入NH4Fe(SO4)2溶液作指示剂.
d. 用0.100 0mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.
e. 重复上述操作两次,三次测定数据如表1.

表1
f. 数据处理.
所消耗的NH4SCN标准溶液平均体积为______mL,测得c(I-)=________mol·L-1.

n(AgNO3)=25.00×10-3L×
0.100 0mol·L-1=2.5×10-3mol,
n(NH4SCN)=0.100 0mol·L-1×
10.00×10-3L=1.00×10-3mol,
则 c(I-)×25.00×10-3L=2.5×10-3mol-1.00×10-3mol,所以c(I-)=0.060 0mol·L-1.
4) 配位滴定:是以配位反应为基础的一种滴定分析法,可用于对金属离子进行测定,工业上常采用EDTA(乙二胺四乙酸)作配位剂测定金属原子.

(2-x)Al2(SO4)3+3xCaCO3+3xH2O=
2[(1-x)Al2(SO4)3·xAl(OH)3]+
3xCaSO4↓+3xCO2↑,
通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
① 取碱式硫酸铝溶液25.00mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.330 0g.
② 取碱式硫酸铝溶液2.50mL,稀释至25mL,加入0.100 0mol·L-1EDTA标准溶液25.00mL,调节溶液的pH约为4.2,煮沸,冷却后用0.080 00mol·L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00mL(已知Al3+、Cu2+与EDTA反应的化学化学计量数比均为1∶1).计算(1-x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程).

2.50mL溶液中,
n(Al3+)=n(EDTA)-n(Cu2+)=
0.100 0mol·L-1×25.00mL×10-3L·mL-1-
0.080 00mol·L-1×20.00mL×10-3L·mL-1=
9.000×10-4mol.
25.00mL溶液中:
n(Al3+)=9.000×10-3mol,
1mol(1-x)Al2(SO4)3·xAl(OH)3中:


2 多步滴定法计算
1)连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定.根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量.

测定三草酸合铁酸钾中铁的含量.
① 称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点.② 向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中.加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL.该晶体中铁元素的质量分数的表达式为________.

2)返滴定法:第一步用的滴定剂是过量的,然后第二步再用另一物质返滴定过量的物质.根据第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量.

Ⅰ.采样:略去.
Ⅱ.NOx含量的测定.

则气样中NOx折合成NO2的含量为________mg·m-3.




