贝伐单抗抑制缝线诱导大鼠角膜新生血管及淋巴管
王剑超,穆廷魁,胡 笳,刘子瑶,姚 亮,秦 莉
(1西安交通大学第二附属医院眼科,西安 710048;2西安交通大学光信息科学与技术系;3西安交通大学第一附属医院眼科;*通讯作者,E-mail:eyeqinli@163.com)
正常角膜组织没有血管及淋巴管,这是维持其透明性和作为重要屈光介质的组织学依据。角膜无血管的结构特点限制了血源性免疫效应细胞和分子进入角膜组织,阻止了免疫细胞对角膜抗原的识别;角膜的无淋巴管的结构特点使抗原物质不能进入区域淋巴结,从而产生免疫耐受。眼外伤或化学伤、感染、倒睫、角膜手术等一系列病理情况下,角膜产生新生血管和淋巴管,视力下降,甚至导致角膜盲。其中角膜手术,特别是角膜移植术后的角膜新生血管及新生淋巴管,使免疫排斥反应发生率增高,影响手术成功率。因此,如何抑制角膜新生血管及新生淋巴管生成,改善新生血管性角膜病预后,降低角膜移植术后免疫排斥反应,提高手术的成功率,值得进一步研究。
目前,人们对角膜新生血管发生发展机制的研究已相对深入,CD31就是一种常用的血管内皮细胞特异性标志物,其在造血干细胞的整个发育过程中均有表达[1];近年来,随着各种淋巴管内皮细胞特异性标记物的发现,如血管内皮生长因子受体3(VEGFR-3)、LYVE-1,肝细胞生长因子、血管生成素及淋巴管内皮细胞的特异性有丝分裂原VEGF-C的发现,为研究角膜新生淋巴管形成的具体机制提供了有利的条件[2]。在诱导淋巴管生成过程中,VEGF-C/VEGFR-3信号传导通路的作用十分重要[3],该信号传导通路若被阻断,则淋巴管生成受到抑制,抑制该信号传导通路是目前临床上抗淋巴管生成治疗最常用的方法。贝伐单抗(bevacizumab)能够抑制血管内皮细胞的有丝分裂,减少血管通透性,抑制新生血管的生成[4],但其对新生淋巴管的作用及相关机制研究较少。
本实验制作SD大鼠缝线诱导的角膜新生血管及新生淋巴管模型,结膜下注射贝伐单抗,观察大鼠角膜新生血管和新生淋巴管生成情况及贝伐单抗对缝线诱导的角膜新生血管及新生淋巴管的抑制作用。
1 材料与方法
1.1 实验动物及分组
健康SD(sprague dawley)大鼠55只,雌性,8-12周龄,体质量170-210 g,西安交通大学医学院动物实验中心提供。经眼部检查排除外眼和眼部疾患。实验动物和实验动物使用条件符合《实验动物管理条例》(国家科学技术委员会)。
随机抽取3只大鼠(6只眼)作为对照组,双眼不缝线,过量麻醉法处死;其余52只,均选右眼为角膜缝线实验眼,建模后随机分为两组。生理盐水组:26只(26眼),右眼角膜缝线后立即结膜下注射生理盐水0.05 ml 1次;贝伐单抗组:26只(26眼),右眼角膜缝线后立即结膜下注射贝伐单抗(Roche公司)1.25 mg(0.05 ml)1次。
1.2 实验方法
1.2.1 制备缝线诱导的SD大鼠角膜新生血管及淋巴管模型 复方托品酰胺充分散瞳后,10%的水合氯醛(0.35 ml/100 g)腹腔注射麻醉,以右眼为实验眼,0.3%妥布霉素冲洗结膜囊,盐酸奥布卡因滴眼液眼表麻醉,在手术显微镜下用10-0尼龙线铲针穿过角膜深基质层间断缝合8针(沿12个钟点位置平均分配),自距离角膜缘2 mm处(圆规定位)向瞳孔中心方向进针,缝线埋入深度约为角膜厚度的2/3,在角膜表面留线头长约1 mm。术毕结膜囊内涂红霉素眼膏。术后每日点用0.3%氧氟沙星滴眼液4次/d,复方托品酰胺滴眼液3次/d,1%阿托品眼用凝胶1次/d,至实验结束。同时检查缝线若有脱落,及时原位或原进针点旁补缝。同一位点缝线脱落2次以上则剔除分析[5]。
1.2.2 术后观察及处理 于术后第4,7,10,14日(d4,d7,d10,d14)10%水合氯醛(0.35 ml/100 g)腹腔注射麻醉后置于裂隙灯显微镜下观察术眼角膜新生血管发生情况,并照相、记录,计算新生血管面积。
对照组大鼠采用过量麻醉法处死后,在角膜缘外1 mm处平行角膜缘环形剪取双眼角膜,置于4%多聚甲醛溶液中固定,用HE染色及免疫组织化学染色的方法检测角膜炎症反应情况及VEGF-C、CD31蛋白的表达;生理盐水组及贝伐单抗组分别于d4,d7,d10,d14随机挑选6只大鼠做免疫组化标本用,方法及检测指标同对照组。
生理盐水组及贝伐单抗组分别于d10和d14随机挑选1只大鼠,采用过量麻醉法处死后,在角膜缘内1 mm处平行角膜缘环形剪取右眼角膜,置于3%戊二醛-0.1 mol/L PBS(pH7.2)中,4 ℃保存(2 h以上),做电子显微镜观察标本。
1.2.3 结果判断标准 角膜新生血管面积计算:d4,d7,d10,d14应用裂隙灯显微镜观察角膜新生血管发生情况,采用裂隙灯显微数字图像处理系统照相、分别测量角膜4个象限自角膜缘长出的新生血管的长度(L),记录角膜半径(r)及其累及角膜的圆周钟点数(C)。测量时,以连续弯曲度小,朝向角膜中心生长的最长血管的垂直长度为准。按Robert公式计算新生血管面积S=C/12×3.141 6[r2-(r-L)2][6]。角膜新生血管总面积等于4个象限面积之和。
HE染色观察:各组大鼠分别处死,取材,做石蜡切片后,行苏木素-伊红(H-E)染色,中性树胶封片,光学显微镜下观察角膜病理变化以及新生血管数量。
VEGF-C蛋白及CD31蛋白的表达:VEGF-C蛋白染色定位于细胞胞浆,CD31蛋白染色定位于细胞浆及细胞膜,均以呈现棕黄色颗粒为阳性。按照染色程度深浅分为4级:不着色为(-),淡黄色为弱阳性(+),棕黄色为阳性(++),棕褐色为强阳性(+++)。应用Image-ProPlus 6.0图像分析仪,分别测定VEGF-C蛋白及CD31蛋白阳性颗粒的积分光密度值(intergrl optical density,IOD),IOD值的大小与相应蛋白表达的多少成正比,以IOD值对相应蛋白的表达进行定量分析。光学显微镜(×400)下每个标本随机选取5个视野,分别计算每个视野VEGF-C蛋白及CD31蛋白阳性表达的IOD值,取5个视野的IOD值的平均值为该标本最后的IOD值。
透射电镜下观察角膜新生淋巴管的形成:淋巴管的管腔较大,管壁不规则,由连续的单层内皮细胞围成。内皮细胞胞核大,突向腔内,胞质薄,为连续型,无窗孔,外周无周细胞,基底膜不完整,不连续,或缺如。淋巴管内皮细胞的管腔面及非管腔面均可见指状或树根状突起,分别伸向管腔中的胞质及周围组织。两相邻的LEC之间可有较大的空间,大于30 nm,呈开放连接,是淋巴管内皮的特征性结构,借此可与血管内皮进行区分。
1.3 统计学方法
本实验所有数据均采用SPSS21.0统计分析软件包进行分析,总体均数间比较采用两独立样本均数的t检验,各组间比较采用重复测量设计资料的方差分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 角膜新生血管的裂隙灯显微镜观察及新生血管面积计算
对照组:正常角膜,透明无血管,无水肿,虹膜血管清晰可见(见图1)。
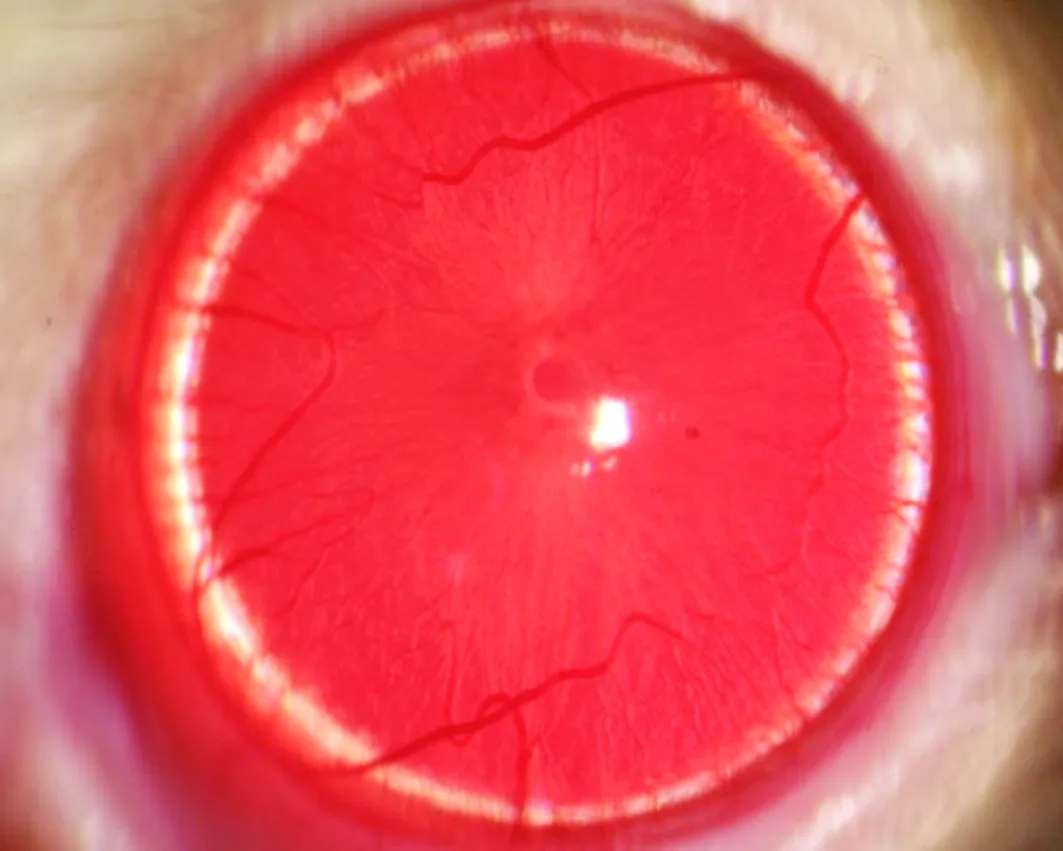
图1 正常大鼠角膜裂隙灯显微镜观察Figure 1 Normal cornea by slit lamp microscope
生理盐水组:术后第4天,角膜缘血管明显扩张充血,毛刷状新生血管向心性长入透明角膜约2 mm,至角膜缝线外缘,新生血管充血及角膜水肿明显,无法透见虹膜纹理(见图2A);第7天,角膜新生血管增粗增长,越过角膜缝线,但未及角膜瞳孔中央区,新生血管顶端分叉,部分交织成网状,角膜仍水肿,不能清晰透见虹膜纹理(见图2B);第10天,角膜新生血管增长,部分垂直长入角膜瞳孔中央区,顶端分叉更为明显,但较前稀疏,角膜水肿减轻,可透见虹膜纹理(见图2C);第14天,角膜新生血管变细,充血不明显,角膜中央部分新生血管闭塞呈白线状,角膜透明,可清晰透见虹膜纹理(见图2D)。
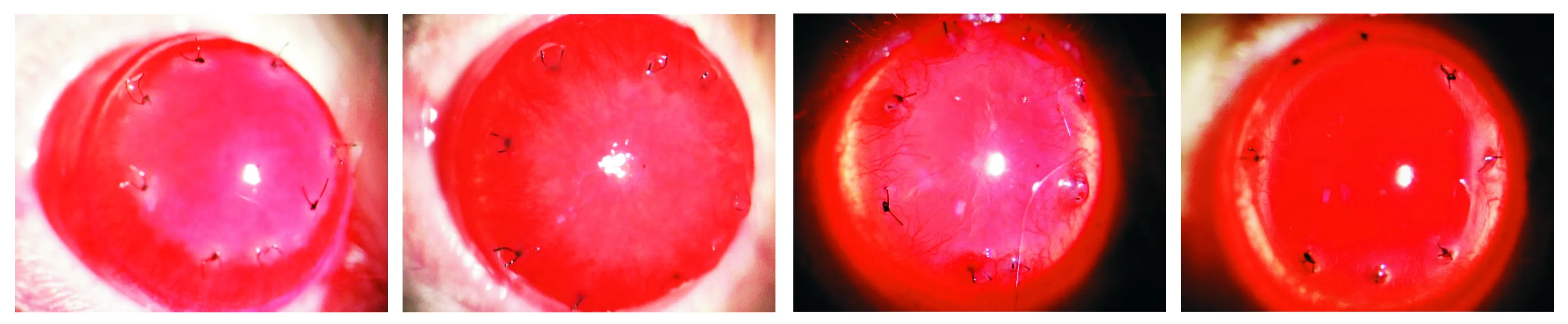
A.第4天 B.第7天 C.第10天 D.第14天图2 生理盐水组大鼠角膜裂隙灯显微镜观察Figure 2 Cornea by slit lamp microscope in PS group
贝伐单抗组:术后第4天,角膜缘血管充血,毛刷状新生血管芽向心性长入透明角膜约1 mm,未及角膜缝线外缘,新生血管充血,角膜缝线周围角膜水肿,角膜中央尚透明,可透见虹膜纹理(见图3A);第7天,角膜新生血管增粗增长,至角膜缝线外缘,新生血管顶端少见分叉,角膜水肿消退,可清晰透见虹膜纹理(见图3B);第10天,角膜新生血管稍增长,但变细,顶端见分叉,包绕角膜缝线形成新生血管网,两角膜缝线之间新生血管明显稀疏,角膜透明,可清晰透见虹膜纹理(见图3C);第14天,角膜缘新生血管明显变细,充血不明显,稀疏而短,角膜透明,可清晰透见虹膜纹理(见图3D)。
贝伐单抗组与生理盐水组相比,大鼠角膜新生血管面积在第4,7,10,14天均减小,差异有统计学意义(见表1)。
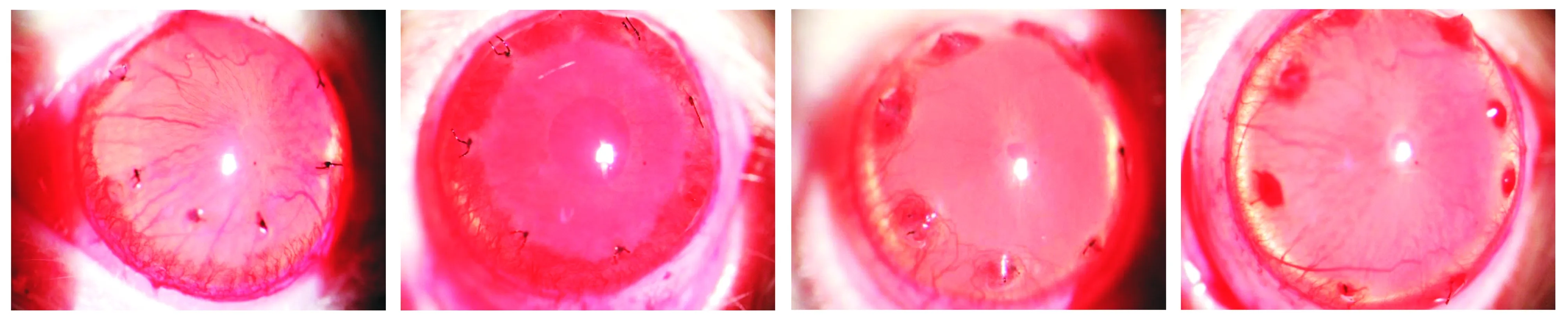
A.第4天 B.第7天 C.第10天 D.第14天图3 贝伐单抗组大鼠角膜裂隙灯显微镜观察Figure 3 Cornea by slit lamp microscope in bevacizumab group
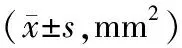
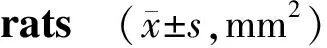
组别d0d4d7d10d14对照组 0.00±0.00----生理盐水组-15.52±1.8835.32±1.6945.53±2.3027.38±1.13贝伐单抗组-8.69±1.62∗∗30.31±3.76∗10.50±1.94∗∗5.23±1.07∗∗
与生理盐水组相比,*P<0.05,**P<0.01
2.2 显微镜下角膜组织切片HE染色
对照组:正常角膜,角膜组织各层结构完整,排列紧密,角膜全层内无血管(见图4)。
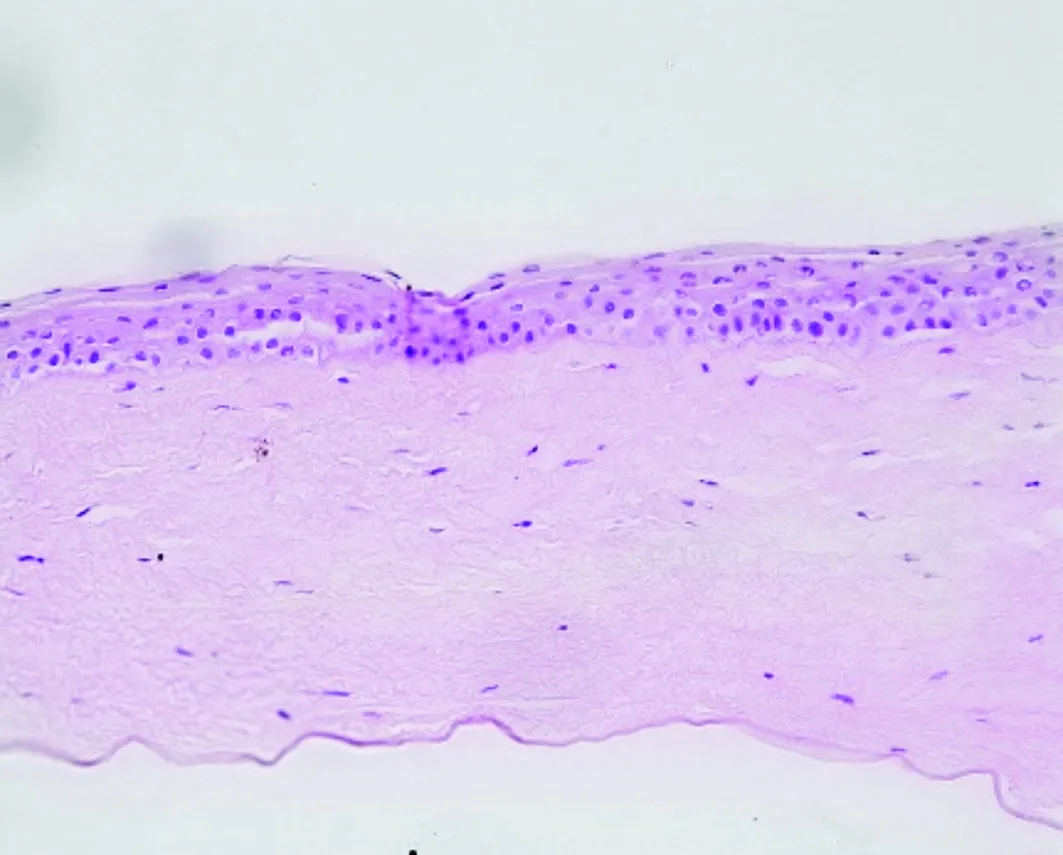
图4 正常角膜组织结构 (HE染色,×400)Figure 4 Normal corneal specimens (HE,×400)
生理盐水组:第4天,角膜上皮基底细胞见较多空泡,角膜水肿明显,结构疏松,角膜基质前2/3炎性细胞浸润明显,单层内皮细胞围绕形成毛细血管腔,大多分布于角膜浅基质层,管腔较小,其内可见较多红细胞(见图5A);第7天,角膜上皮空泡减少,角膜组织仍水肿,角膜基质前2/3仍有炎性细胞浸润,成熟的新生血管密集分布于浅基质层及深基质层,管腔呈扩张状态,其内可见红细胞(见图5B);第10天,角膜水肿减轻,各层结构较清楚,基质内炎性细胞浸润减少,主要集中于浅基质层,新生血管数量减少,管腔稍小,管腔内红细胞减少(见图5C);第14天,角膜水肿基本消退,炎细胞浸润明显减少,新生血管管腔塌陷,管腔内未见红细胞(见图5D)。
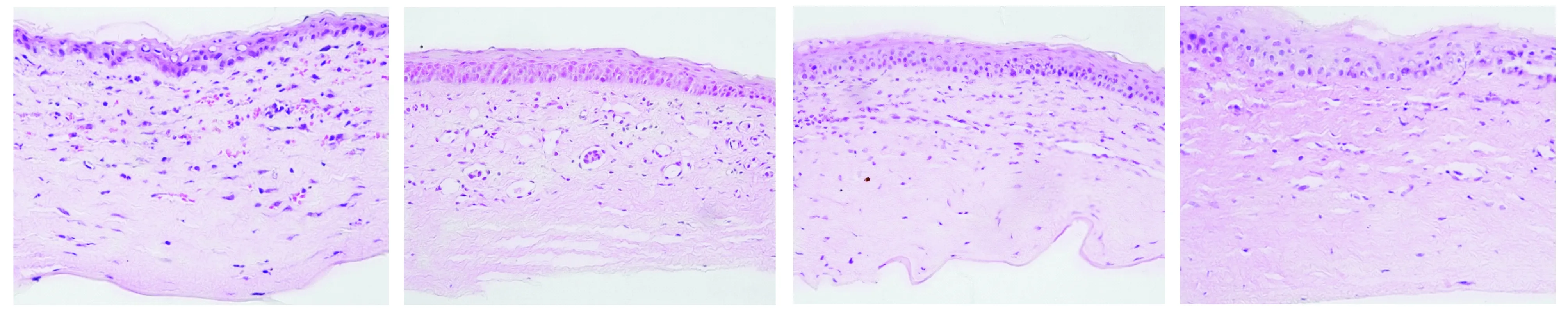
A.第4天 B.第7天 C.第10天 D.第14天图5 生理盐水组大鼠角膜组织结构 (HE染色,×400)Figure 5 Corneal specimens in PS group (HE,×400)
贝伐单抗组:第4天,角膜上皮基底细胞可见少量空泡,角膜组织稍水肿,组织结构略疏松,角膜基质内炎性细胞浸润,主要集中于浅基质层,单层内皮细胞围绕形成毛细血管腔,新生血管密度低,分布于角膜浅基质层,管腔小,其内可见少量红细胞(见图6A);第7天,角膜上皮未见空泡,角膜组织无水肿,角膜基质前2/3少量炎性细胞浸润,主要位于新生血管周围,成熟的新生血管大多分布于浅基质层,管腔较大,其内红细胞较少(见图6B);第10天,角膜无水肿,可见接近正常的上皮细胞层次和形态,基质内炎性细胞浸润进一步减少,主要集中于浅基质层,基质板层排列较紧密,浅基质层可见角膜新生血管管腔塌陷,密度低(见图6C);第14天,角膜无水肿,炎细胞浸润明显减少,集中于浅基质层新生血管周围,新生血管密度低,管腔塌陷,其内未见红细胞(见图6D)。
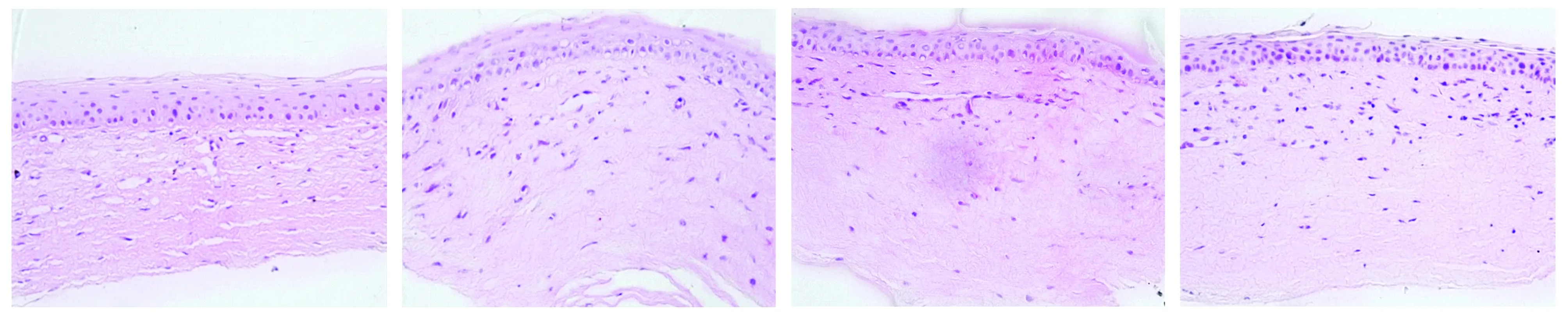
A.第4天 B.第7天 C.第10天 D.第14天图6 贝伐单抗组大鼠角膜组织结构 (HE染色,×400)Figure 6 Corneal specimens in bevacizumab group (HE,×400)
2.3 免疫组织化学方法检测VEGF-C蛋白表达的结果
对照组:正常角膜,角膜上皮层基底细胞胞浆有VEGF-C蛋白弱阳性(+)表达,基质层中无阳性表达(见图7)。
生理盐水组:第4天,角膜上皮层VEGF-C蛋白阳性表达增加,角膜基质层前2/3中浸润的炎细胞胞浆、部分角膜基质细胞、新生的脉管管壁上均可见VEGF-C蛋白阳性颗粒表达,呈棕黄色至棕褐色颗粒状(++~+++)(见图8A);第7天,VEGF-C蛋白阳性表达进一步增强,阳性颗粒多位于角膜基质层中浸润的炎细胞及管腔周围,呈棕褐色颗粒状(+++)(见图8B);第10天,VEGF-C蛋白阳性细胞减少,角膜基质层新生的脉管管壁上仍有少量阳性颗粒表达,呈棕黄色(++)(见图8C);第14天,VEGF-C蛋白阳性细胞进一步减少,角膜基质层新生的脉管管壁上仍有少量阳性颗粒表达,呈淡黄色(+)(见图8D)。
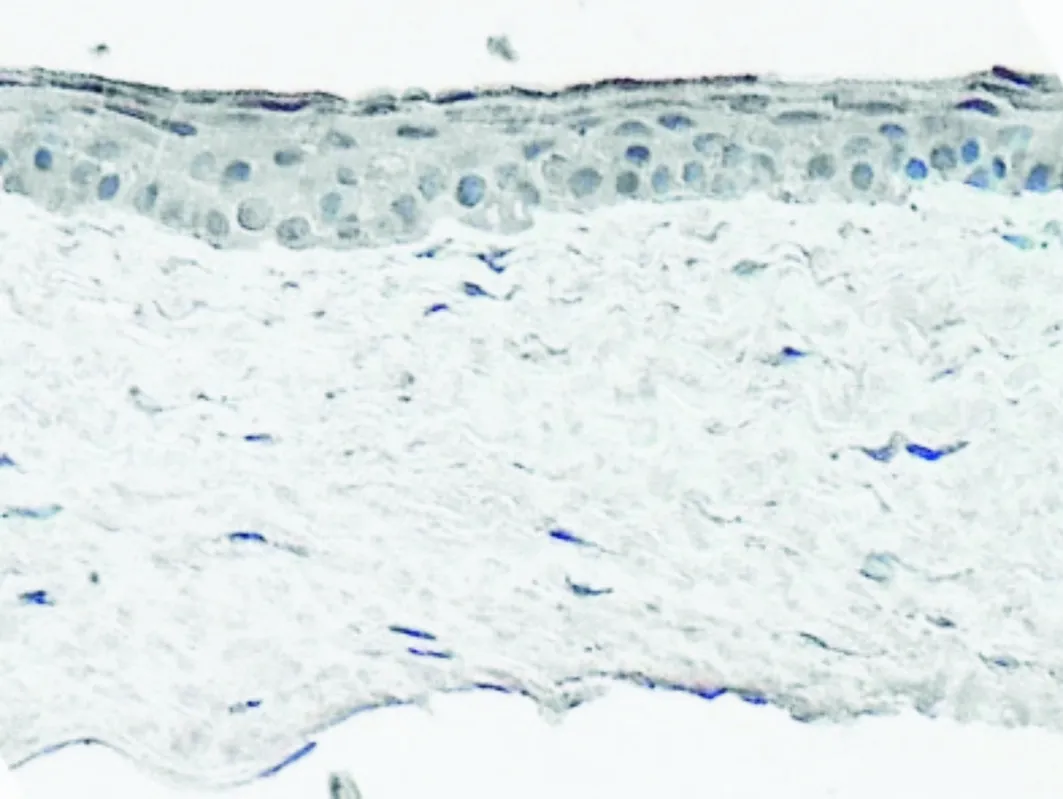
图7 正常大鼠角膜VEGF-C蛋白的表达 (免疫组化染色,×400)Figure 7 The expression of VEGF-C in normal cornea (immuohistochemical staining,×400)
A.第4天 B.第7天 C.第10天 D.第14天图8 生理盐水组大鼠角膜VEGF-C蛋白的表达 (免疫组化染色,×400)Figure 8 The expression of VEGF-C in cornea of subc-ps group (immuohistochemical staining,×400)
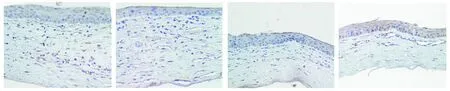
贝伐单抗组:第4天,角膜上皮层VEGF-C蛋白阳性表达增加,角膜基质层前2/3中浸润的炎细胞胞浆、部分基质细胞、新生的脉管管壁上均有VEGF-C阳性颗粒表达,呈棕黄色至棕褐色颗粒状(++~+++)(见图9A);第7天,VEGF-C蛋白阳性表达未见明显增强,阳性颗粒多位于角膜基质层中浸润的炎细胞及管腔周围,呈棕黄色至棕褐色颗粒状(++~+++)(见图9B);第10天,VEGF-C蛋白阳性表达大量减少,角膜基质层新生的脉管管壁上仍有少量阳性颗粒表达,呈淡黄色(+)(见图9C);第14天,VEGF-C蛋白阳性表达进一步减少,角膜基质层新生的脉管管壁上仍有少量阳性颗粒表达,呈淡黄色(+)(见图9D)。

A.第4天 B.第7天 C.第10天 D.第14天图9 贝伐单抗组大鼠角膜VEGF-C蛋白的表达 (免疫组化染色,×400)Figure 9 The expression of VEGF-C in cornea in bevacizumab group (immuohistochemical staining,×400)
各组VEGF-C蛋白表达IOD值统计分析后结果显示:术后第4,7,10天,贝伐单抗组VEGF-C表达的IOD值较生理盐水组减小,差异有统计学意义(P<0.01);第14天,贝伐单抗组VEGF-C表达的IOD值与生理盐水组及对照组相比,差异均无统计学意义(见表2)。
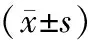
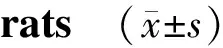
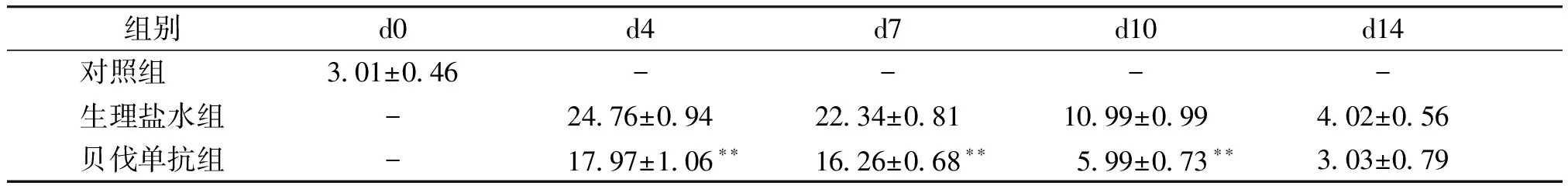
组别d0d4d7d10d14对照组 3.01±0.46----生理盐水组-24.76±0.9422.34±0.8110.99±0.994.02±0.56贝伐单抗组-17.97±1.06∗∗16.26±0.68∗∗5.99±0.73∗∗3.03±0.79
与生理盐水组相比,**P<0.01
重复测量设计资料的方差分析表明,角膜缝线后不同时间点的VEGF-C蛋白表达的IOD值满足“球对称”假设,VEGF-C蛋白表达的IOD值差异有统计学意义(P<0.05),结膜下注射药物不同对VEGF-C蛋白表达的IOD值有影响,具有统计学意义(P<0.05)。
2.4 免疫组织化学方法检测CD31蛋白表达的结果
对照组:正常角膜,角膜上皮层基底细胞胞浆及胞膜有CD31蛋白弱阳性(+)表达,基质层中无阳性表达。正常角膜基质中,胶原纤维排列整齐,无新生血管与新生淋巴管(见图10)。
生理盐水组:术后第4天,CD31阳性颗粒主要分布于角膜浅基质层新生的血管内皮细胞胞浆及胞膜上,呈棕黄色颗粒状(++)(见图11A);第7天,CD31蛋白阳性表达明显增强,阳性颗粒多位于角膜
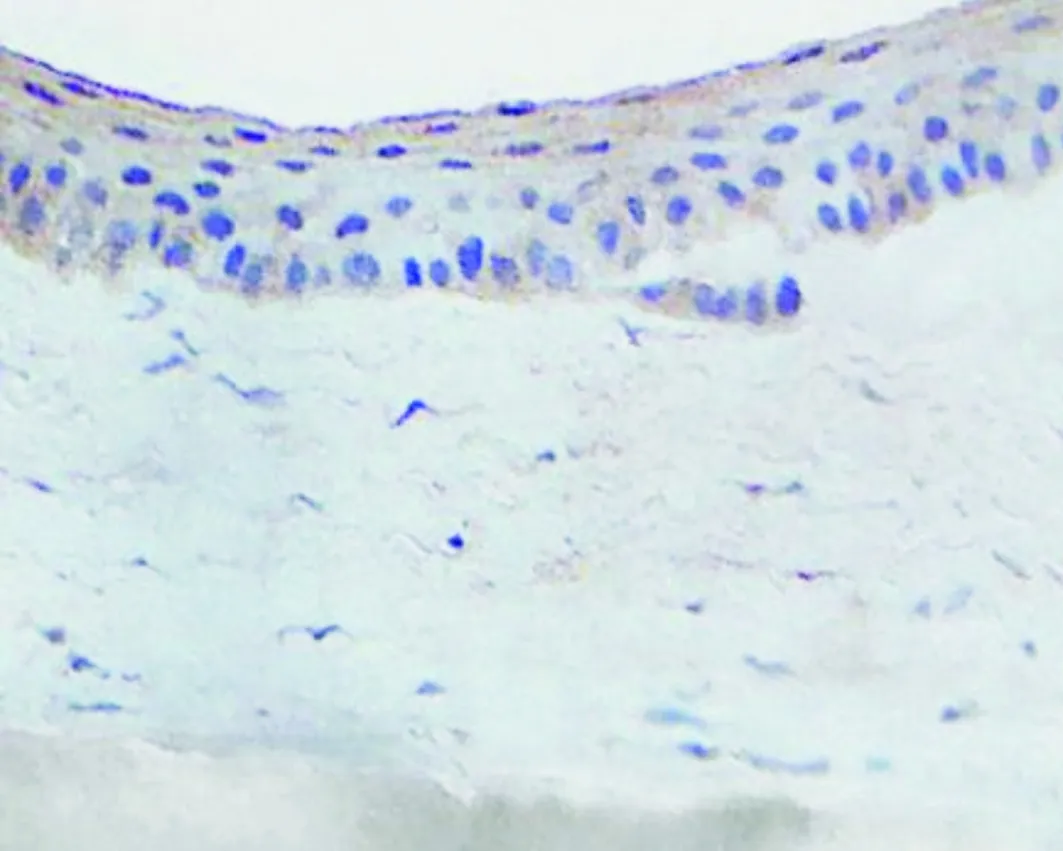
图10 正常大鼠角膜CD31蛋白的表达 (免疫组化染色,×400)Figure 10 The expression of CD31 in normal cornea (immuohistochemical staining,×400)
基质层前2/3的新生血管内皮细胞胞浆及胞膜上,呈棕褐色颗粒状(+++)(见图11B);第10天,CD31阳性细胞数量未见明显减少,分布于角膜基质层新生的脉管管壁上,阳性颗粒呈棕黄色(++)(见图11C);第14天,CD31阳性细胞明显减少,角膜基质层新生血管内皮细胞上仍有少量淡黄色(+)CD31阳性颗粒表达(见图11D)。

A.第4天 B.第7天 C.第10天 D.第14天图11 生理盐水组大鼠角膜CD31蛋白的表达 (免疫组化染色,×400)Figure 11 The expression of CD31 in cornea in PS group (immuohistochemical staining,×400)
贝伐单抗组:第4天,CD31阳性细胞主要分布于角膜浅基质层新生的血管管壁上,阳性颗粒呈淡黄色(+)(见图12A);第7天,CD31蛋白阳性表达明显增强,阳性颗粒多位于角膜基质层前2/3的新生血管内皮细胞胞浆及胞膜上,呈棕黄色颗粒状(++)(见图12B);第10天,CD31阳性细胞数量明显减少,分布于角膜基质层新生的血管管壁上,阳性颗粒呈淡黄色(+)(见图12C);第14天,CD31阳性细胞进一步减少,角膜基质层新生的血管管壁上仍有少量阳性颗粒表达,呈淡黄色(+)(见图12D)。
各组CD31蛋白表达的IOD值统计分析结果表明:第4,7,10,14天,贝伐单抗组CD31蛋白表达的IOD值较生理盐水组减小,差异有统计学意义(P<0.01);第14天,贝伐单抗组CD31蛋白表达的IOD值与对照组相比,差异无统计学意义(P=0.11,见表3)。
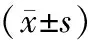
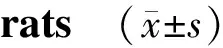
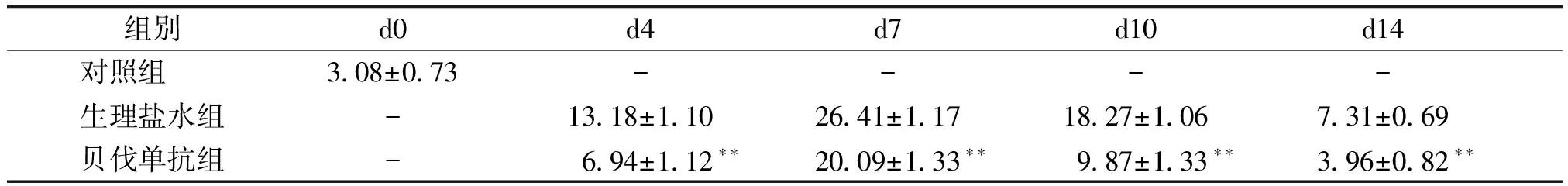
组别d0d4d7d10d14对照组 3.08±0.73----生理盐水组-13.18±1.1026.41±1.1718.27±1.067.31±0.69贝伐单抗组-6.94±1.12∗∗20.09±1.33∗∗9.87±1.33∗∗3.96±0.82∗∗
与生理盐水组相比,**P<0.01
重复测量设计资料的方差分析表明,角膜缝线后不同时间点的CD31蛋白表达的IOD值满足“球对称”假设,CD31蛋白表达的IOD值差异有统计学意义(P<0.05),结膜下注射药物不同对CD31蛋白表达的IOD值有影响,差异有统计学意义(P<0.05)。
2.5 透射电镜观察角膜新生血管及新生淋巴管
生理盐水组:第10天,见角膜基质层中除新生血管外,还存在新生淋巴管。血管内皮细胞的胞浆较丰富,细胞器数量较多,细胞外基底膜完整,新生血管管腔内常可见红细胞,外周常有周细胞(见图13A)。淋巴管的管腔较大,管壁不规则,由连续单层内皮细胞围成,内皮细胞胞核大,突向腔内,胞质薄,无窗孔,外周无周细胞,基底膜不完整,不连续,或缺如。LEC的管腔面及非管腔面均可见指状或树根状突起,分别伸向管腔中的胞质及周围组织。两相邻的LEC之间可有较大的空间,大于30 nm,呈开放连接,是淋巴管内皮的特征性结构,借此可与血管内皮进行区分。淋巴管的开放连接便于大分子物质、细胞、凋亡及坏死细胞的碎片进入淋巴管腔(见图13B);第14天,角膜基质中新生血管管腔塌陷,管腔内未见红细胞(见图13D),新生淋巴管稍密集,基底膜不连续,相邻LEC间可见开放连接。
贝伐单抗组:第10天,透射电镜观察角膜,角膜基质层可见新生血管,基底膜完整,外周常可见周细胞,管腔内红细胞较少,未见角膜新生淋巴管;第14天,角膜基质中新生血管管腔塌陷,管腔内未见红细胞,可见新生淋巴管,较稀疏,基底膜不连续,相邻LEC间可见开放连接。
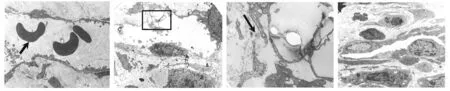
A.透射电镜下角膜新生血管,箭头所示为红细胞(3.5×1 000);B.透射电镜下角膜新生淋巴管(4.0×1 000);C.透射电镜下角膜新生淋巴管,即B图方框区放大图,箭头示淋巴管内皮细胞开放连接(20×1 000);D.透射电镜下角膜新生血管(3.5×1 000)图13 透射电镜观察角膜新生血管及新生淋巴管Figure 13 Corneal neovascularization and lymphangiogenesis under electron microscope
3 讨论
角膜位置表浅,易因外伤、酸碱烧伤、各种感染导致角膜盲。角膜盲是我国第二大致盲眼病,仅次于白内障[7],通过角膜移植手术,可使大部分角膜盲患者重见光明[8]。而角膜移植术后的免疫排斥反应,是导致手术失败的主要原因之一,抑制免疫排斥反应造成的角膜新生血管和新生淋巴管,对降低角膜移植手术失败率,减少角膜盲有重大意义。
本研究采用缝线诱导的SD大鼠角膜新生血管及新生淋巴管模型,呈现了角膜移植术后的病理状态,是研究角膜移植术后角膜新生血管及新生淋巴管生成的调控机制、探索和评价其防治方法的理想模型。
CD31即血小板内皮细胞黏附分子-1,在炎症反应、血管生成[9]等方面,具有重要的生理及病理功能。CD31在发育中和已成熟个体的所有血管内皮细胞都有高度表达,并和血管内皮细胞的运动有关,常被作为血管内皮细胞的特异性标志物。本研究通过检测角膜CD31蛋白表达来反映角膜新生血管生成情况,结果表明,贝伐单抗能够抑制大鼠角膜缝线早期的角膜新生血管生成,与既往研究结论一致[4,10]。
VEGF-C是一种淋巴管内皮细胞的特异性有丝分裂原,与淋巴系统的发展有关,主要通过血管内皮生长因子受体-3(VEGFR-3)发挥作用,而VEGFR-3特异性地表达于成人组织淋巴管内皮细胞[11,12]。Veskkola等[13]采用过度表达VEGF-C1565的转基因小鼠研究表明,VEGF-C/VEGFR-3信号传导通路在诱导淋巴管生长方面起重要作用,该信号传导通路的特异性阻断剂可明显抑制淋巴管生成,是目前防治新生淋巴管应用最广泛的方法。本研究发现,在角膜新生淋巴管形成过程中,贝伐单抗降低了VEGF-C蛋白的表达,推测其可能通过阻断VEGF-C/VEGFR-3信号传导通路,抑制角膜新生淋巴管形成。
综上所述,本研究证实了贝伐单抗结膜下注射能够抑制大鼠角膜缝线早期的新生血管和淋巴管生成,并推测贝伐单抗可能通过阻断VEGF-C/VEGFR-3信号传导通路抑制新生淋巴管形成。但对贝伐单抗抑制新生血管形成的分子机制研究不够深入,对角膜缝线后晚期角膜新生血管和淋巴管的研究,也有待进一步开展。
——淋巴管系统

