不同贮藏温度对宰后猪里脊肉乳酸代谢通量的影响
张成云,何兴兴,庞广昌,张德权,张春晖,关文强,*
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.中国农业科学院农产品加工研究所,北京 100193)
鲜肉富含人体所需要的各种营养物质,特别是动物性蛋白质,在人们的饮食生活中,肉类食品具有重要地位[1-3]。动物屠宰后会经历僵直、成熟等一系列复杂的生理生化反应,完成从肌肉到食用肉的转变。机体的生命结束后,其组织细胞在一段时间内仍然存活,细胞中酶系统仍具有活性,可以对相应底物进行作用,继续其生理代谢活动。但由于血液循环中断,供氧停止,组织细胞的呼吸途径被迫改变,从有氧呼吸变为无氧呼吸,这时体内的糖酵解途径(Embden-Meyerhof pathway,EMP)变成了主要供能方式。而EMP产生的乳酸又不能被转运到肝脏重新利用,导致大量乳酸积累在肌肉中,最终被运送到肌肉纤维外,使宰后胴体的pH值由弱碱性慢慢降到酸性极限值[4-6]。pH值的下降导致宰后肌肉出现僵直状态,使得肉的韧性增强、食用度降低,口感香气也受到影响,使肉的品质下降[7],pH值的变化速率与极限pH值是影响肉品品质的关键因素,乳酸的积累是导致pH值下降的主要原因。乳酸是EMP的终产物,该途径在生物体内广泛存在,被认为是对生物体具有重要意义的中心代谢途径。因此,乳酸在贮藏保鲜中具有重要作用[8],而乳酸代谢通量在代谢网络途径中不仅可以反映呼吸代谢的受限情况,还能反映合成代谢的增强情况,进而能反映出鲜肉品质在贮藏过程中的变化,因此对于宰后鲜肉乳酸代谢通量的研究是有意义且有必要的。
研究发现,温度是多数生物体代谢活动的重要环境因子,温度对肌肉的成熟进程和肉品质有重要影响,宰后成熟温度越低,肉品最终感官品质和卫生指标越好[9-11]。最常见的保鲜方法是将鲜肉冷藏在4 ℃左右,但近年来,国内外对鲜肉、果蔬和水产品等食品冰温保鲜的研究也逐渐增多[12-14],在合适的冰温区域能够将机体的生理活性降到最低程度,又不损害内部结构,还能维持其正常的新陈代谢[15]。王正荣等[16]报道,鸡胸肉在冰温贮藏下可以将成熟进程延缓大约2~6 h;许立兴等[17]研究发现,鸭胸肉在冰温下贮藏比冷藏能够更好地延缓其腐败变质,使保鲜期延长15 d。
近几年,采用代谢通量分析的方法来研究乳酸在水果贮藏保鲜中的作用已有很多报道,王会松等[18]研究发现适当的贮藏温度会增加乳酸代谢通量,有利于降低甜瓜的呼吸代谢,增强合成代谢,达到延长果蔬保鲜的效果;与此同时,蔡修臻[19]也发现温度会影响乳酸代谢通量的升高或降低,并得出5 ℃是哈密瓜贮藏的最佳温度,在此温度下,分解代谢最低,合成代谢最高。但目前关于宰后肌肉的乳酸代谢通量变化的研究鲜有报道。而在代谢工程中一种重要的量化分析方法就是代谢通量分析(metabolic flux analysis,MFA),目的是定量分析生物体内稳态状态下代谢途径中的通量,获得生物化学系统的代谢通量、反应速率等量化信息,评估系统代谢能力和极限[20]。因此,本实验通过对贮藏不同温度和不同时间猪里脊肉乳酸代谢通量的变化情况进行研究,旨在寻找宰后鲜肉在贮藏过程中代谢通量的变化规律,为进一步通过代谢分析从生理生化方面提高鲜肉品质质量,延长鲜肉贮藏期。
1 材料与方法
1.1 材料与试剂
大白猪小里脊条购自天津肉联厂;聚乙烯自封袋购自河源市华丰塑胶有限公司。
4-羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)、1,3-二磷酸甘油酸(1,3-diphosphoglycerate,1,3-BPG)、二羟基苯乙酮(dihydroxyacetophenone,DHAP) 美国Sigma公司;KCl、MgSO4生工生物工程(上海)股份有限公司;NaCl 天津市化学试剂供销公司。
1.2 仪器与设备
SBA-40C生物传感分析仪 山东省科学院生物研究所;FA25匀浆机 上海FLUKO公司;ME204电子天平梅特勒-托利多(仪器)上海有限公司;GQB-700KB温度梯度箱 天津捷盛东辉保鲜科技有限公司;TG16-WS台式高速冷冻离心机 长沙湘仪离心机仪器有限公司;Fluoroskan Ascent FL荧光-化学发光检测仪美国Thermo Scientific公司。
1.3 方法
1.3.1 材料处理
适龄生猪屠宰后立即取出脊椎骨内侧的完整条状嫩肉(小里脊条)共8 条,放入已装好碎冰的13 L便携式保温箱(28 cmh20 cmh25 cm),1 h内运回实验室,及时剔除表面脂肪、筋膜,分割成质量40 g左右的肉块(6 cmh4 cmh2 cm)共24 块,装入标记好的苹果牌5号食品级保鲜自封袋(100 mmh140 mm)中,分别放入-1 ℃和4 ℃条件下贮藏。在0.5、2、6、12、24、72、120、168 h取样,取样时采用液氮迅速将样品冻结,立即冻存于-80 ℃冰箱备用[4]。
1.3.2 葡萄糖、乳酸和NADH含量的测定
准确称取10 g肉样,冰浴研磨,加入90 mL、质量分数0.86%的生理盐水,进行匀浆(匀浆时间10 s/次,间隔30 s,连续3~5 次),并将匀浆好的液体全部移入离心管,用8 000 r/min的转速在设定温度为4 ℃条件下离心10 min,取适量离心后的上清液分别移入离心管中,每次取25 µL样液,采用生物传感器分析仪分别测定葡萄糖和乳酸的质量浓度,每组取3 个平行,结果取平均值。之后分别对其进行时间微分,以测定出变化速率(单位:mg/(mLgh)),用于通量的计算。
NADH含量采用Fluoroskan Ascent FL荧光-化学发光检测仪,根据酶偶联法的原理进行测定,参考Schaefer等[21]的研究,其反应体系为0.25 mmol/L HEPES/EDTA缓冲液、100 mmol/L KCl、10 mmol/L MgSO4、0.4 U/mL GAPDH、0.5 mmol/L DHAP、3 mmol/L 1,3-BPG。
1.3.3 乳酸代谢网络图的构建
基于猪肉宰后僵直变化规律及乳酸代谢途径,并依据EMP、三羧酸(tricarboxylic acid,TCA)循环和磷酸戊糖途径(pentose phosphate pathway,PPP)3 个重要中心代谢途径,构建如图1所示的猪肉宰后乳酸代谢通量的网络图(本实验不考虑涉及范围以外的代谢途径,把没有分叉的直线反应统一合并为一个反应,减少代谢网络的反应数目)。

图 1 猪里脊肉中心代谢网络图Fig. 1 Central metabolic network of pork tenderloin
1.3.4 乳酸代谢通量的测定
通过图1创建的代谢网络可知,共有9 个未知的代谢速率需要测定(表1),同时可以确定在胞内的6 个质量平衡方程,具体如表2所示。
假设中间代谢途径产生的代谢物在胞内均处于一种拟稳定的状态,那么这6 个途径的代谢物没有积累,即这6 个途径的代谢速率均为0,此时就有6 个约束向量可以得到。这时该系统的自由度F=3,也就是只需求出3 个未知量(表3),此方程有唯一解(式(1))。而3 个所求速率P1、P2和P3分别为葡萄糖、乳酸和NADH的变化速率,均可通过实验测得,最后通过计算方程得到乳酸的代谢通量[22-24]。

表 1 猪里脊肉的中心代谢途径生化反应方程式Table 1 Biochemical reactions involved in central metabolic pathway of pork tenderloin
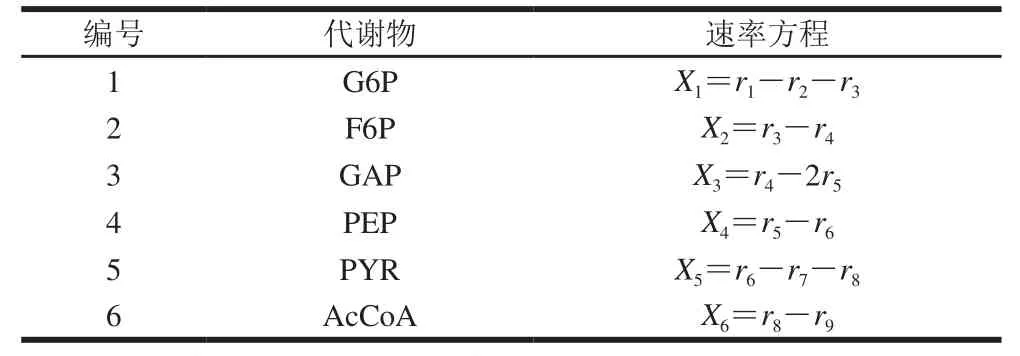
表 2 猪里脊肉的质量平衡方程式Table 2 Metabolic flux model equations of pork tenderloin

表 3 猪里脊肉代谢过程所需要测定的代谢物速率的平衡方程Table 3 Rate equations of measurable extracellular metabolites in the metabolism of pork tenderloin
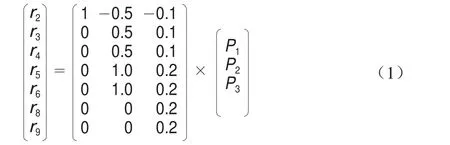
式中:P1、P2和P3分别表示葡萄糖、乳酸和NADH水平的变化速率。
1.4 数据统计与分析
实验数据采用Excel 2010软件进行整理,采用SPSS 19.0软件进行统计学分析,不同处理组间采用独立样本T检验、不同时间点的同一处理组间采用F检验以及Duncan’s多重比较进行差异显著性分析,显著水平为P<0.05,采用Origin 8.5软件作图。
2 结果与分析
2.1 不同贮藏温度对猪里脊肉葡萄糖含量的影响
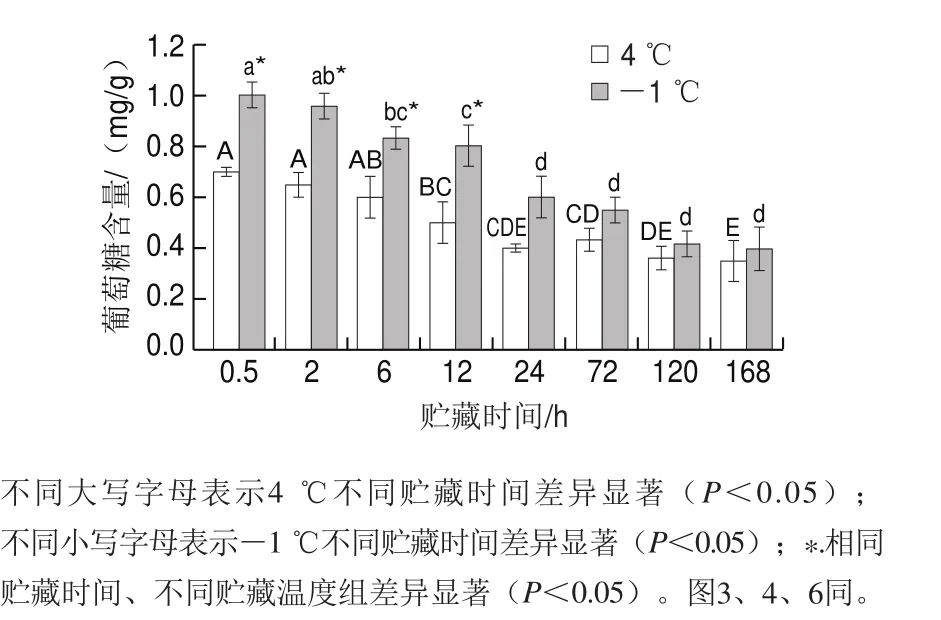
图 2 不同贮藏温度对猪里脊肉葡萄糖含量的影响Fig. 2 Effect of different storage temperatures on glucose content of pork tenderloin
动物宰后糖原是肌肉中的重要能量贮备物质。在活体状态下,肌糖原(葡萄糖)分解后通过有氧呼吸形成大量的能量物质,供肌肉运动之用。但在宰后,葡萄糖则通过无氧呼吸进入EMP生成乳酸来维持机体的稳定[25-26]。由图2可知,宰后猪里脊肉在-1 ℃和4 ℃贮藏条件下,葡萄糖含量均先逐渐降低最终趋于稳定,于168 h后分别达到0.40 mg/g和0.35 mg/g,从图2可以看出,-1 ℃贮藏下的葡萄糖含量明显高于4 ℃(P<0.05),且葡萄糖在整个贮藏过程中的下降速率低于4 ℃,结果表明宰后贮藏温度越低,葡萄糖分解速率越慢,越有利于猪肉的保鲜,与李培迪等[4]的研究结果一致。
2.2 不同贮藏温度对乳酸含量的影响
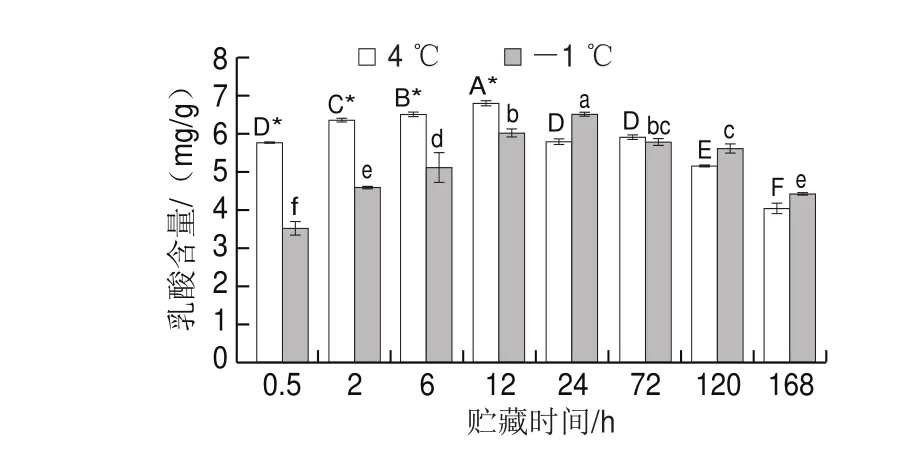
图 3 不同贮藏温度对猪里脊肉乳酸含量的影响Fig. 3 Effect of different storage temperatures on lactic acid content of pork tenderloin
EMP在生物体内广泛存在,被认为是对生物体具有重要意义的中心代谢途径,乳酸是动物宰后EMP的最终产物,其含量是评价无氧EMP程度与肉品质的重要指标[27-29]。由图3可知,宰后猪里脊肉在-1 ℃和4 ℃贮藏条件的乳酸含量均先逐渐增加后缓慢下降,在0.5~12 h贮藏期间4 ℃贮藏下猪里脊肉的乳酸含量高于-1 ℃(P<0.05),是因为在无氧条件下,葡萄糖通过EMP生成大量乳酸,且温度越高代谢速率越快,乳酸生成速率越快。在24~120 h贮藏期间猪肉乳酸含量上升,是因为后期EMP终止,氨基酸蛋白质分解导致pH值上升,且微生物也开始入侵,因此乳酸含量有所下降;且-1 ℃贮藏组猪肉乳酸含量高于4 ℃贮藏组,是因为后期-1 ℃低温延缓了乳酸的下降速率。因此,-1 ℃贮藏的保鲜效果要好于4 ℃。由图2、3可知,乳酸含量与葡萄糖含量的结果大致呈相反趋势,说明贮藏过程中葡萄糖被消耗,乳酸积累。且温度越低乳酸含量变化速率越慢[30]。
2.3 不同贮藏温度对NADH含量的影响
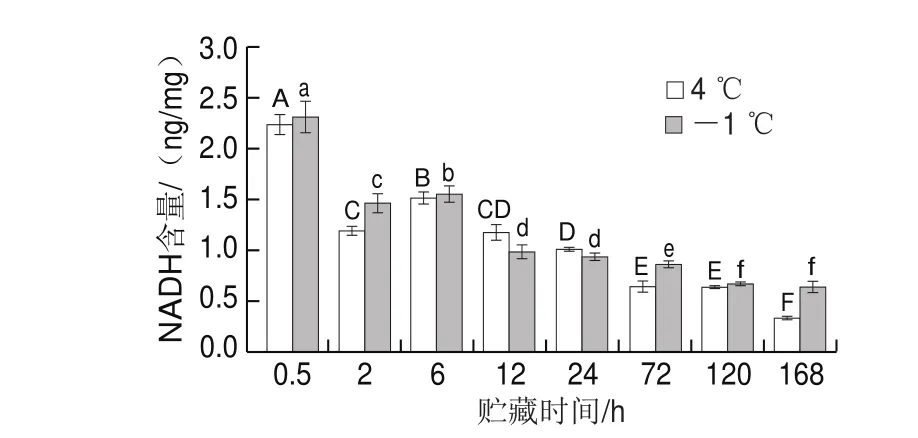
图 4 不同贮藏温度对猪里脊肉NADH含量的影响Fig. 4 Effect of different storage temperatures on NADH content of pork tenderloin
NADH不仅是EMP和细胞呼吸作用中的主要电子供体,还是EMP中的重要代谢产物。在有氧条件下乳酸在乳酸脱氢酶的作用下结合NAD+生成丙酮酸和NADH,丙酮酸进入TCA循环。而无氧条件下丙酮酸在乳酸脱氢酶的作用下发生脱羧和还原反应,其中还原剂是NADH,最终生成乳酸和氧化态的NAD+,提供了EMP所需要的NAD+,NADH和NAD+在EMP途径中相互转化,在维持机体代谢网络平衡中起到了重要作用。由图4可以看出,NADH含量在0.5~12 h贮藏过程中呈下降趋势,与此段时间乳酸含量趋势相反,因为4 ℃贮藏下乳酸含量下降要快于-1 ℃,所以消耗的NADH多,因此在贮藏的0.5~12 h,-1 ℃贮藏下的NADH含量高于4 ℃。说明机体中NADH与乳酸之间存在一定相互关系,并且温度的变化会影响宰后机体的代谢物的变化。
2.4 不同温度、不同时间贮藏下宰后猪里脊肉的乳酸代谢通量
通过测定不同温度、不同时间贮藏下宰后猪里脊肉组织中葡萄糖、乳酸和NADH含量的变化速率,并通过平衡方程(表3)求出代谢图中其他未知变化速率,运用Excel 2010软件进行数据整理并进行归一化处理(统一为100),然后对数据进行通量分析,得到4 ℃和-1 ℃贮藏条件下的乳酸代谢通量图,代谢网络属于有向加权网,整个代谢网络以代谢底物、代谢产物或者中间代谢物为网络节点,以实际的反应为边线,反应方向为箭头的方向,通过代谢网络图可以清楚地看到每一条代谢途径的流向和趋势,结果如图5所示。

图 5 不同温度对猪里脊肉作用所产生的乳酸代谢通量图Fig. 5 Lactic metabolic flux map of lactic acid in pork tenderloin stored at different temperatures
从图5中可以看出,根据构建的代谢网络图以及相应的速率计算,可以得到宰后猪里脊肉在不同温度、不同时间贮藏下的乳酸代谢网络通量变化情况。在不同温度相同贮藏时间下的乳酸代谢通量明显不同,并且在同一温度下不同贮藏时间的乳酸代谢通量也明显不同。温度的变化使猪酮体中EMP的速率发生了变化。从图5可以看出,葡萄糖大多数进入了EMP途径,说明EMP途径在碳源的代谢上具有重要的作用。从丙酮酸节点来看,大部分丙酮酸生成乳酸,很少部分生成AcCoA进入TCA循环。-1 ℃贮藏时进入PPP的通量要高于4 ℃,说明4 ℃条件下机体的分解代谢速率比-1 ℃贮藏条件下要快,-1 ℃条件下合成代谢增强。这与Marsh等[31]报道的提高肌肉温度可以加快代谢速率结论一致。这表明温度对代谢通量具有明显的调节作用,温度越低分解代谢速率越低,这对于实际的理论研究具有一定的指导意义。
为了进一步分析不同温度不同贮藏时间下,宰后猪里脊肉乳酸代谢通量的变化趋势及乳酸代谢通量的分布规律,建立如图6所示的柱状图。
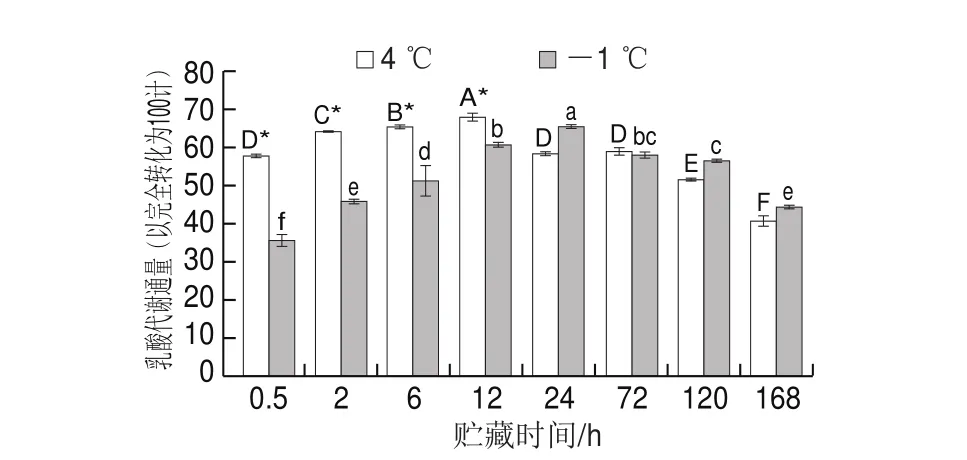
图 6 不同贮藏温度对猪里脊肉乳酸代谢通量的影响Fig. 6 Effect of different storage temperatures on lactic acid metabolic flux in pork tenderloin
由图6可知,随着贮藏时间的延长,在4 ℃和-1 ℃贮藏下的乳酸代谢通量均显示先上升后缓慢下降的趋势,且宰后猪里脊肉的乳酸代谢通量在4 ℃贮藏12 h时已经达到最大值,而在-1 ℃贮藏下的乳酸代谢通量24 h才达到最大值,比4 ℃贮藏延迟12 h 。4 ℃贮藏0.5~12 h的猪里脊肉乳酸代谢通量之间差异显著,这一结果与朱学伸[3]的报道结果类似。-1 ℃贮藏下猪里脊肉的乳酸代谢通量在0.5~12 h之间出现显著上升的趋势(P<0.05),24 h后开始降低,72~168 h之间差异不显著(P>0.05)。在贮藏0.5~12 h时4 ℃和-1 ℃的乳酸代谢通量具有显著差异(P<0.05)。结果表明:-1 ℃贮藏比4 ℃能够更有效地减缓EMP的速率,同时对乳酸含量的降低也有一定的延缓作用。温度可以影响EMP的速率,低温可以抑制或者减缓乳酸的积累,这与王会松等[32]研究发现某些原因(如常规的低温贮藏或适当温度的热处理等)可以使甜瓜呼吸代谢受到限制从而产生较多的乳酸,此时机体的分解代谢降低,更有利于延长果蔬的货架期有相似之处。
3 结 论
本实验通过对宰后猪里脊肉在不同温度和不同贮藏时间下的乳酸代谢通量进行分析,发现宰后猪里脊肉在冰温-1 ℃贮藏下葡萄糖、乳酸、NADH的含量均与4 ℃贮藏条件下的明显差异,且-1 ℃贮藏下的保鲜效果好于4 ℃,从代谢网络图中发现,在不同温度相同贮藏时间下的乳酸代谢通量明显不同,并且在同一温度下不同贮藏时间的乳酸代谢通量也显著不同,且在贮藏0.5~12 h期间,-1 ℃贮藏的猪里脊肉乳酸代谢通量比4 ℃贮藏时低,而在贮藏12~168 h期间,-1 ℃的乳酸代谢通量高于4 ℃,表明低温有利于降低葡萄糖的分解代谢,延缓了葡萄糖在EMP途径中转化为乳酸的速率,从而延缓了乳酸的积累。通过对乳酸代谢通量的分析,期望从基本的代谢水平来揭示宰后鲜肉受到外部环境影响后机体的变化,以便为寻找适合鲜肉贮藏的最佳温度条件提供更为科学的理论和依据。

