数字化实验在《化学反应原理》教学中的运用研究
蓝丽凤
[摘要]信息技术与教学的融合是当前教学研究的热点。化学教学中融入数字化实验,解决了传统实验“定性不定量,定量不体现过程”的问题,超越了传统实验。《化学反应原理》的知识抽象、难理解,为此结合课题研究小组的实践经验,以案例的形式,分享数字化实验在突破教学难点、提升认知方式、创新教学模式、培养学生学科核心素养等方面发挥的重要作用,促进数字化实验在化学教学中的运用研究。
[关键词]数字化实验;化学反应原理;运用
[中图分类号]G633.8 [文献标识码]A [文章编号]1674-6()58(2020)02-0075-02
数字化实验简称DIS(Digital Information System)实验,是通过计算机、传感器、数据采集器和相关软件组成的能够定量采集数据,并以图表的形式清晰、准确呈现出来的现代化的新型实验技术手段。数字化实验也被称为“手持技术”“掌上技术”“传感器实验”“DIS实验”等。它具有直观、便携、实时、综合、绿色等特点。下面以《化学反应原理》的教学为例,谈谈如何应用数字化实验,使微观反应宏观化,进而突破教学难点,拓展探究问题的深度和广度,创新教学模式,从而提升学生的认知方式,培养学生的化学学科核心素养。
一、利用数字化实验,使微观反应宏观化,突破教学难点
微观反应宏观化是培养“宏观辨识与微观探析”核心素养的重要保障,而数字化实验可以使微观反应变得真实、直观。连接实验装置及相关设备,计算机能将复杂的数据以图表的形式动态呈现,让实验结果一目了然地呈现在学生面前,帮助学生将抽象、概括的知识转化成形象、具体的理解,从而有效突破教学难点。下面以“弱电解质的电离”为例进行阐述。
传统教学中比较盐酸与醋酸的酸性强弱,用的是pH试纸和镁条,宏观现象明显,操作简单,但是定性不定量,没有数据支持,说服力不强。涉及电离平衡移动知识时,只是枯燥地讨论外界条件对电离平衡的影响。为此,笔者所在课题组,借助数字化实验,用pH传感器和压强传感器测量绘制曲线,改良了上述实验。
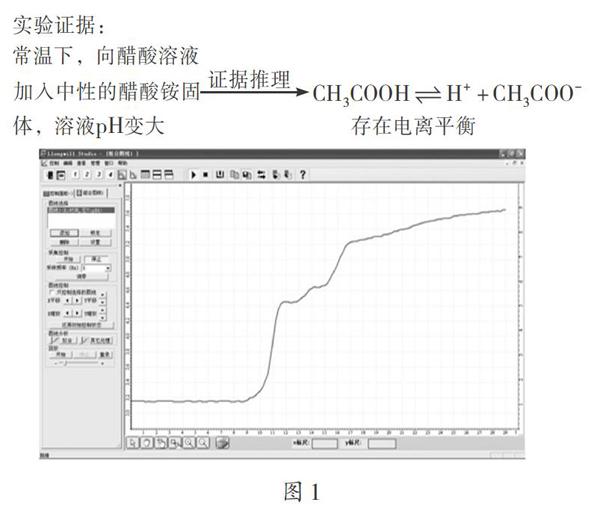
【实验1】探究盐酸和醋酸的电离程度
常温下,分别向0.1 mol/L的HCl和CH3COOH溶液中不断加入中性的NaCl和CH3COONH4固体,用pH传感器测量溶液pH的变化情况,实时呈现溶液pH随时间变化的图像(如图1)。反应的微观本质是增大CH3COO-浓度,CH3COO-结合H+生成CH3COOH,平衡右移,从而降低H+浓度。宏观上呈现出盐酸pH不变,醋酸pH增大,从而证明了盐酸完全电离,醋酸部分电离,存在电离平衡。
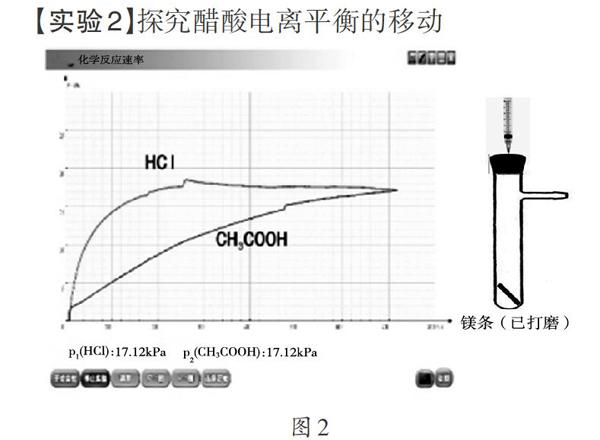
【实验2】探究醋酸电离平衡的移动
常温下,向两支盛有等量Mg条的具支试管中分别同时加人过量的1 mL 1 mol/L HCl和1 mL 1 mol/L CH3COOH,利用压强传感器测量试管内的压强变化,绘制压强(p)随时间(t)变化的曲线(如图2)。等体积、等浓度的盐酸和醋酸溶液中,由于盐酸完全电离,初始H+浓度大于醋酸,因此反应速率较快。加入镁条后,醋酸中的H+被消耗,电离平衡被破坏,平衡右移,直至醋酸完全消耗,因此最终生成等量的氢气。通过观察压强一时间曲线,判断两者速率的大小,直观、高效地揭示了强弱电解质的本质。
利用数字化实验,通过数字、图像的读取,强化学生对于抽象知识点的理解,使看不见、摸不着的弱电解质电离平衡真实、直观地呈现在学生面前,从而突破教学难点。实验过程中还培养了学生“宏观辨识与微观探析”“证据推理与模型认知”“变化观念与平衡思想”等化学学科核心素养。
二、利用数字化实验,融合四重表征教学模式,促进学生认知方式的提升
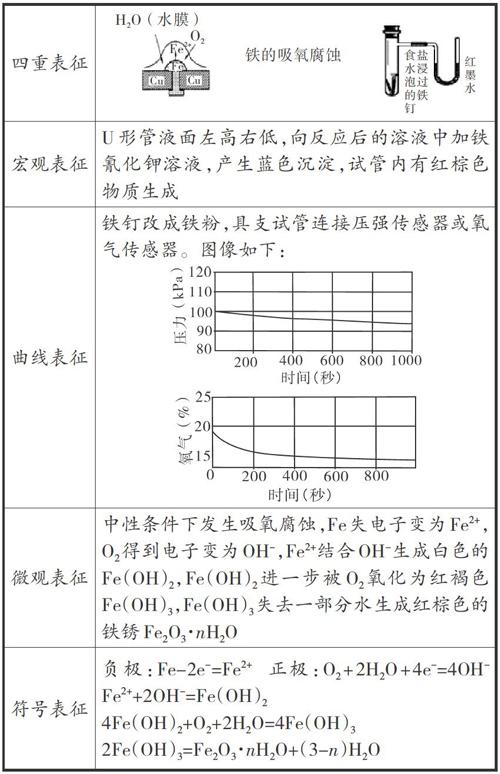
四重表征方式是化學教学中的一种常见的教学方法,它主要是从宏观、微观、符号、曲线四个方面帮助学生理解知识,让学生的思维完成从宏观到微观的一个转变。下面以“铁的吸氧腐蚀”为例来进行阐述。
鲁科版教材没有设计实验探究铁的腐蚀原理,其他版本的教材实验也无法直观显示空气中的氧气参与了反应,仅仅通过U形管的水柱变化进行逻辑推理,无法化解学习难点。笔者将铁钉改成铁粉以缩短反应时间,再将具支试管的出口连接压强传感器或氧气传感器,直接测量氧气的数据。在宏观现象的基础上,从实验曲线分析相关量的变化,再从微观角度分析其主要粒子的变化,最后落实符号信息,具体如下表所示。
由此可见,《化学反应原理》的教学可融合“宏观一曲线一微观一符号”四重表征教学模式,通过分析实验曲线,探究宏观现象背后的微观本质,再从微观的角度分析主要微粒的实质变化,最后落实符号表述,引导学生从现象到本质来理解化学概念、反应本质及实验原理,从而促进学生认知方式的提升。
三、利用数字化实验,深化定量实验,培养学生学科核心素养
酸碱中和滴定实验承载着实现课标中“体会定量研究的方法对研究和学习化学的作用”要求的功能,其重要性不言而喻。鲁科版选修4中的中和滴定,采用的是传统实验,利用酸碱指示剂的变色定性判断终点,通过计算求出未知酸或碱的浓度。该探究存在不足之处:①利用指示剂的变色定性判断中和滴定的终点,人为误差较大;②无法体现滴定突跃与指示剂的选择的关系;③难以说明滴定终点可以代替反应终点(化学计量点)的原理;④pH的突跃是真实存在的,但传统实验却无法让学生直观感受到它的存在。引入数字化实验可以弥补上述不足。以盐酸滴定NaOH和氯水的实验为例,实验图如图3所示。
从图3曲线可以看出,pH变化不是均匀的,在盐酸量为滴加25 mL之前的初始阶段,pH变化很缓慢;在25 mL左右,pH变化迅速;在25 mL后,pH变化缓慢。pH的突跃是真实存在的,在25 mL前一滴和后一滴,溶液的pH从4.31变化到9.70,变化幅度较大。
指示剂选择时要选择颜色变化灵敏、显著且颜色变化范围窄的。人眼对蓝色与紫色分辨率低,因此不用石蕊。指示剂的变色范围和反应终点pH=7会有一定的差距,但是对照滴定曲线,发现指示剂的变色刚好在pH突变范围内,因此酸碱指示剂可以用来指示中和滴定的终点。按照反应终点盐溶液的pH与指示剂变色范围相一致的原则来选择指示剂,例如盐酸滴定氨水,反应时生成的氯化铵溶液呈酸性,因此选择甲基橙;而强酸强碱的滴定,由于生成的盐溶液呈中性,用甲基橙或酚酞都可以。指示剂附表如下:
传统酸碱中和滴定实验侧重于具体操作步骤、酸碱滴定管的规范使用、观察滴定终点的现象。而中和滴定的数字化实验通过pH传感器自动绘制出滴定曲线,使学生真实地感受到滴定过程的“突跃”;然后分析曲线变化趋势,透过现象看本质,分析曲线的起点、终点、拐点等特殊点,分析不同节点的微粒成分及变化,从而引发学生深层次的思考。实验过程中帮助学生体验宏观和微观的有机结合。定量实验的纵深学习,培养了学生“宏观辨识与微观探析”“变化观念与平衡思想”等化学学科核心素养。
总而言之,数字化实验为中学化学教学带来了革命性的变化,成为中学化学教学改革的一道亮丽风景。教学中运用数字化实验是非常必要的,对培养学生学科核心素养,增强实验教学的有效性等具有积极意义。如何进一步创造性地发挥数字化实验的作用,我们教师将继续研究和探索。生命不息,教改不止,如此方能与时俱进。

