氯唑西林人工抗原的合成及其抗体的制备
张冬昊,赵桐桐,何扩
(河北北方学院河北省农产品食品质量安全分析检测重点实验室,河北张家口075000)
氯唑西林(cloxacillin,CLOX),属于半合成类青霉素类抗生素[1],主要用于治疗动物的败血症、呼吸道感染、以及皮肤和软组织感染,是治疗牛乳腺炎的最佳用药[2]。一度成为牲畜疾病预防和治疗使用最多的抗生素类药物之一。氯唑西林在畜禽养殖中的不规范使用,造成环境和食品中残留的氯唑西林超标,严重影响食品的安全性与人体的健康。残留主要危害有:可引起皮肤、消化道甚至呼吸道的过敏反应;干扰人体的正常生理机能,影响儿童和青少年的生长发育;降低人体对致病菌的抵抗能力;由于革兰氏阳性菌G+对青霉素的耐药性较高,可诱发耐药性的产生;给出口带来障碍,造成经济上的损失[3-8]。我国在2008 年的农业部235 号公告规定氯唑西林在动物源组织中的限量值为300 μg/kg,牛奶中氯唑西林规定为不得超过30 μg/L[9]。目前检测氯唑西林主要方法是高效液相色谱法和液相色谱串联质谱法,如章敏等[10]通过该方法对牛奶中氯唑西林的残留量进行测定,线性范围为5 ng/mL~1 000 ng/mL,且具有良好的相关系数,其样品检出限为15 ng/mL。李学民等[11]根据液相色谱-串联质谱法对河豚鱼和鳗鱼中氯唑西林残留量进行检测,此方法在国家标准的基础上进行了优化,其回收率达84.1%以上,检出限为2.0 μg/kg。郭萌萌等[12]依据液质联用法,先将水产品中氯唑西林残留提取净化,后优化质谱条件快速准确地检验水产品氯唑西林的残留,对氯唑西林的检出限2.6 μg/kg。
酶联免疫法是近年新兴的一种快速检测方法,主要应用高度特异性抗原-抗体的免疫反应与酶对作用底物的高效催化作用相结合起来的一种免疫检测技术,具有快速便捷,操作简单,适合现场快速筛选测定的特点[13-14]。该技术在食品中兽药残留检测当中应用最广,国内外已有许多检测兽药残留的商品化酶联免疫(enzyme-linked immuno sorbent assay,ELISA)试剂盒,具有良好的市场需求和远大的发展前景。目前关于氯唑西林特异性抗原-抗体的合成还未有报道。本文首先采用碳化二亚胺法合成氯唑西林免疫抗原和检测抗原,其次通过红外光谱扫描鉴定,然后免疫小鼠得到氯唑西林抗体,最终对氯唑西林抗体的效价及其特异性进行检测。
1 材料与方法
1.1 材料及试剂
氯唑西林:北纳创联科技有限公司;碳二亚胺盐酸盐 [1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC]、N-羟基琥珀酰亚胺(N-hydroxysuccinimi,NHS)、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF):上海晶纯生化科技股份有限公司;牛血清白蛋白(bovine albumin,BSA)、卵清白蛋白(ovalbumin,OVA)、弗氏完全佐剂、弗氏不完全佐剂:Sigma 公司;3,3',5,5'-四甲基联苯胺显色液(3,3',5,5'-tetramethylbenzidine,TMB):北京索莱宝科技有限公司;辣根过氧化物酶标记山羊抗小鼠IgG(H+L):北京中杉金桥生物技术有限公司;羊血清:河北北方学院河北省农产品食品质量安全分析检测重点实验室自制;其他试剂均为分析纯。
1.2 仪器与设备
磁力搅拌器(RH-2):德国 IKA 公司;MULTISKAN MK3 酶标仪(Thermo Multiskan FC):美国 Thermo Scientific 公司;紫外可见分光光度计(U-3900):日立高新技术公司;双杰电子天平(JJ100):常熟市双杰测试仪器厂;仪都离心机(TGL-16A):金坛市岸头仪都仪器厂。
1.3 试验动物
5 周龄 SPF 级 KM 雌性小鼠[SCXK(京)2014-0004]:5 只,北京华阜康生物科技股份有限公司。
1.4 方法
1.4.1 氯唑西林人工抗原的制备及其鉴定
采用碳化二亚胺法制备氯唑西林人工完全抗原。称取7.5 mg CLOX(氯唑西林标准品)、21.1 mg EDC(碳二亚胺盐酸盐)、8.5 mg NHS(N-羟基琥珀酰亚胺)使其溶于 1.5 mL 的 DMF(N,N-二甲基甲酰胺),25 ℃避光,在磁力搅拌器上反应4 h,制得A 液。称取25 mg 的BSA 溶解于3.5 mL 0.01 mol/L pH 为7.4 的磷酸缓冲液(phosphate buffered saline,PBS)中,在 4 ℃下预冷反应12 h,制得B 液。将溶液A 逐滴加入到溶液B 中使之充分混合,在磁力搅拌器下避光反应12 h。将混合液装入透析袋中,用 0.01 mol/L 的 PBS(pH 7.4)4 ℃下透析72 h,每8 h 换一次透析液,制得免疫抗原CLOX-BSA。-20 ℃保存。
同样的方法将BSA 换成OVA,制得包被抗原CLOX-OVA。-20 ℃保存。
1.4.2 完全抗原的鉴定
用磷酸盐缓冲液(PBS)按照一定比例稀释CLOX、BSA、OVA 和 CLOX-BSA、CLOX-OVA,空白对照用PBS,在紫外分光光度计200 nm~400 nm 处开始扫描,然后对扫描得到的图谱组合在一起,是否偶联成功通过定性证明。
1.4.3 动物免疫
实验动物饲养于河北北方学院实验动物中心[SYXK(冀)2014-0062],不控制它的饮水和进食。预测期为7 d,挑选取用5 只健康KM 雌性小鼠分别进行在腹腔部位进行免疫,1.00 mg/kg/次(以载体蛋白含量计算),每次免疫时间间隔为14 d,一共需要免疫5 次。第一次使用完全相同剂量的弗罗因德佐剂乳化抗原注射和免疫抗原混合均匀免疫小鼠,随后接下来的第二次、第三次、第四次注射均可采用免疫完全相同量的不完全弗罗因德佐剂乳化抗原和免疫抗原混合均匀免疫小鼠,最后一次直接注射免疫抗原,来加强免疫。在第3 次免疫注射后的第7 天,从免疫注射的实验小鼠中随机取1 只小鼠进行断尾采血,然后用间接ELISA法检测抗体效价。最后一次加强免疫后第7 天,摘取小鼠眼球进行采血,在25 ℃下放置1 h,在4 ℃以下过夜,用离心机进行离心,采集其上清,在-20 ℃中保存[15]。
1.4.4 抗体效价的测定
用间接ELISA 测定氯唑西林抗体效价[16]。
包被抗原:将检测抗原进行倍比稀释,然后纵向加入酶标板,100 μL/孔,37 ℃条件下孵育 2 h,使用磷酸盐洗液(phosphate buffered saline-tween,PBST)洗涤3 次,每次3min,拍干。封闭:将配制好的封闭液加入酶标板,200 μL/孔,4 ℃过夜保存;PBST 洗涤,拍干。加一抗:抗体用PBS 进行倍比稀释,同时采集健康小鼠的血清(200×稀释)作阴性对照,横向加入酶标板,100 μL/孔,37 ℃条件下孵育1 h;PBST 洗涤,拍干。加酶标二抗:加辣根过氧化物酶标记山羊抗小鼠LgG(H+L),用PBS 按照 1 ∶2 000 体积比稀释,100 μL/孔,37 ℃条件下孵育 1 h;PBST 洗涤,拍干。显色:TMB 10 mL,100 μL/孔,避光显色 5 min。终止:1 mol/L H2SO4终止反应,100 μL/孔;用酶标仪读取整板 OD450值。
1.4.5 抗体特异性的测定
用竞争法测定氯唑西林抗体的特异性[17]。
包被抗原:可根据1.4.4 用间接ELISA 测定氯唑西林抗体效价获得抗原最佳包被浓度,每孔100 μL,在37 ℃条件下孵育2 h,用PBST 液清洗3 次,每次清洗时间为3 min,然后在滤纸上拍干。封闭:在酶标板中滴加5 %的羊血清,每孔加200 μL,在37 ℃下孵育1 h,用 PBST 液清洗 3 次,每次清洗时间为 3 min,然后在滤纸上拍干。加一抗:加入最佳工作浓度的氯唑西林抗体和不同浓度的氯唑西林标准品(或其他标品),此阶段氯唑西林标准品抑制包被好得检测抗原CLOX-OVA 与氯唑西林抗体反应。根据1.4.4 用间接ELISA 测定氯唑西林抗体效价获得本次试验抗体最佳竞争浓度为 1 ∶32 000,首先将 2 mL PBS(pH 7.4)与2 μL 氯唑西林抗体进行混匀后,然后从中吸取200 μL液体加入6.2 mL PBS 中。即得到氯唑西林抗体最佳工作浓度。每孔50 μL,并加入不同浓度的氯唑西林标品(或其他标品),本试验使用标品的浓度为:0.1、1、10、100、1 000、10 000 ng/mL。分别加入到酶标板的每一行中,每孔50 μL,其中要做两个对照组,阴性对照组使用氯唑西林抗体,阳性对照使用氯唑西林标品。在37 ℃下孵育1 h,用PBST 液清洗3 次,每次清洗时间为3 min,然后在滤纸上拍干。加酶标二抗:酶标二抗为加辣根过氧化物酶标记山羊抗小鼠IgG,遵照说明书,用 PBS 作稀释,稀释比例为 1 ∶5 000,每孔加 100 μL,在37 ℃下孵育1 h,用PBST 液清洗3 次,每次清洗时间为3 min。显色:使用TMB 单组分显色液,每孔加入100 μL,避光显色 5 min。终止:1 mol/L H2SO4终止反应,100 μL/孔;用酶标仪读取整板OD450值。试验分别测定各个浓度氯唑西林标品竞争后的OD450值,通过以下公式计算各个浓度的抑制率,然后以抑制率为纵坐标,添加氯唑西林标品浓度的对数为横坐标,绘制氯唑西林抗体的竞争曲线,得到氯唑西林抗体的IC50值和IC15值从而筛选出灵敏度最高的抗体。

式中:B空白为空白对照的 OD450值;B对照为阴性对照的OD450值;B样品为添加各个浓度氯唑西林标品竞争后的OD450值。
按以上方法将氯唑西林标品换为其他药品,通过计算得到其他药品对氯唑西林抗体的IC50值,将其代入以下公式,得到其他药品与氯唑西林抗体的交叉反应率。使用4 种氯唑西林同种类抗生素:阿莫西林、哌拉西林、氨苄青霉素、甲砜霉素及3 种常用抗生素为四环素、链霉素、呋喃它酮,与氯唑西林抗体进行交叉反应试验。交叉反应率的计算公式为:
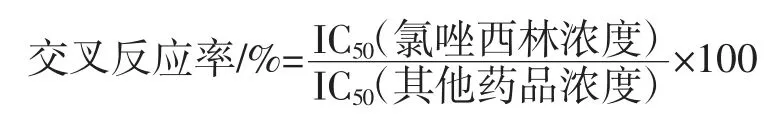
1.4.6 抗体浓度的测定
将200 μL 氯唑西林抗体加入到3.8 mL 磷酸盐缓冲液(PBS)中,充分混匀得到氯唑西林抗体稀释液。将紫外分光光度计进行调零,使用PBS 当作空白对照,测定PBS 在波长为280 nm 处的吸光度值,将比色皿洗净后,测定氯唑西林抗体稀释液在波长280 nm 处的吸光度值,代入以下公式可得氯唑西林抗体浓度。重复以上操作3 次,求抗体浓度的平均值。

式中:A1为抗体蛋白在 280 nm 的吸光度值;A0为空白对照的吸光度值;1.35 为蛋白系数。
2 结果与分析
2.1 完全抗原的红外光谱扫描鉴定结果
图1 为 CLOX、BSA 和 CLOX-BSA 的红外光谱图。

图1 CLOX-BSA 的红外光谱图Fig.1 The IR spectrum plot of CLOX-BSA
如图1 所示,BSA 是典型蛋白质红外光谱,有4 个明显吸收峰,分别在 1 532、1 653、2 933 cm-1和 3 300 cm-1处,其中1 532 cm-1处是酰胺中C=O 伸缩振动引起的吸收峰;1 653 cm-1处是酰胺中N-H 键弯曲振动引起的吸收峰;2 933 cm-1处是-CH2-基团和-CH3的吸收峰;3 300 cm-1处是-NH-基团的吸收峰。谱图中氯唑西林分子有以下几个明显吸收峰:1 039 cm-1处为C-OC 伸缩振动峰;1 680 cm-1处和 1 714 cm-1处为 C=O 伸缩振动引起的吸收峰;3 398 cm-1处为Ar-OH 中的O-H伸缩振动引起的吸收峰。
由光谱图可知CLOX-BSA 多处吸收峰与BSA 谱带重合,具有较高相似度。但CLOX-BSA 在2 850 cm-1处有明显吸收峰,BSA 光谱图中没有与之对应的吸收峰存在。由此可以证明CLOX 已经成功与BSA 偶联,可以用于免疫。
图2 为CLOX、OVA 和CLOX-OVA 的红外光谱图。
如图2 所示,OVA 同BSA 一样是典型蛋白质红外光谱,分别在 1 532、1 653、2 933 cm-1和 3 300 cm-1处有明显吸收峰,其中1 532 cm-1处是酰胺中C=O 伸缩振动引起的吸收峰;1 653 cm-1处是酰胺中N-H 键弯曲振动引起的吸收峰;2 933 cm-1处是-CH2-基团和-CH3的吸收峰;3 300 cm-1处是-NH-基团的吸收峰。谱图中氯唑西林分子有以下几个明显吸收峰:1 039 cm-1处为C-O-C 伸缩振动峰;1 680 cm-1处和 1 714 cm-1处为C=O 伸缩振动引起的吸收峰;3 398 cm-1处为Ar-OH中的O-H 伸缩振动引起的吸收峰。由图2 可知OVA谱带中有4 个明显吸收峰,CLOX-OVA 谱图中的吸收峰均可与之对应,而且CLOX-OVA 拥有两个OVA 光谱没有的吸收峰,由此可以说明CLOX 与OVA 偶联成功。
2.2 抗体效价的测定
第3 次免疫后7 d,间接ELISA 法测定血清中CAP 抗体效价可达1 ∶32 000。加强免疫后抗血清效价的测定结果见图3。
由图3 可知,加强免疫后7 d,眼眶采血后测定血清中抗体效价最高可达1 ∶64 000,抗原最佳工作浓度是 1 ∶8 000,抗体最佳工作浓度是 1 ∶64 000。由此可证明CLOX 多克隆抗体制备成功。

图2 CLOX-OVA 的红外光谱图Fig.2 The IR spectrum plot of CLOX-OVA
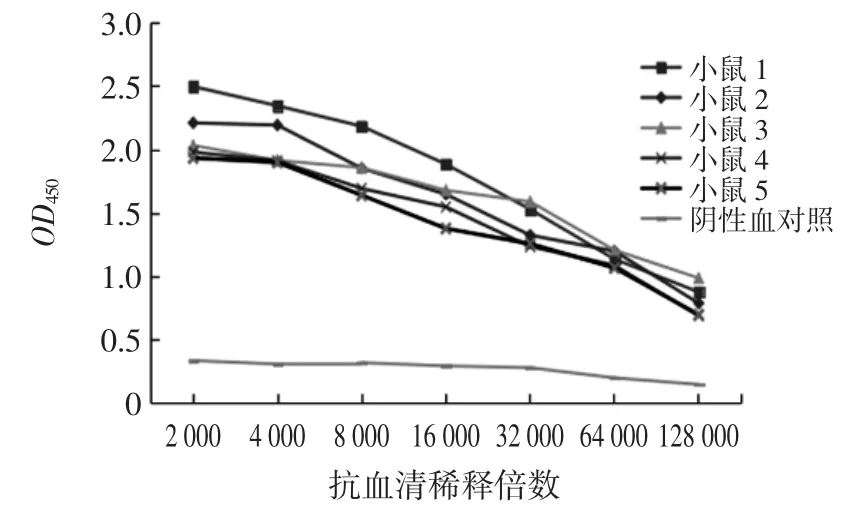
图3 加强免疫后抗血清效价的测定Fig.3 Determination of antiserum titer after boosting immunization
2.3 抗体特异性的测定
氯唑西林抗体竞争曲线见图4。
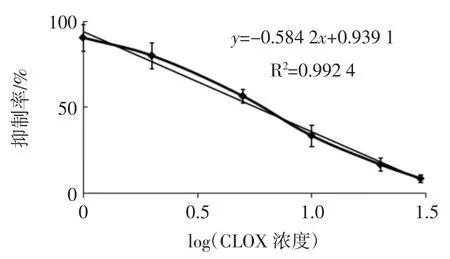
图4 CLOX 抗体的竞争曲线Fig.4 Competition curve of CLOX antibody
绘制的氯唑西林抗体的抑制曲线,其回归方程为y=-0.584 2x+0.939 1(R2=0.992 4),经计算可得到 IC50值为(5.64±0.03)ng/mL,IC15值为(22.43±0.02)ng/mL。
利用间接竞争ELISA 法测定氯唑西林抗体与氨苄青霉素、阿莫西林、哌拉西林、甲砜霉素、四环素及链霉素等抗生素的交叉反应。交叉反应结果见表1。

表1 氯唑西林抗体的交叉反应率Table 1 Cross-reaction rate of cloxacillin antibody
结果表明氯唑西林抗体具有良好特异性,与其他抗生素均无交叉反应。
2.4 抗体浓度的测定
将抗体稀释20 倍后,以PBS 为空白对照,用紫外分光光度计在波长为280 nm 下测定抗体浓度。根据公式,计算得到氯唑西林抗体浓度为2.96 mg/mL。
3 结论
由于氯唑西林相对分子质量为436,只具有应原性,而无免疫原性。所以在制备抗体时,它必须成功地与大分子蛋白偶联,才能对动物进行免疫。常用载体蛋白有 BSA、OVA、RSA、HSA 等,其中 BSA 和 OVA 均含有多组自由羧基和氨基可在EDC 与NHS 的辅助下与CLOX 进行快速偶联。使用此方法成功合成了免疫抗原CLOX-BSA 与检测抗原CLOX-OVA。现在对于鉴定人工抗原的方法主要紫外分光光度法、电泳鉴定法、红外光谱法、质谱法。由于分外光谱法操作较为简单,结果较为准确且合成的氯唑西林抗原与载体蛋白BSA、OVA、CLOX 的光谱图可以明显区分,所以本次试验使用红外光谱法鉴定即可。目前对抗体纯化的方法主要有盐析(辛酸-饱和硫酸铵法)、全抗原亲和纯化、蛋白G 亲和纯化、载体蛋白亲和纯化。据文献[18-20]报道表明:盐析法提纯效果最差且会造成大约为40%抗体的损失;全抗原亲和纯化纯化效果较差,造成严重的抗体损失并降低抗体的亲和常数;蛋白G 亲和纯化法纯化效果较好,不会对抗体造成负面影响;载体蛋白亲和纯化法纯化效果最佳,不仅可以去除多克隆抗体中识别载体蛋白的组分,而且可增强抗体的亲和常数。本试验采用辛酸-饱和硫酸铵法对抗体进行纯化,纯化效果未达到理想状态。今后可尝试其他方法对氯唑西林抗体进行纯化,从而获得最佳抗体。
本试验采用二亚胺法制备了氯唑西林完全抗原进行免疫小鼠,成功制备了氯唑西林抗体。试验获得的氯唑西林抗体的效价均达1 ∶64 000,绘制的氯唑西林抗体的抑制曲线,其回归方程为y = -0.584 2x +0.939 1,经计算可得到 IC50值为(5.64±0.03)ng/mL,IC15值为(22.43±0.02)ng/mL,与其他药品均无交叉反应,特异性强。氯唑西林人工抗原的合成及其抗体的制备为食品安全检验试剂盒的开发奠定了基础。

