白细胞介素-6抑制剂对银屑病模型大鼠背部皮肤组织的影响及作用机制
魏荣 吴斌 吕静
(三峡大学附属仁和医院皮肤科,湖北 宜昌 443001)
银屑病是由T淋巴细胞介导的、免疫反应异常所引起的慢性炎症性皮肤病,其主要临床症状表现为鳞屑性红斑〔1〕。目前临床上银屑病的流行病学调查显示,受多种基因的连锁影响,银屑病发生后较易引起代谢综合征、心血管疾病、糖尿病、高血压等多系统疾病,且认为上述并发症的严重程度与银屑病的严重程度有关〔2〕。有研究表明〔3〕,银屑病患者机体T淋巴细胞、免疫反应异常与白细胞介素(IL)-6的异常表达有关,IL-6在银屑病患者血清中为高表达,IL-6可对中性粒细胞、T淋巴细胞、嗜酸性粒细胞等具有较强的趋化作用,最终导致血管周围发生炎性细胞浸润。由于银屑病较为顽固难治、较易复发,临床上常规治疗此病的效果并不理想,目前已经成为世界范围内重大疑难病之一,严重影响着患者的正常生活〔4〕。本研究旨在观察IL-6抑制剂对银屑病模型大鼠背部皮肤组织的影响及作用机制。
1 材料与方法
1.1材料 研究动物:选择SD健康大鼠30只(SPF级),由基尔顿生物科技(上海)有限公司提供。鼠龄3~6个月,平均(3.8±1.5)个月;体重200~250 g,平均(220±7.9)g;饲养温度为22~25℃,室内湿度35%~40%,饲养室定时进行紫外线照射消毒。统一给予标准饲料,允许它们自由活动,饲养时间为1 w。本研究所做实验均获得医院伦理委员会批准。
主要试剂:IL-6抑制剂(北京白奥莱博科技有限公司,货号M07110);Trizol(美国Invitrogen公司);RNA提取试剂盒、反转录cDNA合成试剂盒、PCR扩增试剂盒(均购于天根生化科技(北京)有限公司,货号:DP422、KR103、KT109)。
1.2分组及建模 将30只大鼠随机分为空白对照组、银屑病组和IL-6抑制剂组各10只,参照高扬等〔5〕研究实验中银屑病模型建立方法建立银屑病大鼠模型,将所有大鼠背部中央2 cm×4 cm的毛发区处的毛发全部剃除,之后按照0.05 g/cm2的标准将药膏均匀涂抹至剃除的毛发区,空白对照组大鼠剃除的毛发区均匀涂抹凡士林乳膏,银屑病、IL-6抑制剂组大鼠剃除的毛发区均匀涂抹咪喹莫特乳膏,每日1次,共涂抹14 d。若在建模过程中大鼠背部中央毛发区再次长出毛发,重复进行脱毛处理。
1.3给药 建模成功后,IL-6抑制剂组大鼠腹腔注射5 mg/kg IL-6抑制剂,空白对照组、银屑病组腹腔注射等剂量的生理盐水,4 w注射1次,共注射3次,在对大鼠最后一次给药后2 d观察大鼠变化。
1.4背部皮肤组织样本采集 给药结束后,采用断头法处死3组大鼠,取大鼠背部皮肤组织分为两份,其中1份在10%的甲醛溶液中进行固定,制备石蜡切片,测定大鼠背部皮损表皮厚度、Baker病理评分、炎性细胞计数及苏木素-伊红(HE)染色观察病理组织学病变情况。另一份液氮冷冻保存,作后续指标检测。
1.5HE染色及背部皮损表皮厚度检测 将所制备的大鼠背部皮损组织在10%甲醛溶液中进行固定,脱水透明,浸蜡包埋,脱蜡、HE染色,之后脱水、透明,待封片晾干后再显微镜下观察大鼠背部皮损组织病理学表现。采用IPP6.0软件测量表皮厚度。
1.6Baker病理评分、炎性细胞计数 ①Baker病理评分标准。角质层:2分:出现小脓疡;1分:角化不完全;0.5分:过度角化计。表层:1分:表层中见有颗粒细胞层消失;1分:棘层肥厚。真皮层:5分:毛细血管扩张;出现单一多核细胞浸润,根据严重程度分为重度、中度、轻度,分别计为2分、1分、0.5分。②炎性细胞计数。Baker病理评分完成后,使用光学显微镜对大鼠背部皮肤组织进行摄片,采用Imagepro-plus6.0图像分析系统对所选视野中的炎性细胞进行计数。
1.7背部皮肤组织中IL-17、IL-22、IL-23表达水平检测 取液氮冷冻保存的大鼠背部皮肤组织,使用酶联免疫吸附试验检测,将采集到的标本,取包被液〔pH9.5 0.05 mol/L磷酸盐缓冲液(CB)〕适当稀释的抗IL-17、IL-22、IL-23 0.1 ml,添加至聚苯乙烯反应板孔中,加盖后温度4℃ 24 h,次日使用洗涤剂洗涤3次后,甩干。在各孔中加入稀释液(pH7.4 0.02 mol/L Tris-HCl缓冲液)稀释的待测标本0.1 ml,同时加入阳性和阴性的对照标本,在43℃置60 min,将液体移除洗涤3次后,甩干。在各孔中加入IL-17、IL-22、IL-23的酶标抗体0.1 ml,43℃置60 min。液体移去后洗涤3次,甩干。在各个空中加入底物液(0.1 mol/L Na2HPO4(Na2HPO4·12H2O 35.8 g/L)5.14 ml,0.05 mol/L枸橼酸(10.5 g/L)4.86 ml混匀,加入邻苯二胺(OPD)4 mg,置棕色小瓶中,临用时加30% H2O24.0 μl,混匀0.1 ml,黑暗环境下放置20 min,在各孔中加入2 mol/L H2SO40.05 ml,终止反应。在酶标仪上读取A405吸收值。分析IL-17、IL-22、IL-23水平。
1.8背部皮肤组织中IL-6受体/Janus激酶/信号转导和转录激活因子(IL-6R/JAK/STAT3)通路因子mRNA表达量检测 取液氮冷冻保存的大鼠背部皮肤组织,加入1 ml Trizol研磨为粉末状,按照制备试剂盒说明书提取大鼠背部皮肤组织中总RNA,之后对RNA纯度、含量进行检测,使用Takara逆转录试剂盒行逆转录处理后获得cDNA,之后使用Primer5.0软件对引物序列进行设计,使用RT-PCR方法检测大鼠背部皮肤组织中IL-6R/JAK/STAT3通路因子mRNA表达量,采用2-△△Ct方法计算出需要检测的IL-6R、JAK1、STAT3、CD80、CCL5 mRNA表达量。IL-6R引物序列:上游:5′-CATGTGCGTCGCCAGTAGT-3′,下游:5′-AGCTCAAACCGTAGTCTGTAGA-3′;JAK1引物序列:上游:5′-AGTGCCCTGAGCTACTTGGA-3′,下游:5′-AGGTCAGCCAGCTCCT-3′;STAT3引物序列:上游:5′-ATCACGCCTTCTACAGACTGC-3′,下游:5′-CATCCTGGAGATTCTCTACCACT-3′;CD80引物序列:上游:5′-AAACTCGCATCTACTGGCAAA-3′,下游:5′-GGTTCTTGTACTCGGGCCATA-3′;CCL5引物序列:上游:5′-GCAAGGAGACCACCAACAG-3′,下游:5′-CCCTCACTTCCAACCCAAATC-3′;β-actin引物序列:上游:5′-TGACGTGGACATCCGCAAAG-3′,下游:5′-CTGGAAGGTGGACAGCGAGG-3′。
1.9统计学处理 采用SPSS19.0软件进行方差分析、t检验。
2 结 果
2.13组大鼠一般情况观察 空白对照组大鼠背部备皮区皮肤始终为淡红色的光滑皮肤,无鳞屑、红斑、糜烂症状出现。银屑病组大鼠背部皮区皮肤在建模后的第2天开始出现厚层银白色鳞屑和浸润性红斑症状,少量的大鼠出现出血点,且随着时间的推移,鳞屑、红斑症状逐渐加重。IL-6抑制剂组大鼠背部皮区皮肤鳞屑、红斑症状逐渐减轻、消退,逐渐恢复至正常。见图1。

图1 3组大鼠背部皮肤变化
2.23组大鼠病理组织学观察 空白对照组大鼠角质层较薄,颗粒层为2~4层,棘层大为2~3层。银屑病组大鼠颗粒层较为肥厚、颗粒层减少、存在少量的中性白细胞聚集、皮突下延呈杵状、真皮乳头上延,存在组织细胞、淋巴细胞浸润,真皮浅层毛细血管扩张、充血。IL-6抑制剂组大鼠表皮变薄,角化过度、角化不全基本消失,颗粒层增多,组织细胞、淋巴细胞浸润、真皮浅层毛细血管扩张、充血等症状表现显著减轻,基本恢复正常。见图2。

图2 3组大鼠病理组织学HE染色观察图(×100)
2.33组大鼠Baker评分、炎症细胞浸润数、表皮厚度比较 银屑病组、IL-6抑制剂组大鼠Baker评分、炎症细胞浸润数、表皮厚度均明显高于空白对照组(P<0.05);IL-6抑制剂组大鼠Baker评分、炎症细胞浸润数、表皮厚度均明显低于银屑病组(P<0.05)。见表1。
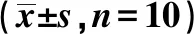
表1 3组大鼠Baker评分、炎症细胞浸润数、表皮厚度比较
与空白对照组比较:1)P<0.05;与银屑病组比较:2)P<0.05,下表同
2.43组大鼠背部皮肤组织中IL-17、IL-22、IL-23表达水平比较 银屑病组、IL-6抑制剂组大鼠背部皮肤组织中IL-17、IL-22、IL-23表达水平均明显高于空白对照组(P<0.05);IL-6抑制剂组大鼠背部皮肤组织中IL-17、IL-22、IL-23表达水平均明显低于银屑病组(P<0.05)。见表2。

表2 3组大鼠背部皮肤组织中IL-17、IL-22、IL-23表达水平比较
2.53组大鼠背部皮肤组织中IL-6R/JAK/STAT3通路因子mRNA水平比较 银屑病组、IL-6抑制剂组大鼠背部皮肤组织中IL-6R、JAK1、STAT3、CD80、CCL5 mRNA表达量均明显高于空白对照组(P<0.05);IL-6抑制剂组大鼠背部皮肤组织中IL-6R、JAK1、STAT3、CD80、CCL5mRNA表达量均明显低于银屑病组(P<0.05)。见表3。
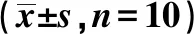
表3 3组大鼠背部皮肤组织中IL-6R/JAK/STAT3通路因子mRNA表达量比较
3 讨 论
银屑病的病理机制尚不完全明确,但就目前研究来看银屑病与病灶内异常浸润的T淋巴细胞及其所产生的炎症因子有关,当T淋巴细胞表面受体与炎症因子结合后会引起受体活化,之后沿着其特定的信号转导通路经过细胞质移动至细胞核中,对目的基因的转录产生启动作用,最终发挥其相应的生物学功能〔6,7〕。活化的信号转导通路在银屑病炎症、免疫应答过程中有着关键的调节作用〔8〕。目前有研究认为MAPK、NF-κB、Notch、IL-6R/JAK/STATs、Wnt等信号转导通路参与银屑病的发生和发展〔8,9〕。而IL-6在银屑病发生后出现高表达,其生物学功能主要是通过与IL-6R相结合后形成异源二聚体,之后再在gp130上结合,形成具有高亲和力的复合物IL-6/IL-6R/gp130,最终作用于IL-6R/JAK/STAT信号转导通路,启动或者加重银屑病〔10〕。
IL-6发挥作用途径是与IL-6R相结合后对JAK/STAT信号转导通路进行激活,对其特定基因的表达产生影响,因此认为IL-6是否会产生其特性的生物学效应与IL-6R表达水平的高低有关〔11〕。IL-6R/JAK/STAT3属于一种由细胞膜转移至细胞核的信号转导通路,当JAK/STAT通路被激活后其通路因子STAT3会对细胞的增殖产生影响〔12〕。STAT3的活化主要是通过STAT3分子酪氨酸残基发生磷酸化后所实现的,当发生磷酸化的STAT3形成二聚体后会进入至细胞核中了,之后通过其信号识别作用与其下游靶基因的启动子进行特异性的结合,最终对相关基因的表达进行调节〔13〕。IL-6R/JAK/STAT3的下游靶基因包括CD80、CCL5。其中CD80属于一种活化T淋巴细胞所必需的共刺激因子,当两者协同作用刺激信号较强时,会对自身反应性的T淋巴细胞产生激活作用,进而引起自身免疫反应、机体损伤等,导致继发性的角质细胞产生过度增生作用〔14〕。有研究表明〔15〕,T淋巴细胞在迁移至银屑病皮损处前已经被激活,而银屑病患者淋巴细胞中CD80为高表达,与患者疾病的发生呈正相关。
CCL5为IL-6R/JAK/STAT3的另一种下游靶基因,属于CC类亚族趋化因子家族中的主要成员,在人体组织中广泛存在,可调节正常活化的T细胞的表达和分泌蛋白;CCL5一方面可对淋巴细胞迁移、归巢产生介导作用,另一方面可引发白细胞的迁移,具有较强的诱导能力,诱导白细胞向炎症部位浸润〔16〕。CCL5不仅对多种细胞产生趋化作用,还可对淋巴细胞产生激活作用,调节细胞生长、分化和参与炎症反应〔17〕。在银屑病发生后角质形成细胞来源的CCL5高于正常皮肤,CCL5表达增强,其原因可能与银屑病病灶皮损处聚集大量的活化T细胞有关〔18〕。本研究结果提示,IL-6抑制剂可能是通过作用于IL-6R/JAK/STAT3信号通路,调控其通路因子,进而影响银屑病病灶内异常浸润的T淋巴细胞及其所产生的炎症因子,最终起到改善皮损病症的目的,但目前临床上对于IL-6抑制剂与银屑病之间的作用关系并无研究,因此本研究结果还需后续研究实验进一步证实。
而IL-6R/JAK/STAT3信号通路的激活可诱导T-bet的表达、促进Th1细胞因子的释放,但同时会抑制Th17细胞因子的分泌,研究认为IL-6R/JAK/STAT3信号通路的激活与Th1、Th17细胞共同参与银屑病的发生〔19〕。而目前研究认为〔20〕,由Th17细胞所分泌的IL-17、IL-22、IL-23因子水平会诱导角质增生和病灶处炎症反应。本文结果说明,IL-6抑制剂可能是通过作用于IL-6R/JAK/STAT3信号通路,抑制Th17细胞炎症因子的分泌,最终抑制角质增生和病灶处炎症反应。
综上,IL-6抑制剂可有效抑制银屑病大鼠背部皮肤组织角质增殖、炎症反应,其作用机制可能与调控IL-6R/JAK/STAT3通路转导因子有关。

