水稻根系盐胁迫响应miRNA 和tRF 的鉴定
孟淑君,张雪海,王琪月,张稳,黄力,丁冬,汤继华
(河南农业大学农学院/省部共建小麦玉米作物学国家重点实验室,郑州 450002)
0 引言
【研究意义】水稻(Oryza sativaL.)是中国最重要的粮食作物,随着全球气候变暖及生态环境恶化,水稻生长过程中遭受的干旱、高盐等非生物胁迫日益增加。盐胁迫作为主要的非生物胁迫之一,严重影响水稻的生长发育。植物盐胁迫一般表现为渗透胁迫和离子毒害2 个阶段,引起植株体内活性氧破坏、膜系统损伤、光合和呼吸作用受抑制、酶活性降低等;表现为植株矮小,叶片黄化,最终导致粮食产量、品质的下降[1]。在高盐环境下,水稻会产生2 种生理反应:快速的渗透反应,能抑制新梢/根的生长;较慢的离子反应,加速成熟叶片的衰老或加快细胞程序性死亡[2]。【前人研究进展】MicroRNAs(miRNAs)是一类普遍存在于生物体内,5'端带有磷酸基团,3'端带有羟基,长度为20—24 nt 的内源性非编码小分子RNA[3],在转录后水平调控其靶基因的表达。miRNA 通过剪切靶基因转录本或抑制靶基因翻译行使其生物学功能[4-5]。在植物中,miRNA 通过对靶基因的调控,参与植物的生长发育、器官形态建成、生物及非生物胁迫响应等多种生物学进程[6-7]。GAO 等[8]发现miR393 的表达水平在盐碱胁迫下明显上调,而过表达miR393 的转基因水稻对盐碱处理比野生型更敏感,表明miR393 是水稻盐碱胁迫的负调控miRNA。YANG 等[9]研究表明,过表达miR171c 可降低水稻的盐胁迫耐受能力,说明miR171c 是水稻耐盐胁迫的负调控因子。此外,miRNA156 是调控水稻干旱和盐胁迫的重要因子[10],水稻miR393可以和miR390 在不同胁迫条件下协同调控水稻侧根生长[11]。tRF 是一种最近被发现的、在动植物中广泛存在的小分子量非编码RNA,其结构、分布及其生物学功能正日益受到研究者关注。tRF 序列全长20—40 nt,由前体tRNA 或成熟tRNA 经核苷酸酶加工和修饰而成[12]。tRF 最先在人类细胞中被鉴定获得[13]。根据来源不同,tRF 可被分为3'端tRF[14]、不包含5'端和3'端结构的tRF[15]、含有CCA 结构的tRF[16]、5'端tRF[17]、tRNA 半分子tiR(tRNA-derived stress-induced RNAs)[18]等5 种类型。功能研究表明,tRF 具有类似于miRNA 的调控功能,是一种潜在的转录后基因表达调控因子。tRF 在调控mRNA 翻译、细胞增殖、应激条件下细胞应答和人类疾病方面均具有重要作用[19]。除了在四膜虫中[20],tRF 的表达与它们各自的前体tRNA 的丰度无关[21,17]。迄今为止,tRF在植物中的功能研究相对较少。CHEN 等[22]在水稻胚愈伤组织中鉴定到大量tRF,其中表达量最高的tRF来自于Ala-AGC tRNA 的5'端,且未分化愈伤中的tRF含量显著高于已分化愈伤。【本研究切入点】根系是水稻直接接收盐胁迫信号的部位。除功能基因外,调控性核酸分子在植物逆境响应过程中也发挥着不可替代的作用。miRNA 是植物胁迫响应的上游调控因子,通过调节靶基因的表达响应胁迫信号。而作为新近发现的小分子量调控RNA,tRF 在植物胁迫响应方面的鉴定及功能研究鲜见报道。【拟解决的关键问题】本研究以水稻粳稻品种日本晴为试验材料,对盐胁迫处理的水稻根系材料进行了小分子量RNA 测序,并利用qRT-PCR 方法对测序结果进行了验证。鉴定和筛选到水稻盐胁迫响应miRNA、tRF 及其靶基因;分析盐胁迫处理/非盐处理水稻根系miRNA、tRF 差异表达情况,并建立了水稻非编码小分子量RNA 参与的盐胁迫响应基因表达调控网络。
1 材料与方法
1.1 试验材料
挑选饱满且均匀一致的水稻粳稻品种日本晴种子60 粒,剥去种子的颖壳,在超净工作台内经75%酒精浸泡清洗5 min,用0.1%升汞处理20 min,灭菌去离子水清洗4—5 次,并用滤纸吸取多余的水分。将灭菌处理过的种子分别铺于1/2MS 和含150 mmol·L-1NaCl的1/2MS 培养基上,每个直径90 mm 的培养皿中铺放30 粒种子。用灭菌的镊子夹取种子,将水稻种子按照从左到右的顺序均匀排列。封口膜封口后的培养皿放置于28℃恒温培养箱中进行暗培养,待种子露白后于光照培养箱中培养(每日光照28℃ 14 h/黑暗25℃ 10 h)。处理21 d 后,取盐胁迫处理/非盐处理水稻植株根部样品液氮中速冻后置于-80℃保存备用。每份材料取3 个生物学重复,分别用于提取根系组织总RNA进行小分子量RNA 测序,每个生物学重复由3 个植株的根系样品等量混合组成。
1.2 水稻根系RNA 提取
使用冷冻的TriZol(Invitrogen,Carlsbad,CA,USA)根据RNeasy minikit(Qiagen, Hilden, Germany)说明书提取水稻根系总RNA,利用NanoDrop2000 分光光度计检测RNA 浓度,并利用Agilent2100 检测RNA 样品的质量及完整性。
1.3 Small RNA 建库测序
使用15%PAGE 胶分离不同片段大小的RNA,取14—40 nt 条带回收小分子量RNA;使用RNA 连接酶将回收的小分子量RNA 加上3'和5'接头,每次连接后进行切胶回收。将最终回收到的小分子量RNA 反转录成cDNA,PCR 扩增16 个循环;用PAGE 胶对PCR 产物切胶回收,完成文库构建,质检后用于高通量测序。利用illumina Nextseq500 仪器,75SE 测序模式对样品进行小分子量RNA 测序。
1.4 Small RNA 数据分析方法
首先对测序得到的原始数据进行过滤,去除有5'接头污染的、长度小于18 nt、polyA 和低质量(Q<=5)的reads,得到clean reads 用于数据分析。
1.4.1 miRNA 数据分析 利用bowtie 软件[23]将数据与miRBase 数据库(水稻)(http://www.miRBase.org/, Version 21;包括172 个成熟的miRNA)进行比对。当测序片段与数据库中已知的miRNA 序列错配数小于2 时认为该测序片段为已知的miRNA。为了判断样品之间miRNA 的表达量差异,用featurecounts 软件[24]统计样本reads 数。用DESeq2 进行差异基因分析[23]。将每个样品的所有miRNA 进行归一化处理,处理后如果miRNA 在2 个材料内的表达量都小于1RPM,则不予考虑[25]。两材料之间表达量差异大于2 倍(log2FC>1 或<-1),则认为是差异表达的小分子量RNA。
1.4.2 tRF 数据分析 从Ensembl 数据库(http://grch37. ensembl.org/index.html)下载水稻参考基因组数据的注释信息,从中筛选出tRNA 的注释信息,将tRNA 序列从反密码子处分开,区分为tRNA 的5'和3'端,构建tRF 序列比对文件。根据构建的5'和3'的注释信息,使用featurecounts软件统计与tRNA5’及3’序列匹配的reads 数目,并计算每种长度的tRF 所占的比例。
1.5 miRNA 和tRF 及其靶基因表达量分析
分别以日本晴盐处理/非盐处理根系总RNA 为模板,利用Mir-XTMmiRNA First-Strand Synthesis 试剂盒(TaKaRa)加A 法进行反转录合成cDNA 第一链。利用TB GreenTMPremix Ex TaqTMⅡ(TaKaRa)荧光定量试剂盒在 CFX96 Real-Time PCR Detection System 实时定量PCR 仪上对转录组数据表达差异的3个miRNA 基因(miR156、miR167 和miR396)进行定量分析。miRNA 的定量引物使用其成熟序列(U 用T 取代)作为qRT-PCR 的正链引物(F)(表1),试剂盒中的mRQ3'作为负链引物(R)。内参为U6,qRT-PCR 引物列于表1 中,每个反应设有3 个生物学重复和3 次技术重复。采用2–ΔΔCt方法[26]计算基因的相对表达量,并利用T 测验分析基因的表达差异。
选取测序结果中差异表达的来源于 tRNA EPlORYSAT000373840 和EPlORYSAT000373812 的2个tRF,截取特异序列作为正链引物(F)(表1), 进行qRT-PCR 分析,方法同miRNA 定量。
靶基因定量分析利用TaKaRa PrimerScriptTMRT reagent Kit with gDNA Eraser 试剂盒(TaKaRa)对总RNA 进行反转录。利用Primer3(http://primer3.ut.ee/)在靶基因外显子区设计特异定量引物(表1),qRT-PCR 方法同上,内参基因为Osβ-Actin。

表1 水稻盐胁迫相关基因qRT-PCR 引物序列Table 1 qRT-PCR primer sequences of salt stress related genes in rice
1.6 保守性miRNA 及tRF 靶基因分析
利用psRNATarget 网站(https://plantgrn.noble. org/psRNATarget/analysis)预测保守Small RNA 靶基因及其功能,在Gramene 网站(http://www.gramene. org/)使用BLAST 功能分析tRF 靶基因并进行功能注释。
2 结果
2.1 水稻盐胁迫响应表型
在1/2MS 培养基中对水稻进行盐胁迫处理21 d, 150 mmol·L-1NaCl 处理与非盐处理相比,水稻日本晴幼苗明显受到盐胁迫的抑制(图1)。

图1 NaCl 处理21 d 的水稻苗期表型Fig. 1 Phenotypes of rice seedlings at 21 days under NaCl
2.2 RNA-seq 测序数据保守miRNA 的鉴定
2.2.1 水稻小分子量RNA 测序 对日本晴盐处理和非盐处理21 d 根系的小分子量RNA 文库进行高通量测序,以鉴定影响水稻盐胁迫响应的miRNA 和tRF。为消除不同个体间的差异,每个样品设置3 个生物学重复用于RNA 提取及后续测序分析。盐处理和非盐处理21 d 的水稻根系每个样品设置3 个生物学重复,共6 个样品,共得到150 501 099 条测序数据。平均每个样品有25 083 517 个读数,范围从15 848 571到54 767 011。测序所得的小分子量RNA 几乎涵盖所有RNA 类型,包括tRNA、rRNA、snRNA、snoRNA、siRNA、miRNA、外显子和内含子降解片段等。片段大小在18—75 bp,根据小分子量RNA 的长度获得分类柱状图(图2)。在盐处理水稻根系中24 nt 的小分子量RNA 的量最多,占其测序数据的18.40%,非盐处理水稻根系中24 nt 的小分子量RNA 的量占其测序数据的16.27%。盐处理水稻根系中34—38 nt 的小分子量RNA 的量明显多于非盐处理水稻根系。
2.2.2 水稻盐胁迫响应miRNA 的鉴定 将测序数据与水稻miRNA 数据库miRBase(http://www.mirbase. org)中的成熟序列及前体序列进行比对,鉴定出保守的miRNA。以至少有一个样品RPM>1 为筛选条件, 共比对到451 个miRNA。为了寻找表达量较高的miRNA,以至少有一个样品RPM>50 为筛选条件,共比对到149 个miRNA(电子附表1)。
2.2.3 保守miRNA 差异表达分析 为了寻找水稻盐胁迫响应相关的差异miRNA,对检测到的149 个保守miRNA 进行均一化后的差异分析,以至少一组数据RPM>500 为筛选条件,共得到54 个miRNA,分属于25 个miRNA 家族。对在盐胁迫处理和非盐处理条件下水稻日本晴根系的miRNA 的表达量进行分析,以log2FC>1 或<-1 为筛选条件,共得到8 个表达量显著上调的miRNA和23个表达量显著下调的miRNA(表2),属于12 个miRNA 家族。
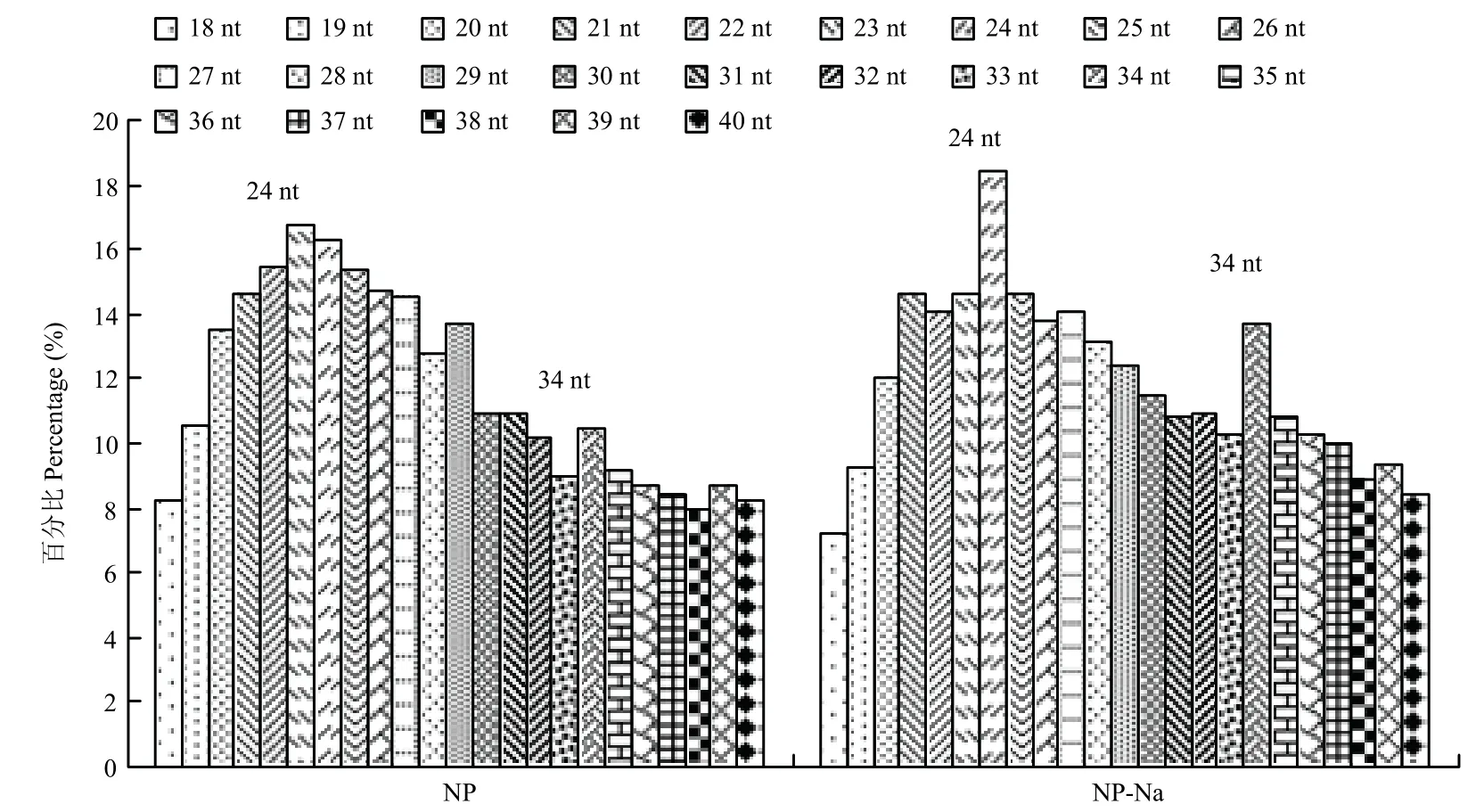
图2 小分子量RNA 的长度分类柱状图Fig. 2 Histogram of the length of small molecular RNA

图3 检测到的每个miRNA 家族成员数Fig. 3 The number of detected family members per miRNA family
水稻盐胁迫相关的miRNA 的差异还反映在每个家族成员的数目上(图3)。测序结果检测到数目最多的miRNA 家族是osa-miR156,由10 个成员组成;随后是osa-miR167、osa-miR397、osa-miR396和osa-miR159,分别有7、2、2 和3 个成员。其他的miRNA 家族,如osa-miR1882、osa-miR1432、osa-miR168、 osa-miR1432、osa-miR1876、osa-miR164 和osa-miR5077等,只检测到一个盐胁迫响应成员。说明不同miRNA家族成员对盐胁迫信号响应情况存在差异。
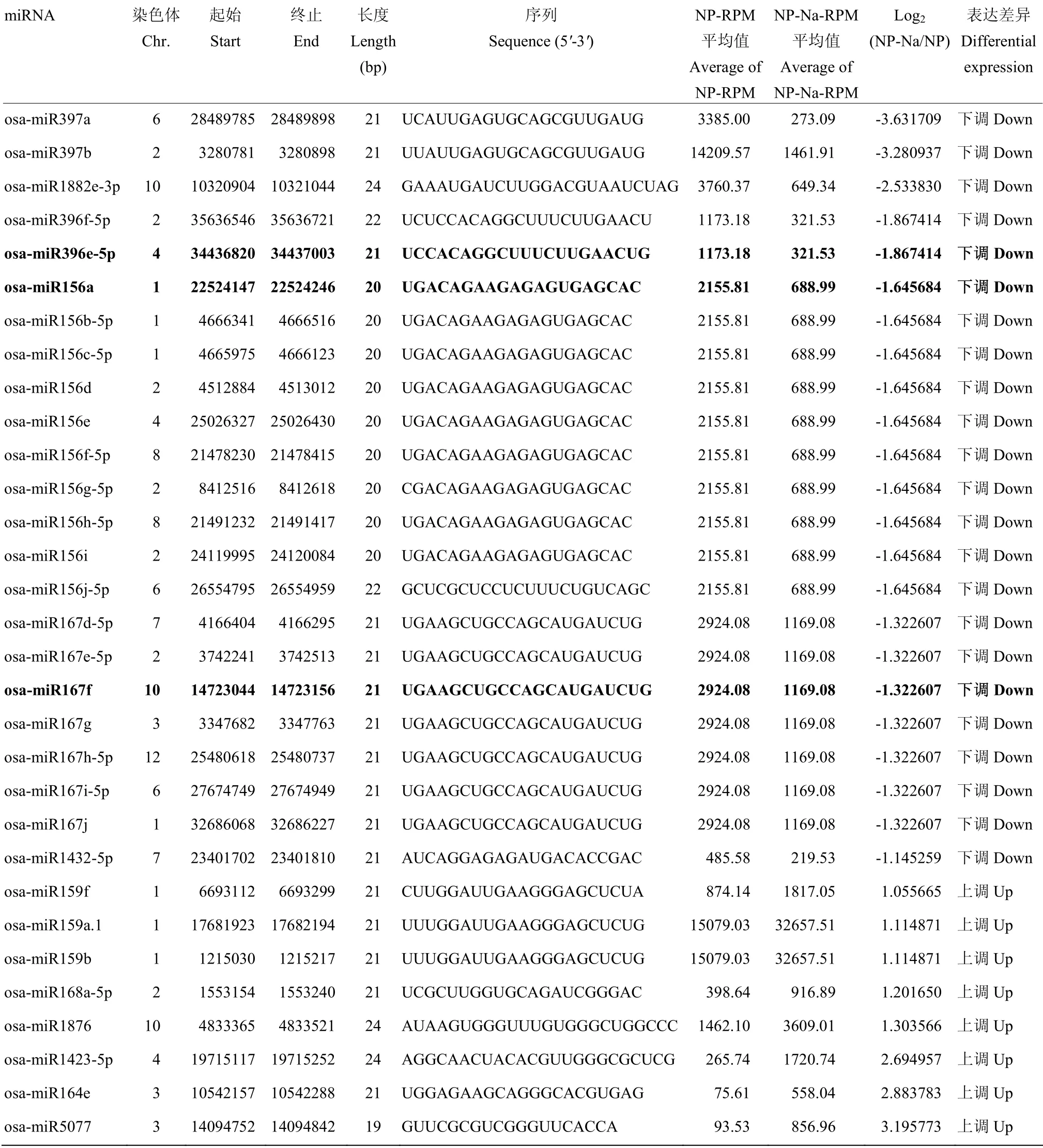
表 2 水稻盐胁迫响应差异表达miRNATable 2 Differentially expressed miRNAs in response to salt stress in rice
2.2.4 差异miRNA 靶基因预测 大多数植物内保守 的miRNA 与其靶基因具有高度的匹配,一个miRNA可以靶定多个靶基因。利用miRNA 预测软件psRNA Target program(http://plantgrn.noble.org/psRNATarget/)对在水稻盐胁迫响应的31 个差异表达的miRNA(12个miRNA 家族)的靶基因进行了预测,共得到162个靶基因(电子附表2)。
2.2.5 差异miRNA 及其靶基因的qRT-PCR 表达分析 选择在本研究中被检测到的家族成员较多,且在其他物种中已有其与盐胁迫相关报道的3 个差异表达的miRNA,包括miR156、miR167 和miR396,利用qRT-PCR 对其成熟序列进行检测验证,结果表明,高通量测序与qRT-PCR 虽然存在相对倍数的差异,但所有检测miRNA 的相对表达差异与测序数据相一致(表2 和图4)。这种表达量差异倍数差异也许是由于2 种技术的操作原理与精度不同导致的。利用qRT-PCR 对选择的miRNA 对应的靶基因进行表达量分析。在盐胁迫条件下,miR156 的靶基因OsSPL11(Os06g45310)和OsSPL13(Os07g32170)的相对表达量都较对照有显著降低;miR167 的靶基因Os06g03830相对表达量显著上调,而OsARF6(Os02g0164900)的相对表达量较对照极显著下调;miR396 的靶基因OsGRF2(Os06g10310)的相对表达量和对照相比极显著上调(图4)。

图4 水稻盐胁迫相关miRNA 及其靶基因的qRT-PCR 表达分析Fig. 4 qRT-PCR expression analysis of salt stress miRNAs and target genes in rice
2.2.6 水稻盐胁迫响应tRF 的鉴定及靶基因预测通过与tRNA 数据库进行比较,以至少有一个样品RPM>1 为筛选条件[25],与tRNA 5'端序列共比对到145 个tRF。与非盐处理的日本晴相比,在盐胁迫条件下的日本晴有77 个差异表达的tRF,其中有75 个上调表达的tRF,2 个下调表达的tRF(电子附表3),以至少一组数据RPM>50 数据为筛选条件,共比对到6 个tRF,其中有3 个tRF 的表达量是上升的,其余3 个tRF 无差异(表3)。以至少有一个样品RPM >1 为筛选条件,3'端共比对到78 个tRF,与非盐处理的日本晴根系相比,在盐胁迫条件下的日本晴根系有58 个上调表达的tRF,其余的tRF 无表达差异(电子附表3),以至少一组数据RPM>50 数据为筛选条件,共比对到4 个tRF,其中3 个tRF 的表达量上调(表3)。与非盐处理的日本晴根系相比,在盐胁迫条件下的日本晴根系在 3'和 5'端比对到tRF 共有的来源tRNA 有2 个,分别为tRNA-Glu的EPlORYSAT000373797以及 tRNA-Asp 的EPlORYSAT000373840。由此可见,大多数tRF 受盐胁迫诱导表达,推测这些差异tRF 可能是水稻盐胁迫响应通路中的重要调节因子。

表3 水稻盐胁迫相关tRF 的来源tRNATable 3 Source tRNA of tRFs related to salt stress in rice
利用Gramene 网站(http://gramene.org/)的BLAST功能对盐胁迫诱导的6 个tRF 进行靶基因预测,共得 到29 个靶基因(表4)。
2.2.7 盐胁迫诱导差异表达 tRF 及其靶基因的qRT-PCR 表达分析 对水稻盐胁迫诱导差异表达的2 个tRF(EPlORYSAT000373812和EPlORYSAT000373840)进行qRT-PCR 验证,结果表明,检测tRF 的相对表达差异与测序数据相一致(图5),与非盐处理相 比,盐处理水稻根系中2 个tRF 的相对表达量均显著升高。利用qRT-PCR 对EPlORYSAT000373812 和EPlORYSAT000373840 靶基因 Os01g0810100、Os04g0531300 的表达量进行分析发现(图5),与非盐处理相比,盐处理水稻根系中靶基因的相对表达量均显著降低。

表4 水稻盐胁迫差异表达tRF 预测靶基因Table 4 Predictive target genes for differential expression of tRFs in rice salt stress

图5 水稻盐胁迫相关tRF 及其靶基因的qRT-PCR 表达分析Fig. 5 qRT-PCR expression analysis of salt stress tRFs and target genes in rice
3 讨论
3.1 使用RNA-seq 方法,可高通量获得水稻盐胁迫响应small RNA
已有研究表明,植物遭受非生物胁迫会诱导相应 miRNA 的表达变化,通过对其靶基因的转录后表达调控影响植株形态、生理和代谢以对逆境做出响应。RNA-Seq 技术已经成为目前研究胁迫相关的miRNA功能及调控路径的主要方法[27-29]。
水稻是盐敏感作物,高盐环境能够影响水稻正常的代谢活动,引起细胞壁的破坏、膜系统破坏、细胞质溶解,产生渗透胁迫甚至离子毒害,并影响基因组的稳定性,最终引起细胞凋亡或植株死亡,严重影响水稻的产量和品质。miRNA 在水稻盐胁迫响应通路中发挥重要的调控作用。本研究通过RNA-Seq 手段共检测到水稻根系盐胁迫差异表达的miRNA 54 个,分属于25 个miRNA 家族,其中8 个miRNA 表达量上调,23 个miRNA 表达量下调。利用实时荧光定量PCR 方法对测序结果进行了验证,miRNA 定量结果与测序结果基本一致,说明RNA-Seq能够高通量、准确可靠地鉴定盐胁迫下水稻根系miRNA 的表达情况。
由于miRNA 的碱基序列较短,靶定的靶基因较多,且参与许多较复杂的生物学过程并起很重要的调控作用,因而预测miRNA 的靶基因是研究miRNA 作用机制的基础,研究miRNA 的功能及作用机制就要研究靶基因与其miRNA 的相互作用方式。本研究运用psRNATarget 网站分析鉴定了RNA-Seq 中筛选得到的盐胁迫相关差异表达的miRNA 靶基因162 个。这些miRNA 通过对其靶基因的转录后表达调控影响水稻盐胁迫响应的生理生化过程。
3.2 miRNA 在不同植物生长发育和胁迫响应中功能的通用性
在本研究检测到的差异表达基因中,有8 个miRNA 家族在其他物种中也被报道为盐胁迫响应miRNAs,如表达量下调的osa-miR397、osa-miR396、osa-miR156、osa-miR167、osa-miR1432 和表达量上调的osa-miR159、osa-miR168、osa-miR164。研究表明,红花miR397a表达可增强植物对NaCl 的敏感性[30];番茄的miR397过表达植株中,LeLACmiR397表达量降低,从而使番茄出现盐敏感表型[31]。烟草中Sp-miR396a-5p 通过作用于NtGRF1和NtGRF3的调控网络,靶向NtGRF7调控渗透应激反应基因的表达和病原菌感染,在非生物胁迫中发挥重要作用[32]。紫花苜蓿在重度盐胁迫下,miR156 下调了SPL 转录因子家族基因,修饰了重要转录因子的表达,并下调下游盐胁迫应答基因,说明miR156 在紫花苜蓿对盐胁迫的生理反应和转录过程中起着调节作用[33]。在番茄中盐、干旱和热处理导致了miR167 表达量下调,表明不同胁迫激活了miR167a调控替代机制[34];拟南芥中miR167 与其靶基因ARF6和ARF8之间存在反馈调节作用,ARF6激活miR167表达,ARF8抑制miR167 表达,它们之间的彼此激活或抑制作用调控不定根的形成[35]。毛竹经强光、黑暗、高温、低温、NaCl 等胁迫处理后,叶片中phe-miR1432的表达下调[36]。YIN 等[37]利用棉花耐盐品种和盐敏感品种研究miRNA 的表达差异,发现在盐胁迫条件下,盐敏感品种中的miR159 表达下调;而在耐盐品种中miR156a/d/e、miR169 显著下调,miR167a、miR397a/b上调。miR168 介导的反馈调控环调节ARGONAUTE1(AGO1)的稳态对基因表达调控和植物发育至关重要,过表达miR168a 的植株和AGO1功能缺失突变体均表现出ABA 超敏性和耐旱性,而mir168a突变体表现出ABA 低敏性和干旱超敏性[38];高盐条件下拟南芥中miR168 的表达量在初期上升,但6 h 后恢复正常水平[39]。李贺春等[40]利用miRNA 基因芯片杂交技术对盐胁迫条件下耐盐棉花品系和盐敏感棉花品种的miRNA 进行差异表达发现,在盐胁迫条件下miR156、miR164、miR167、miR397 和miR399 在耐盐棉花品系较盐敏感品系表达上调。以上分析表明,部分水稻中的盐胁迫响应miRNA 在其他植物的盐胁迫信号通路中依然适用,说明了这些miRNA 在调节不同植物生长发育和胁迫响应中功能的通用性及进化的整体性。
在miRNA 与下游靶基因的对应关系中,某一miRNA 可能有不止一个靶基因,这些靶基因可能含有类似结构域,也可能隶属不同家族的蛋白,涉及植株不同的发育进程和调控路径。如本研究中的miR156 参与了水稻盐胁迫响应过程,其靶基因有OsSPL11和OsSPL12,说明miRNA 与其靶基因共同参与的植物逆境应答是一个极其复杂多变的动态调控网络。
3.3 tRF 在水稻盐胁迫条件下差异表达
tRF 作为新近发现的含量丰富的非编码小分子调控性RNA,日益受到研究者的关注。尽管tRF 已被证明在生物细胞中普遍存在,其产生机制、结构、分布、生物学功能和作用机制等方面的研究仍处于起步阶段。已有研究表明,tRF 可调控基因的转录和翻译[41-43]、应激条件下的细胞应答[44-46]、恶性肿瘤[47-48]等人类疾病,但目前植物中tRF 的研究鲜有报道。本研究通过RNA-Seq 技术手段,在全基因组层面挖掘了水稻盐胁迫响应tRF。盐胁迫处理后,水稻根系产生的34—38nt tRF 显著多于未处理材料,说明tRF 的产生并非是随机的,而是通过某种特定机制或特定信号诱发tRNA 的加工[41,17]。与对照组相比,共检测到盐胁迫响应的6 个表达量很高且由盐胁迫诱导的tRF,而未检测到表达量下调的tRF。推测这些差异tRF 是潜在的水稻盐胁迫响应tRF。利用实时荧光定量PCR手段证实了它们的存在和验证了测序结果的可靠性。进一步证明tRF 可能受到盐胁迫诱导,tRNA 加工增强,导致tRF 表达量上升。
靶基因分析发现,这些tRF 的靶基因为叶绿体核糖核酸酶Ⅲ域蛋白、F-box 和DUF 结构域蛋白质、LMBR1 膜内蛋白、内吞体分选转运复合体及玉米素葡萄糖基转移酶等,表明其参与了水稻不同的调控路径,也说明了tRF 在水稻盐胁迫调控网络中的功能重要性。而不同结构的tRF 与其靶基因之间的对应关系,tRF 表达量与其靶基因表达量之间的对应关系有待进一步的研究。
根据以上的研究结果,构建了依赖miRNA 和tRF的水稻盐胁迫响应调控网络(图6)。
4 结论
水稻中大多数tRF 受盐胁迫诱导表达;共检测到12 种水稻根系中盐胁迫响应miRNA,其靶基因多为转录因子编码基因,推测其通过对其靶基因转录因子的转录后调控参与了盐胁迫响应的表达调控。其中8个水稻盐胁迫响应miRNA 家族是不同物种间保守的通用盐胁迫响应miRNA。另外,从转录组水平挖掘出水稻盐胁迫响应tRF,并鉴定了6 个盐胁迫诱导表达的tRF。
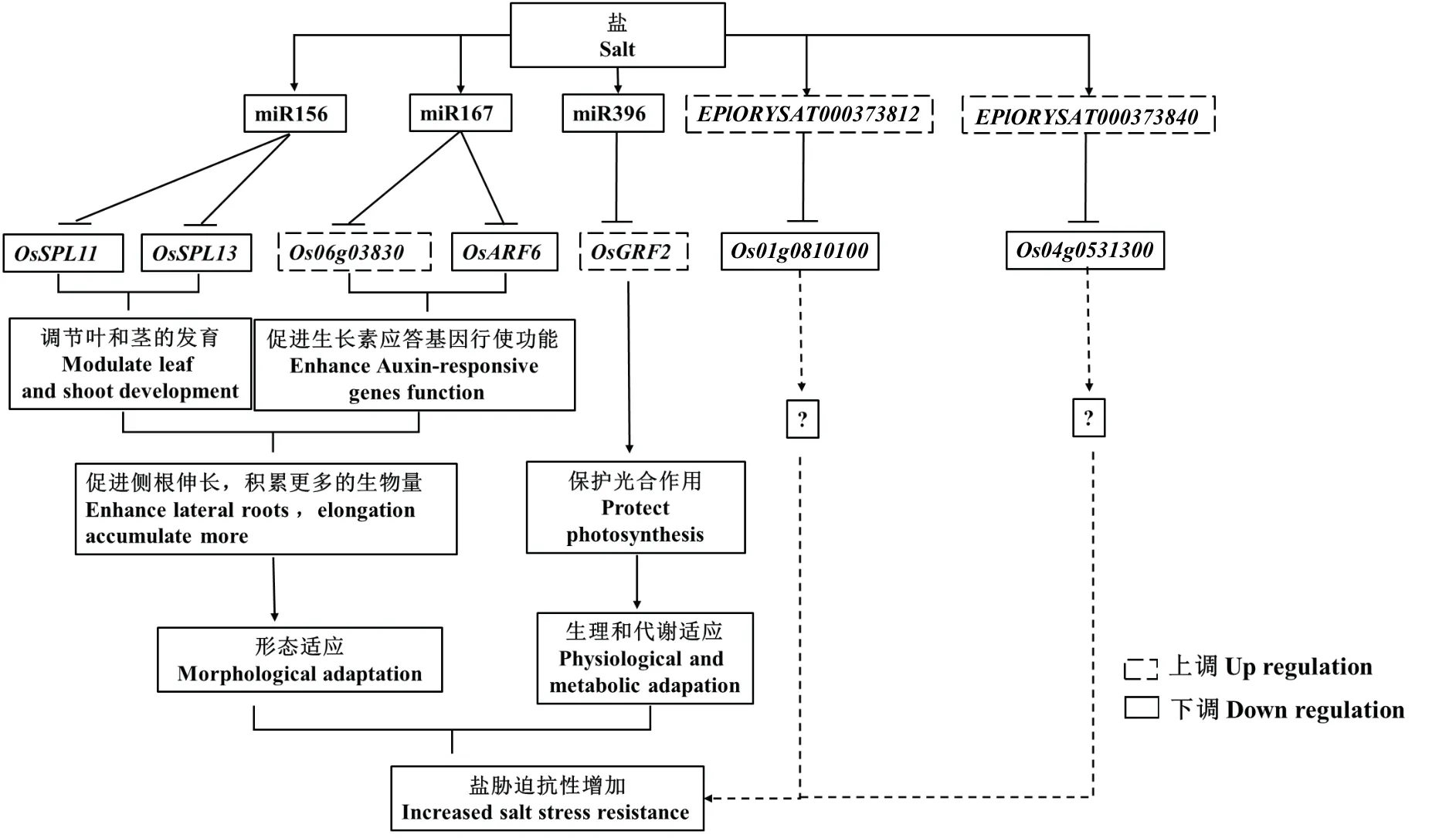
图6 水稻根系中可能的盐胁迫响应miRNA 及tRF 调控网络Fig. 6 The potential regulating network of salt-responsive miRNAs and tRFs in rice roots

