高危型HPV感染不孕症女性患者外周血淋巴细胞亚群水平
李燕华, 周少雄, 薛家权
佛山市禅城区中心医院检验科(广东佛山 528031)
高危型人乳头瘤病毒(HPV)持续感染是宫颈癌及癌前病变发病的病因[1]。大部分子宫颈HPV感染可通过体液和细胞免疫应答而清除,仅有一部分患者HPV感染呈现持续性状态,并最终从宫颈上皮内瘤变进展为宫颈癌。HPV感染细胞的清除,主要与淋巴细胞亚群的数量和功能相关[2-3]。近年来,HPV引起的感染, 尤其是在年轻妇女中生殖道感染的发病率呈上升趋势。一些研究提示高危型HPV感染及可能导致的免疫功能异常是女性不孕症的危险因素之一,但研究深度不够,结果具有争议,本研究通过检测高危型HPV感染的不孕症女性患者外周血中淋巴细胞亚群数量和宫颈口解脲脲原体(UU)感染情况,探讨其与女性不孕的相关性,报告如下。
1 资料与方法
1.1 一般资料 选取我院2016年1月至2018年12月就诊的70例高危型HPV感染(其中24例合并UU感染)的不孕症女性患者为观察组进行回顾性分析,年龄22~45岁,平均(31.23±6.08)岁。入组标准:(1)均为已婚女性, 未避孕、有正常性生活、同居1年而未受孕者;(2)非经期,无其他肿瘤及免疫性疾病等病史;(3)液基薄层细胞制片检查(TCT)结果为轻度宫颈炎;(4)17种高危型人HPV(16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、82亚型)核酸检测结果为阳性;另选取同期的70例HPV阴性的不孕症女性患者为对照组,年龄22~44岁,平均(31.69±4.99)岁。
1.2 方法
1.2.1 样本采集 (1)宫颈细胞标本采集:取材前3 d内无妇科检査、无性生活、无阴道冲洗及阴道内用药;采用专用宫颈脱落细胞提取缓冲液管作为采样容器。以窥阴器或阴道张开器暴露宫颈,用棉拭子将宫颈口过多的分泌物轻轻擦拭干净。取出宫颈刷置于宫颈口,顺时针转动 4~5周,以取得足量的上皮细胞样本,然后将宫颈刷头部放入提取缓冲管中,沿刷柄折痕处将宫颈刷柄折断,拧紧管盖,做好样本标识,并保持提取缓冲液管直立放置。(2)生殖道分泌物标本采集:采集宫颈细胞标本的同时,采用无菌生殖泌尿道分泌物专用棉拭子于宫颈口处转动数秒后取出,将棉拭子置于专用容器内密闭送检。(3)淋巴细胞亚群检测标本采集:静脉采血2 mL,置紫色盖EDTA-K2抗凝管,颠倒混匀3次,送检。
1.2.2 试剂和仪器 (1)上海宏石医疗科技有限公司SLAN-96P荧光定量PCR仪及亚能生物技术(深圳)有限公司的17种高危型HPV核酸检测试剂盒(PCR-荧光探针法)。(2)众爱生河北生物科技有限公司的解脲支原体和人型支原体选择分离培养、检定、药敏试剂盒。(3)美国BD公司生产的BD FACSCantoII 6色流式细胞仪和BD Multitest 6-Color TBNK Reagent。
1.2.3 方法 (1)宫颈细胞标本离心加样,严格按操作规程实验操作,运行HPV检测操作程序,根据HPV检测判别软件,判读检测结果。(2)严格按照生殖道支原体培养及药敏操作程序进行实验操作,将采集标本拭子头插入培养基液体中,充分洗涤,在瓶壁上挤干拭子,各取100 μL已接种后的培养基液体样本,滴加在除(-)孔以外的各孔中, 每孔滴加1~2滴石蜡油,盖上盖; 将剩下的培养基和药敏板在(35±1)℃培养箱中培养,24和48 h观察结果。当(+)孔为阳性,UU鉴定孔为阳性(培养24 h,培养基由黄变红、清亮无混浊),表示UU计数(ccf≥104)有临床意义。(3)按照TBNK淋巴细胞亚群相对计数操作规程进行实验操作,鉴定标本合格后,编管;然后加标准抗体到试管中,同时加入标准量的抗凝全血至管底,振荡混匀,避光放置15~20 min;加入溶血素,溶解红细胞;避光室温至完全溶血,24 h内上机检测。用美国BD 公司生产的FACS CantoII 6色流式细胞仪测定,使用FACSCanto Clinical 软件获取分析细胞。
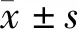
2 结果
2.1 高危型HPV感染不孕症患者与对照组外周血淋巴细胞亚群检测结果 与对照组相比,观察组外周血NK细胞比例显著降低(P<0.05), CD3+细胞比例显著增高(P<0.05),B细胞、CD4+细胞、CD8+细胞和CD4+/CD8+比值差异无统计学意义(P>0.05)。见表1。
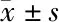
表1 不同组别外周血淋巴细胞亚群检测结果
注:*与对照组比较P<0.05
对检测结果进一步分析表明,成年女性CD4+/CD8+比值正常参考范围为1.0~2.0,将比值≤1.1或≥1.9定义为异常,则观察组中41.43%的患者CD4+/CD8+比值异常,其中30%比值≤1.1,11.43%比值≥1.9,2检验表明,与对照组差异有统计学意义 (P<0.01),见表2。

表2 观察组外周血CD4+/CD8+比值分布情况 例(%)
2.2 单一感染组与合并UU感染组外周血淋巴细胞亚群检测结果分析 在观察组中UU合并感染率为34.29%,单一感染组外周血NK细胞、B细胞、CD3+、CD4+细胞、CD8+细胞比例以及CD4+/CD8+与合并UU感染组相比差异均无统计学意义(P>0.05),见表3。
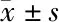
表3 单一HPV感染组与合并UU感染组外周血淋巴细胞亚群检测结果
合并UU感染组CD4+/CD8+比值异常率略高于单一感染组, 但差异无统计学意义(P>0.05),见表4。

表4 单一HPV感染组与合并UU感染组外周血CD4+/CD8+比值分布情况 例(%)
3 讨论
3.1 高危HPV感染与机体细胞免疫防御 HPV在年轻女性中的感染非常普遍,在HPV与宿主免疫系统的对抗中,主要是由病毒自身的或诱导的免疫逃逸机制和人体的免疫应答机制之间的平衡来决定病变的转归[4-5]。细胞免疫是抗病毒免疫的主要方式,而淋巴细胞是细胞免疫系统的主要细胞,包括NK细胞、B细胞和T细胞。NK细胞是天然免疫系统的重要组成部分, HPV可能干扰先天免疫细胞迁移和黏附以及细胞表型的定义[6],HPV 感染患者NK细胞数量下降。B淋巴细胞主要介导体液免疫, 而体液免疫在抗病毒免疫中起协同作用,观察组中B细胞数量与正常对照组相比差异并无统计学意义。T细胞是参与机体细胞免疫反应并起主导调节的一组免疫细胞,随着NK细胞比例下降,观察组患者外周血中CD3+细胞的比例升高。适应性反应的病毒特异度T细胞由辅助性T细胞CD4+和细胞毒性T细胞CD8+两个群体组成,CD4+/CD8+的恒定比例,维持着机体细胞免疫反应的平衡。在本研究中观察组CD4+、CD8+细胞比例以及CD4+/CD8+比值与对照组相比差异并无统计学意义,但在观察组中41.43%的患者出现CD4+/CD8+比值异常(表1、2)。可见,在高危型HPV感染的不孕妇女中部分患者的免疫平衡遭到破坏,出现免疫紊乱的情况。
3.2 高危HPV感染与UU感染 支原体是泌尿系感染的常见致病微生物,支原体的感染很可能会引起不孕不育,其中以UU尤为突出[7-9]。在本研究中,观察组中UU合并感染率为34.29%,并未发现单一高危HPV感染组与合并UU感染组间T淋巴细胞分类的差异性,也并未发现两组间CD4+/CD8+比值差异有统计学意义;虽然在本研究的例数范围内,未发现合并UU感染能协同增强高危型HPV感染女性不孕症患者存在的免疫功能紊乱,但从分析结果上,合并UU感染组CD4+/CD8+比值异常的比率略高于单一高危HPV感染组(表3、4)。CD4+/CD8+比值常用于评价机体的免疫功能,当CD4+/CD8+比值异常时,机体自身免疫能力下降,对外源性病原体的抵抗力降低,更容易发生HPV和生殖道感染。
3.3 高危型HPV感染与女性不孕症 女性不孕症发病机制比较复杂,免疫因素和生殖道感染是两大重要影响因素。性传播感染(STI)可以针对女性生殖道沿线的不同组织导致其功能改变,从而导致生育能力下降甚至不孕[10]。HPV是最常见的性传播感染病毒之一,对于HPV感染能否改变生殖功能尚具有争议[11-14]。本观察组中虽并未发现HPV感染患者外周血T细胞分类的显著异常,但高比率的CD4+/CD8+比值异常和高比率的UU合并感染是两个必须引起关注的问题。免疫平衡的破坏对妊娠的建立和维持均有不利影响[15]。免疫细胞分布的细微变化可能对宿主处理HPV感染和抵御其他病原体入侵的能力有重要影响[16];同时,当女性免疫功能异常时,可产生抗精子抗体并影响孕育过程[17]。另一方面,高危型HPV感染患者容易发生生殖道支原体、衣原体、真菌等病原体合并感染,可引起输卵管炎症、损伤和瘢痕的改变,从而导致输卵管性不孕的发生[18]。
经研究,高危型HPV感染的女性不孕患者中存在免疫紊乱的情况且与UU感染的协同病理效应(对输卵管影响)[19],这些因素可能增加女性不孕的发生率。但由于本研究例数较少,该紊乱与不孕之间是否存在因果联系有待进一步研究阐明。尽管未能证明高危型HPV感染是否引起女性不孕的主要原因,但它必须被视为降低生育率或不育的危险因素,在临床诊治时充分考虑感染者的免疫功能的变化,从而提高HPV感染治愈机会,预防宫颈癌的发生和降低不孕的发生率。

