瘦素对动脉内皮细胞影响的研究进展*
陈耿森, 沈粤春
广州医科大学附属第一医院心血管内科(广东广州 510120)
瘦素(leptin)是肥胖基因(ob gene)编码的一种具有多重生物学效应的蛋白质,主要功能是降低食欲、提高能量代谢水平,是抑制肥胖症的主要物质。其主要来源于白色脂肪组织,借助旁分泌、自分泌的方式入血,透过血脑屏障(BBB),与相应受体结合而发生作用。动脉内皮细胞(AEC)构成了动脉内层,除具有屏障功能外,还有分泌不同物质、调节血管运动的作用,而AEC损伤在AS发生、发展中起重要作用。瘦素受体分为长受体b型、短受体(a、c、d、f四型)及可溶性受体e型三大类[1-2]。AEC表面表达b型瘦素受体,为一种具有完整的信号通路结合位点的单跨膜受体,与瘦素特异性结合并发挥作用[3-4]。本文就近年来瘦素与血管内皮细胞关系的研究进展作一综述,包括瘦素影响动脉内皮细胞氧化应激、促进内皮细胞增殖及血管形成、导致动脉内皮细胞功能障碍、诱导动脉内皮细胞分化增殖与迁移、加速动脉内皮细胞损伤及炎症以及影响动脉内皮细胞分泌功能,为AS的研究特别是肥胖相关的AS机制研究提供参考。
1 瘦素与动脉内皮细胞氧化应激
氧化应激反应过程中会产生许多炎症相关因子和活性氧簇(ROS), ROS包括:超氧自由基(O2-)、羟自由基(OH-)等自由基衍生物,ROS超载会破坏细胞内的氧化-抗氧化平衡, 造成氧化损伤。最早的瘦素与动脉内皮细胞关系的研究为1999年 Bouloumie[5]的报道,发现,在高浓度瘦素(100 ng/mL)刺激下1 h,人脐静脉内皮细胞(HUVEC)中ROS的量会聚集,造成内皮细胞损害,认为瘦素具有促进氧化应激的作用。此后,关于瘦素参与氧化应激机制的研究越来越多。Procopio等[6]的研究结果显示瘦素可能通过腺苷酸活化蛋白激酶→蛋白激酶B→一氧化碳合成酶(AMPKα1→Akt→eNOS)途径促进内皮细胞一氧化氮合成酶(eNOS)活化。除此之外,个别研究还发现瘦素对内皮细胞可能存在保护作用:Blanquicett等[7]通过对HUVEC用瘦素(5或60 ng/mL)以不同时间(30~60 min,和72 h)刺激,检测超氧化物和 eNOS活性,结果显示短时间高浓度瘦素刺激HUVEC增加eNOS活化。而长期瘦素刺激并没有改变eNOS表达及一氧化氮(NO)释放及超氧化物的生成。提示,长期慢性瘦素的刺激并不利于血管内皮功能和氧化应激损伤的保护。杨涛等[8]利用ECV-304细胞系,以不同的缺氧/复氧时间对细胞造成损伤。与单纯缺氧组和缺氧/复氧组相比,瘦素处理细胞后,细胞内丙二醛(MDA)和乳酸脱氢酶(LDH)含量明显下降,超氧歧物氧化酶(SOD)含量升高,以瘦素浓度为50 μg/L最明显。说明瘦素对内皮细胞具有抗氧化、抗自由基的作用。正如上述,这对看似矛盾的结论取决于瘦素作用时间及浓度:浓度低时间短,或者相同瘦素浓度,时间短,造成氧化应激;反之,出现抗氧化,起保护作用,与抗自由基酶SOD产生有关。但这些都是体外细胞实验结果,体内缺乏直接证据。上述研究虽未指明的MDA、LDH和SOD来源,但实际情况是,体内高浓度瘦素长时间造成氧化应激增加、直接或间接损害动脉内皮细胞。提示瘦素对机体作用的复杂性,及体内和体外研究存在差异。
2 瘦素促进内皮祖细胞形成及血管形成
循环内皮祖细胞(EPC)是内皮细胞的前体细胞,来源于人循环单核细胞,其主要分布于骨髓、外周血和脐带血,少量存在于器官及组织中。骨髓中含有的大量造血干细胞和间充质干细胞等可分化为EPC,归巢至受损部位,分化为成熟内皮细胞参与血管修复[9]。大量研究表明,瘦素可促进血管内皮细胞的增殖,调节血管重塑和新内膜形成,促进组织间血管的生成。Adya等[10]研究发现该血管内皮细胞的损伤可能会导致血管疾病。瘦素在10 ng/mL的生理浓度下促进新生血管的形成,而高浓度(100 ng/mL)该作用反而减弱。无论是在生理条件还是在高浓度瘦素条件下,瘦素受体都可影响EPC功能。Schroeter等[11]将荧光标记的人类EPC注射到血管损伤无胸腺裸鼠体内,发现瘦素通过整合素avb5和a4途径与EPC结合,刺激血管内膜内皮化和减少新生内膜形成。表明瘦素能够特异性调节EPC的黏附和聚集能力,可能以此在体内促进血管修复。Lanier等[12]研究发现瘦素可经由细胞内ROS介导而自分泌的血管内皮生长因子(VEGF)改变细胞外基质,使血管更易于生长,通透性增强,促进巨噬细胞聚集和脂质沉积,诱导平滑肌细胞的增生、迁移。
3 瘦素与动脉内皮细胞功能障碍
动脉内皮细胞功能障碍(ED)是研究瘦素与AEC关系中最重要的内容。此方面的研究包括造成动脉内皮细胞功能障碍,即血管收缩血压升高,以及改善动脉内皮细胞功能,即舒张动脉作用,这些相互拮抗的作用主要取决于瘦素作用的时间。Ding等[13]通过研究140例慢性肾病的患者和140例健康受试者,发现患者血清瘦素显著高于对照组,且血清可溶性细胞间黏附分子-1(sICAM-1)和可溶性血管黏附分子-1(sVCAM-1)的表达水平升高。这可能通过涉及蛋白激酶B/糖原合成酶激酶-3b(Akt/GSK3β)和β-联蛋白途径,以此使f-肌动蛋白细胞骨架分裂,从而促成ED。Manuel-Apolinar等[14]的体外实验显示,采用瘦素处理培养的内皮细胞,导致其内环氧化酶-2(COX-2)和细胞间黏附因子-1(ICAM-1)表达上调,启动并促进前列腺素产生和募集黏附分子,直接作用于内皮细胞,造成损伤。另外,瘦素参与ED形成,可能还涉及其他机制:Wang等[15]发现,瘦素需要交感神经系统的参与,才能表现血管活性。而Li等[16]的研究中,用棕榈酸(PA)制作内皮细胞中的高脂血症,然后用利拉鲁肽[胰高血糖素样肽-1(GLP-1)类似物]处理。结果显示,PA诱导的瘦素抵抗前提下,细胞因子信号传导抑制蛋白-3(SOCS3)表达下降,同时eNOS活化增强。说明瘦素抵抗的状态能够限制瘦素对动脉内皮张力的影响,具体效应需要进一步发掘。一般情况下,血管处于一定的舒张状态,而血管内皮细胞能够合成与释放舒血管活性物质,主要为NO、前列环素(PGl2)、超极化因子(EDHF)等。瘦素可通过介导EDHF使平滑肌超极化,参与调节血管张力[17];另一方面,通过增加内皮细胞酪氨酸激酶2(JAK2)、信号转导因子和转录激活因子3(STAT3)磷酸化,上调eNOS-/-小鼠内皮细胞神经型一氧化氮合酶(nNOS)的表达,分泌更多NO,维持血管舒张[18]。另外,与此不同的是:Quehenberger等[19]利用瘦素通过c-Jun氨基末端激酶(JNK)(可能涉及bZIP转录因子家族参与),上调HUVEC的内皮素-1(ET-1)表达,而ET-1亦是迄今为止发现的作用最强的缩血管因子。血管内皮细胞功能障碍与原发性高血压密切相关,高血压涉及全身小血管的病变,与ED可形成恶性循环。对此,研究瘦素对动脉内皮细胞损伤及舒缩效应的影响,有助于进一步完善心血管疾病特别是高血压的分子生物机制。
4 瘦素诱导动脉内皮细胞分化、增殖与迁移
通过诱导不同的细胞系分化形成内皮细胞,用不同因素刺激其增生、迁移,对提高缺血部位的血管新生、修复血管、靶向治疗等有着不可估量的前景,同时又可促进动脉内膜增生增厚、促进AS形成,体现了不同因素的复杂性与双刃剑作用。Bekhite等[20]采用人类脂肪组织来源的干细胞(hASC)分化后的脂肪细胞,以细胞缺氧的条件,联合瘦素与VEGF作用,使脂肪细胞有效分化成内皮细胞(通过内皮细胞标志物CD31、血管性血友病因子(vWF)进行鉴定)。有实验表明,瘦素浓度在 0~100 ng/mL之间,能显著促进血管内皮细胞(VEC)与血管平滑肌细胞(VSMC)的增殖[21]。另外,Burgazli等[22]用瘦素和羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂的联合培养HUVEC,通过调节异戊烯酸化,毛细血管样组织形成减少,而抑制了HUVECs的增殖和迁移。反向验证了瘦素促进内皮细胞增殖、迁移的作用。但是也有研究结果显示,加入瘦素的情况下,运用脂联素刺激并不能促进HUVEC增殖。提示瘦素对内皮细胞增殖影响与不同类型脂肪因子的动态平衡有关[23]。
5 瘦素促进动脉内皮细胞损伤及炎症
针对瘦素参与动脉内皮细胞的损伤及炎症,研究表明瘦素可能通过上调HUVEC的a型瘦素受体表达,升高细胞外信号调节激酶(ERK)1/2磷酸化及核因子-κB(NF-κB)活化,增加肿瘤坏死因子-α(TNF-α)分泌,进而导致ED,促进炎症发生[24]。同时瘦素通过蛋白激酶C(PKC)和RhoA途径诱导C反应蛋白(CRP)的 mRNA转录,使内皮细胞CRP表达增多。提示瘦素在炎症发生过程中可能作为CRP的直接刺激来源[25]。
6 瘦素改变动脉内皮细胞分泌功能
瘦素通过诱导血管内皮细胞分泌的改变,释放不同的因子发生一系列反应,主要涉及以下几个方面。
6.1 血管舒缩功能因子 如前所述,瘦素可引起AEC分泌血管舒缩物质如NO、ET-1等,引起血管张力改变。陈岳林等[26]的研究结果显示,经瘦素注射使大鼠主动脉环血管张力发生改变,提高AEC依赖的舒张效应,源于瘦素增加内皮细胞NO表达及体质指数降低改善血管功能。就短时间瘦素作用于单纯内皮细胞而言,产物(主要是NO)的综合效应是促进血管舒张。但长时间高瘦素水平,对机体整体的影响,仍然是促进血压升高为主。
6.2 炎症相关因子 瘦素可以诱导氧化应激,使不同的炎症因子表达增加,导致内皮细胞损伤,发生炎症。根据研究,高浓度瘦素可诱导HUVEC表达肿瘤坏死因子受体(CD40)和NF-κB,同时,上调TNF-α、白细胞介素(IL)-6、8、1β等趋化因子的表达,中性粒细胞被激活,进而变形、趋化、脱颗粒等。而这些炎症因子参与了高瘦素血症引发的动脉粥样硬化的发生和发展[27-30]。与此同时,瘦素促进内皮细胞单核细胞趋化蛋白-1(MCP-1)、细胞间黏附分子-1(ICAM-1)、氧化低密度脂蛋白的内皮受体(LOX-1)表达增加,促进单核细胞黏附,增加氧化型低密度脂蛋白(ox-LDL)促进了巨噬细胞向泡沫细胞转化[31]。
6.3 血管内皮细胞生长因子 瘦素的血管生成作用主要与VEGF有关。VEGF在创伤愈合、组织器官修复、胚胎发育、启动血管形成等方面发挥重要作用。其仅在特定病理条件下表达增多,例如炎症、缺血、肿瘤等。Garonna等[32]研究发现,瘦素通过促分裂素原活化蛋白激酶/蛋白激酶B/环氧化酶-2(p38MAPK/Akt/COX-2)信号轴,受上游血管内皮生长因子受体2型(VEGFR2)的活化调节,联合体现促血管生成作用。该效应是瘦素促进动脉壁炎症加速动脉粥样硬化的表现之一。
7 瘦素与动脉内皮细胞的关系研究进展
笔者结合上述瘦素对动脉内皮细胞结构功能的影响,及不同生物学效应产生的途径,以简易图示进行概括,见图1。
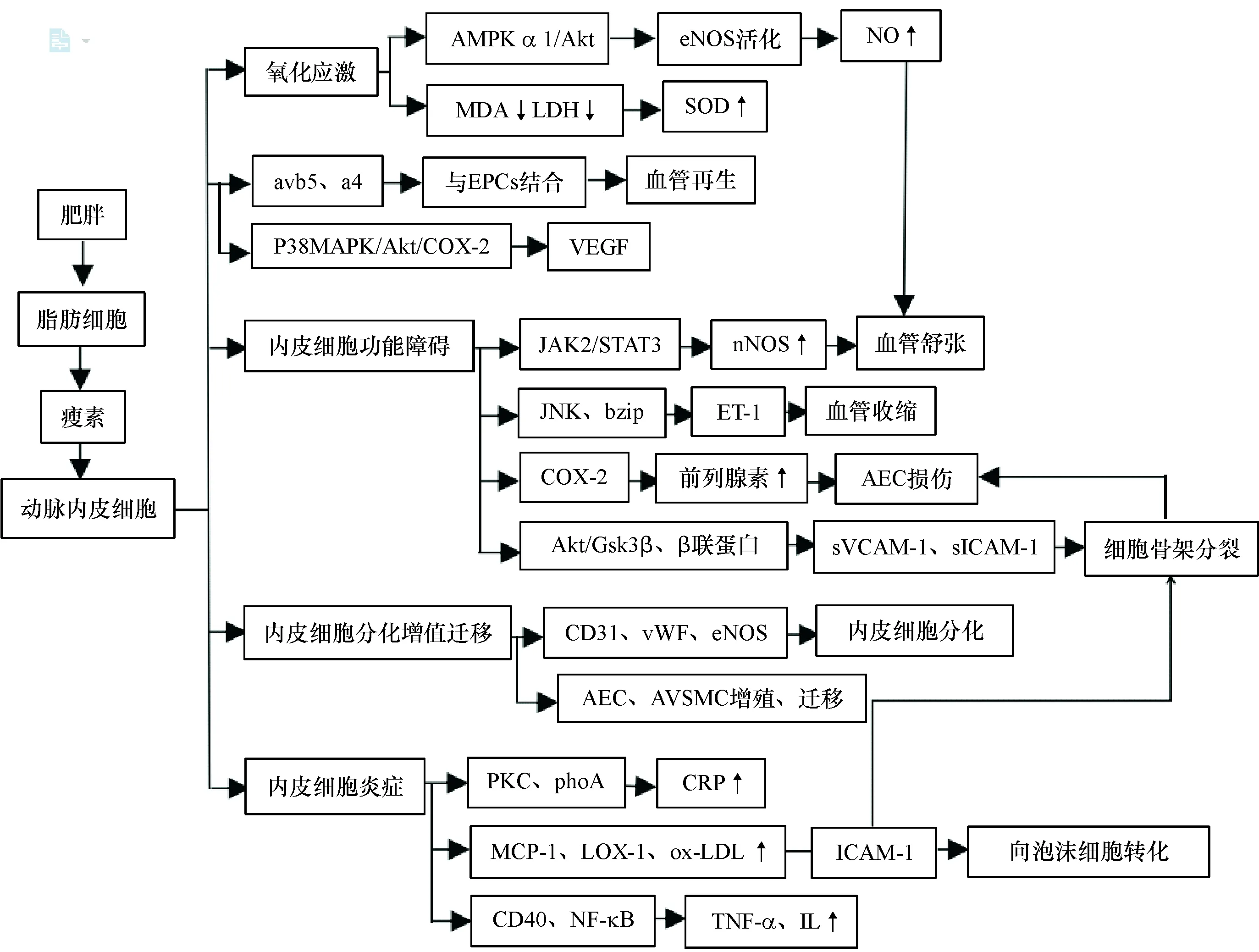
注:AMPK:AMP依赖的蛋白激酶;eNOS:内皮型一氧化氮合成酶;NO:一氧化氮;MDA:丙二醛;LDH:乳酸脱氢酶;SOD:超氧化物歧化酶;avb5、a4:整合素;EPCs:内皮祖细胞;p38MAPK:38 kD的促分裂素原活化蛋白激酶;AKT:蛋白激酶B;COX-2:环氧化酶-2;VEGF:血管内皮生长因子;JAK2:蛋白质酪氨酸磷酸激酶;STAT3:转录激活因子3;nNOS:神经行一氧化氮合成酶;JNK:c-Jun氨基末端激酶;ET-1:内皮素-1;Gsk3β:糖原合成酶激酶-3b;sVCAM-1:可溶性血管黏附分子1;sICAM-1:血清可溶性细胞间黏附分子-1; CD31:内皮细胞标志物;vWFV:血管性血友病因子;AEC:血管内皮细胞;AVSMC:血管平滑肌细胞;PKC:蛋白激酶C;RhoA:小分子G蛋白;CRP:C反应蛋白;MCP-1:核细胞趋蛋白-1;LOX-1;氧化低密度脂蛋白的内皮受体;ox-LDL;氧化型低密度脂蛋白;ICAM-1;胞间黏附分子-1;NF-κB:核因子κB;TNF-α:肿瘤坏死因子-α;IL:白细胞介素
图1瘦素与动脉内皮细胞的关系研究进展
8 小结与展望
动脉内皮细胞损伤、功能障碍等与多种疾病特别是肥胖相关性疾病例如冠心病、高血压密切相关。瘦素与动脉内皮细胞炎症损伤、功能障碍等的关系在其促进动脉粥样硬化及高血压中起着重要作用,例如瘦素促进动脉内皮细胞氧化应激、造成活性氧增加、损害内皮细胞;也有报道瘦素抗氧化、抗自由基、保护内皮细胞;这些体现了瘦素作用的复杂性。而单纯研究内皮细胞不一定反映其总体效应。虽然目前在瘦素对动脉内皮细胞影响的研究有一些进展,但仍需要深入广泛的研究,并注重机体的整体效应,这将为动脉粥样硬化及高血压等瘦素相关性心血管疾病的防治提供新思路与新靶点。

