兽用生物制品批准文号审查要点及问题解析
谭克龙,宫爱艳,吴涛
(中国兽医药品监察所,北京 100081)
兽药产品批准文号是农业农村部根据兽药国家标准、生产工艺和生产条件批准特定兽药生产企业生产特定兽药产品时核发的兽药批准证明文件[1]。截止到2019年6月,共核发有效兽药批准文号82913个,其中生物制品1979个。2018年全年共接收生物制品批准文号申报资料573份,其中符合要求的申报材料363份,不符合要求的申报材料210份,退回率36.6%。较高的申报资料退回率造成企业的时间成本和国家行政资源的浪费,严重降低了工作效率。为此,笔者根据工作经验解析兽药产品批准文号技术审查重点和企业申报工作中的常见问题,以期对兽药生产企业申报兽药产品批准文号工作有所帮助和借鉴。
1 审查的主要依据和工作程序
1.1 审查的法律依据 按照《兽药管理条例》第十五条规定“兽药生产企业生产兽药,应当取得国务院兽医行政管理部门核发的产品批准文号,产品批准文号的有效期为5年。兽药产品批准文号的核发办法由国务院兽医行政管理部门制定”[1]。2015年12月3日农业部令第4号颁布了新《兽药产品批准文号管理办法》,并于2016年5月1日开始实施;此外《兽药标签和说明书管理办法》等配套办法也是申报资料审查的法律依据。
1.2 审查的技术标准 兽药企业申报兽药产品批准文号,应该严格按照《兽药产品批准文号管理办法》要求提交申报材料。审查必须要依据兽药国家标准进行。目前审查兽用生物制品的主要技术标准包括《中国兽药典》(2015年版)、《兽药产品说明书范本》(2015年版)、《中华人民共和国兽用生物制品规程》(2000年版)、《兽药质量标准》(2017年版生物制品卷)以及农业农村部发布的新兽药注册公告。为配合新的《兽药产品批准文号管理办法》实施,农业农村部还发布一系列相关配套规章和制度,如农业部公告第2401号发布了《兽药产品批准文号申请表》《兽药产品批准文号核发及标签、说明书审批规范》《兽药产品批准文号核发标签、说明书审批标准》,农业农村部办公厅关于印发《兽药产品批准文号现场核查申请单》等7个配套文件(农办医[2016]27号)、农业农村部办公厅关于兽药产品批准文号核发有关事宜的通知(农办医[2016]41号)等。
1.3 审查的工作程序及时限 《兽药产品批准文号管理办法》中明确规定了不同申报类型产品的工作程序及审批时限具体见图1和表1
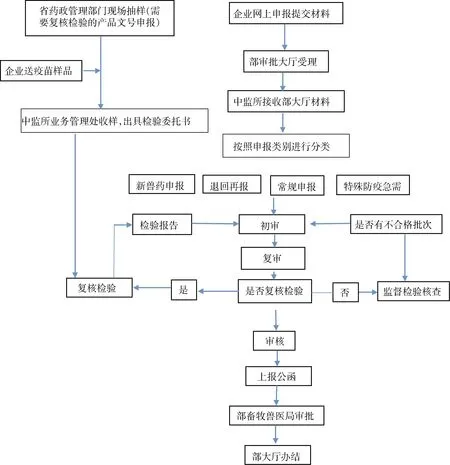
图1 生物制品申报资料审查程序

表1 兽用生物制品产品批准文号承诺时限
注:以上承诺为最长时限,实际办理所需时间均在承诺时限内完成
2 申报资料审查重点
根据新的《兽药产品批准文号管理办法》规定,企业在申报兽用生物制品批准文号时,不同类型要提供相应的资料并经农业农村部兽药产品批准文号核发系统填报。审查人员根据申报类型不同进行分类审查,重点对申请方式、申请类别、生产范围(条件)、复核检验报告、标签说明书及商品名称、产品生产工艺配方资料6个方面进行审查。
2.1 申请方式 申请方式分为首次申请和换发申请两种。企业申报的产品从未获得过批准文号,申请方式应为首次申请;企业申报的产品曾经获得过批准文号,再次申报时,应为换发申请。此项审查企业申报与实际情况是否一致。
2.2 申请类别 按照《兽药产品批准文号管理办法》相关规定,兽用生物制品申请类别分为三大类:一是申请本企业研制的已获得《新兽药注册证书》的兽药产品批准文号的;二是申请他人转让的已获得《新兽药注册证书》或《进口新兽药注册证书》的生物制品类的兽药产品批准文号的;三是申请前两种之外的生物制品类兽药产品批准文号的。审查人员要对企业申报产品的类别是否正确进行审查[2]。
2.3 生产范围(条件) 兽药产品批准文号申报中的生产范围(条件),是指生产该兽药产品所应具备的的硬件条件,应符合兽药GMP要求。兽药产品批准文号申报涉及的项目为“生产范围”和“拟生产该产品的生产线”。审查人员着重对申报企业是否具备生产申报产品的条件进行审查。对于需要在两种(及以上)生产线生产的联苗制品,应在“拟生产该产品的生产线”要填写全生产该制品涉及的所有生产线。申报兽医诊断制品,应根据类别明确填写免疫学类诊断制品(A/B类)或分子生物学类诊断制品(A/B类)。对于已旧命名方式命名的诊断制品生产线,应尽快按标准命名后申报。
2.4 复核检验报告 按照《兽药产品批准文号管理办法》的有关规定需要复核检验的生物制品的,样品由省级兽药检验机构现场抽取,并加贴封签,加贴封签的样品由生产企业交送中国兽医药品监察所进行委托检验。审查人员主要审查抽样单、委托检验委托书、复核检验样品信息的一致性;自检报告执行标准与申报标准一致性;检验项目是否按执行标准检验;复核检验报告结果是否符合规定等。
2.5 标签说明书及商品名称 按照《兽药管理条例》有关规定:兽药包装应当按照规定印有或贴有标签,附具说明书。审查的重点是审查申报兽药产品的标签和说明书样稿编写内容是否与兽药国家质量符合、《兽药产品说明书范本》等规定一致。申报的商品名是否复核《兽药商品名称命名原则》[1,3,6]。
2.6 产品生产工艺、配方等材料 产品生产工艺、配方等材料需按照农办医(2016)27号文件附件7《兽用生物制品生产工艺技术要求》进行填写,不能擅自改变表格项目。对于双地址进行生产的,应写明两个生产地址。
2.7 申请资料附件的审查 不同的申报类别需要提供不同的资料,具体提供的附件见表2

表2 企业所需申请资料
3 常见退回理由
在兽药产品批准文号技术审查过程中发现,由于有些申报企业不能全面理解和掌握兽药产品批准文号的政策法规和技术标准,造成申报资料不能一次审批通过,退回率居高不下。分析近年来退回数据,列出退回率较高的几类退回情况并进行解析。
3.1 标签说明书编写有误 农业农村部制定兽药标签和说明书编写细则、范本,作为兽药标签和说明书编制、审批和监督执法的依据。[3]企业对于有兽药说明书范本的产品,一定要按照范本进行编制标签和说明书。值得注意的是:(1)生物制品一个标准涉及多种规格,说明书需写出所有规格,标签应为单一规格。(2)有两种保存条件且有效期不同的,需分开编写标签说明书。(3)标签中不应印有无关文字或图案(如宣传性文字、非靶动物图案等)。(4)按照农业部公告第2273号第六条要求,标签说明书上不能印有未审批通过的商品名。
3.2 产品生产工艺配方资料编写有误 申报时应注意以下方面:⑴ 应正确填写企业和产品的信息。⑵ “主要成分与含量”项目中的填写内容应与发布的产品说明书中的内容应一致。若说明书中只有“主要成分”,此处也只填写主要成分即可。⑶ 产品配方表中原料名称应将所生产制品涉及的抗原、抗体种类填写齐全(包含菌毒株),不应少于产品制造和检验规程中成品配制包含的内容;辅料应写明保护剂或佐剂。⑷ 原料列表中的主要原料名称,申报企业应按照申报产品工艺要求填写生产涉及的菌毒种、细胞、培养基、佐剂、冻干保护剂等(不适用的除外);填写各原料和内包装材料来源/生产商和所执行的质量标准。⑸ 工艺流程图、关键控制点及参数:按产品生产实际情况填写,但不能违反兽药GMP的相关规定。例,冻干生产步骤净化级别应填写“万级背景下的局部百级”,至少应填写“万级区”。应按照申报产品的生产规程填写生产关键步骤。⑹ 申报强制免疫类疫苗兽药批准文号的,应提供详细的疫苗生产工艺,特别是要确定生产工艺、固化控制指标(如培养方法、浓缩倍数、抗原含量、有效成分含量等)[4]。
3.3 权属证明文件材料提供不全 按照农业部公告第1899号规定“监测期内的新兽药,每个品种,包括同一品种的不同规格,只能由新兽药注册企业生产,但最多不超过3家(必要时,按注册排序确定);新兽药注册单位中无相应生产条件的,可以转让1家其他企业生产”[5]。因此在监测期内申请批准文号时,研发单位超过3家的,需要提交经所有研发单位同意的新兽药监测期内确定生产的企业证明材料(原件)。
申请他人转让的已获得《新兽药注册证书》的生物制品类的兽药产品批准文号的,应提供技术转让合同让与方拥有该申报产品全部知识产权的证明材料或《新兽药注册证书》上所有研制单位共同签署的技术转让合同。值得注意的是首次申请的,需提供转让协议原件;换发的可提供复印件加盖企业公章。
3.4 申报兽医诊断试剂、卵黄抗体文号常见问题解析 由于兽医诊断试剂有多组分的特点,在填写产品配方表时常出现问题。因此企业申报诊断试剂产品文号时要注意:⑴ 填写产品配方表时应按产品的组分填写。⑵填写“主要原料名称”时应按产品的组分逐个填写,组分中涉及菌毒种、细胞、培养基等的,应逐一填写清楚。⑶ 填写“生产关键步骤”时应按产品的组分逐一填写,最后填写各组分分装情况。⑷ 部分组分需要委托生产的,应提供委托生产组分的委托加工协议,涉及到病原微生物的,还应提供生产单位资质证明材料。申报卵黄抗体文号在填写产品配方表时,直接按产品填写抗体名称;由于生产抗体类制品涉及免疫原,因此在填写“主要原料名称”时还应将免疫原制备涉及菌毒种、细胞、培养基、佐剂等情况逐一填写清楚。填写“生产关键步骤”时还应将免疫原制备步骤逐一填写清楚。
3.5 菌(毒、虫)种合法来源证明材料提供不全 申请非自己研发或转让的生物制品类兽药产品批准文号的,需要提供菌(毒、虫)种合法来源证明复印件(加盖申请人公章)。在审查中发现很多企业提供无效的证明或提供的证明材料不全。证明材料分为两种情况:一是国家菌种保藏中心保藏并供应的菌(毒、虫)种,首次申请产品批准文号的,申报企业应提供《兽医微生物菌(毒、虫)种批件》复印件和购买菌(毒、虫)种销售单复印件;换发申请的,需提供购买菌(毒、虫)种销售单复印件。如未提供菌(毒、虫)种销售单仅提供菌(毒)种分发证书的,分发证书应加盖有“中国兽医药品监察所菌毒种、诊断制品销售专用章”,且菌毒种应在有效期内。二是对于早先的没有获得《新兽药注册证书》产品的菌(毒、虫)种,申报企业换发文号是应提供合法获得菌(毒、虫)种来源途径、代次的书面说明和对该基础菌(毒、虫)种按照《中华人民共和国兽用生物制品规程》(2000年版)等进行全项检定的报告。
4 结语
兽药产品批准文号审查是兽药审批的最后一个环节,是企业所有兽药申报活动的最终目标,也是兽药投入市场的必备条件。兽用生物制品是动物防疫工作的重要物质基础,事关动物疫病防控效果,事关生物安全和公共卫生安全。因此,加强对产品批准文号审批工作的管理,对于规范兽药生产、提高兽药质量、促进兽药行业健康有序发展具有较为深远意义。

