自噬抑制剂3-MA对重度急性胰腺炎大鼠肠道黏膜屏障作用的实验研究*
罗旭娟 彭 燕 陈 霞 石 蕾
川北医学院附属医院消化内科1(637000) 西南医科大学附属医院消化内科2
背景:肠道黏膜屏障功能与重度急性胰腺炎(SAP)患者病情转归有密切关系,保护肠道黏膜屏障功能已成为SAP治疗的关键环节。目的:探索自噬与SAP肠道黏膜屏障功能的关系以及自噬抑制剂3-MA对SAP肠道黏膜屏障功能的影响。方法:将SD大鼠分为假手术组(SO组)、急性坏死性胰腺炎组(ANP组)、3-MA组,并进一步分为术后3 h、6 h、12 h三个亚组。采用HE染色观察胰腺组织、肠道组织病理变化,检测血淀粉酶,ELISA法检测血清内毒素、肠型脂肪酸结合蛋白(I-FABP)水平,蛋白质印迹法检测Beclin-1蛋白表达。结果:与SO组相比,ANP组各时间点胰腺和末端回肠组织病理学评分、血淀粉酶、内毒素、I-FABP明显升高(P<0.05),Beclin-1蛋白表达显著降低(P<0.05),且均呈时间依赖性(P<0.05);给予3-MA后,上述各指标均明显改善(P<0.05)。结论:在SAP中,肠道自噬随病情进展逐渐增加,以3-MA干预后,肠道自噬有所减少,且肠道黏膜屏障功能损伤减轻。提示肠道自噬与SAP肠道黏膜屏障功能损伤有关,3-MA对其有一定抑制作用。
重度急性胰腺炎(severe acute pancreatitis, SAP)是临床上常见急腹症之一,其发病迅速,病情进展快,病死率高,已成为临床治疗难点之一[1]。SAP早期即合并多器官功能障碍,而肠道是最早出现障碍的器官之一。大量研究表明,肠道黏膜屏障功能障碍可导致肠道细菌、内毒素移位,从而使SAP患者感染并发症发生率上升,加重病情。预防和治疗肠道功能障碍已成为SAP治疗的关键环节。自噬在SAP中的作用是近年研究的新领域,已有研究表明,SAP时自噬被异常激活且自噬通路受阻,自噬泡异常堆积,导致胰蛋白酶原在胰腺腺泡细胞内激活损伤胰腺腺泡细胞从而启动并加重SAP[2]。但自噬与SAP肠道黏膜屏障功能关系的研究目前尚少见。本研究通过采用急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)模型观察自噬与SAP肠道黏膜屏障功能障碍的关系以及自噬抑制剂3-甲基腺嘌呤(3-methyladenine, 3-MA)对SAP肠道黏膜屏障功能的作用,旨在为SAP肠道黏膜屏障功能的保护探索新的治疗措施。
材料与方法
一、实验动物和主要试剂
健康雄性Sprague-Dawley大鼠共90只,体质量200~250 g,购自西南医科大学动物实验中心,适应性喂养48 h。本研究方案由西南医科大学实验动物伦理委员会审批(批号:201906-2),符合实验室动物管理与使用准则。
3-MA(Sigma公司),ELISA检测试剂盒(武汉默沙克生物科技有限公司),Beclin-1、GAPDH抗体(Cell Signaling Technology, Inc.)。
二、研究方法
1. 动物分组和模型制备:实验前12 h禁食,大鼠自由饮水,实验前2 h禁水。按随机数字表法将大鼠随机分为假手术组(SO组)、ANP组、3-MA组,每组各30只,各组再进一步分为术后3、6、12 h亚组,每亚组各10只。采用改良Aho方法制备ANP模型[3],SO组大鼠开腹后仅将十二指肠提出切口,轻轻翻动胰腺后立即关腹。3-MA组大鼠在建立ANP模型前30 min腹腔注射3-MA(15 mg/kg)。各组大鼠分别于术后3 h、6 h、12 h经腹主动脉穿刺采血,分离血清后置于-80 ℃冰箱保存。采血后迅速将大鼠处死,快速取出胰腺、末端回肠组织,部分于4%多聚甲醛固定,部分-80 ℃保存用于后续测定。
2. 血淀粉酶:收集各时间点各组大鼠血清,采用全自动生化分析仪检测血淀粉酶。
3. 组织病理学检查:取各组大鼠胰腺、末端回肠组织,4%多聚甲醛固定标本,石蜡包埋,切片,HE染色。采用盲法由两位专科病理医师于光学显微镜下阅片评分,胰腺组织采用改良Schmidt评价标准[4],末端回肠组织采用Chiu小肠组织损伤评价标准[5]。
4. 肠道通透性的测定:采用ELISA法测定造模3 h、6 h、12 h大鼠血清内毒素、肠型脂肪酸结合蛋白(I-FABP),具体步骤按试剂盒说明书进行操作。
5. 肠道组织Beclin-1蛋白表达:取各组大鼠末端回肠组织,加入组织裂解液于冰上裂解,提取总蛋白,使用BCA法定量蛋白浓度。每孔上样20 μg蛋白,行SDS聚丙烯凝胶电泳,电泳后转移至PVDF膜上,脱脂奶粉室温封闭,加入一抗(按1∶1 000稀释Beclin-1)4 ℃过夜,PBST洗涤,加入二抗室温孵育1 h;ECL显色,采用Quantity One软件测定各条带灰度值。
三、统计学分析
结 果
一、胰腺、肠道组织病理学改变
SO组胰腺、肠道组织无明显改变。ANP组大鼠腹腔出现淡红色腹水,胰腺不同程度充血、点片状坏死;镜下可见胰腺水肿,腺泡结构破坏,小叶间隔增宽,腺泡细胞不同程度坏死,周边可见中性粒细胞浸润,且随时间延长而加重。ANP组大鼠末端回肠黏膜层重度水肿,小肠绒毛短小、稀少、脱落、断裂现象明显;上皮细胞脱落明显;绒毛固有层结缔组织松散,中性粒细胞浸润明显,小肠腺变浅,数量明显减少,且随时间延长而损伤加重。ANP组和3-MA组胰腺和末端回肠组织病理学评分均随时间延长而升高(P<0.05)。与SO组相比,ANP组、3-MA组各时间点胰腺和末端回肠组织病理学评分均显著升高(P<0.05);与ANP组相比,3-MA组12 h时的胰腺组织病理学评分显著降低(P<0.05),6 h、12 h时的末端回肠组织病理学评分亦显著降低(P<0.05;图1、表1)。
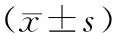
表1 三组大鼠不同时间点胰腺和末端回肠组织病理学评分比较
二、血淀粉酶
ANP组、3-MA组血淀粉酶水平均随时间延长而显著升高(P<0.05)。与SO组相比,ANP组、3-MA组血淀粉酶水平均显著升高(P<0.05);与ANP组相比,3-MA组各时间点血淀粉酶水平均显著降低(P<0.05;表2)。
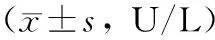
表2 三组大鼠不同时间点血淀粉酶比较
三、血清内毒素、I-FABP变化
ANP组、3-MA组血清内毒素、I-FABP均随时间延长而显著升高(P<0.05)。与SO组相比,ANP组、3-MA组血清内毒素、I-FABP水平均显著升高(P<0.05);与ANP组相比,3-MA组6 h、12 h时的血清内毒素、I-FABP水平显著降低(P<0.05;表3)。
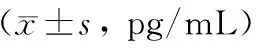
表3 三组大鼠不同时间点血清内毒素、I-FABP比较
四、肠道组织Beclin-1表达情况
ANP组、3-MA组末端回肠组织Beclin-1表达随时间延长而逐渐升高,且各时间点3-MA组Beclin-1表达均明显低于ANP组(P<0.05;图2)。

1 Da=0.992 1 u
讨 论
近年来,SAP发病机制和治疗的研究取得了不少进展,但病死率仍很高,可达36%~50%[6]。如何从源头上抑制SAP局部炎症反应的发生以及级联炎症反应的扩大,是治疗SAP的关键。
急性胰腺炎(acute pancreatitis, AP)发病早期,胰腺腺泡细胞死亡方式是决定病情发生、发展和预后的关键。胰腺腺泡死亡方式分为坏死和凋亡两种形式,AP病情严重程度与腺泡细胞凋亡呈负相关,与坏死呈正相关[7-9]。SAP常伴有胰腺腺泡细胞大量坏死,导致胰腺局部炎症反应加重,引发全身炎症反应综合征和多器官功能障碍。但既往观点认为,坏死为一种不可调控、被动的非程序性死亡方式,广泛参与各种病理生理过程,因其不可调控性,故未引起各研究者的重视。2005年,Degterev等[10]在研究缺血性脑损伤的细胞死亡方式时,发现了一种可被调控的特殊类型细胞坏死方式,并将其命名为程序性坏死。即部分细胞的坏死可被一些内外因子启动,通过特定的信号通路和程序发生,可对其启动、发生、发展进行有目的地调控。AP早期,腺泡细胞存在程序性坏死现象,可能为有效调控AP病情,特别是SAP的发生、发展提供了一条潜在干预途径。自噬作为一种程序性细胞死亡方式,已成为调控SAP病情的研究热点。
自噬广泛存在于真核生物的病理生理过程中,对维持机体的稳态起有重要作用。既往研究[11]表明,生理状态下胰腺外分泌组织中的生理性自噬高于心、肺、肾和胰腺内分泌组织,且禁食24 h后,胰腺外分泌的生理性自噬增强,对胰腺外分泌组织起有保护作用。但发生AP时,小鼠腺泡细胞中的自噬体增大增多,但自噬溶酶体蛋白降解能力降低,提示AP时自噬通量可能受阻[12]。Mareninova等[13]对分离的胰腺细胞、动物模型和人体组织的研究证实AP时自噬通量受损,胰腺腺泡内大量异常自噬空泡堆积,异常自噬参与腺泡细胞空泡和酶原的激活,导致AP的发生。通过抑制SAP胰腺腺泡细胞自噬,能减轻炎症反应及其严重程度[14]。
自噬的主要形式是巨自噬。巨自噬是一个多步骤过程,始于形成自噬体。自噬体形成是一个复杂的过程,触发阶段包括形成所谓的隔离膜或吞噬细胞,延伸以吞噬细胞质的部分(包括细胞器,如线粒体),并最终闭合以形成成熟的自噬体。该过程由一系列进化保守的Atg基因以及脂质激酶如Ⅲ类磷脂酰肌醇3-激酶(PI3KⅢ)控制。PI3K/Akt信号通路是调节自噬的重要途径。Lupia等[15]的研究表明,以PI3K基因敲除小鼠建立AP模型,其炎症反应明显减轻。Singh等[16]发现PI3K抑制剂处理过的AP模型炎症反应减轻,且主要是PI3KⅢ介导炎症反应的加重。由此可见,自噬与AP的发生存在相互关联的因子。
Beclin-1是酵母自噬基因Atg6/Vps30在哺乳动物中被确认的第一个同源类似物,位于人染色体17q21位点,主要通过参与组成PI3KⅢ复合体,募集含FYVE或PX结构域的蛋白质,形成蛋白复合体,是自噬启动的关键蛋白之一,参与早期自噬体膜的形成,通过与Bcl-2结合来调控自噬和凋亡的发生[17-18]。Zhang等[19]采用不同剂量雨蛙素腹腔注射至雄性小鼠内,通过免疫组化和蛋质白印迹法发现,胰腺腺泡细胞Beclin-1蛋白表达明显下降。本研究对大鼠胰胆管逆行注射牛磺胆酸钠成功制备ANP模型后,末端回肠组织Beclin-1蛋白表达较SO组显著降低,提示SAP中可能存在Beclin-1的消耗或其他未知因素,尚需进一步研究。
Wan等[20]的研究结果显示,雨蛙素+脂多糖诱导的ANP小鼠中肠道自噬过度激活,肠道组织存在病理损伤,且反映肠道黏膜屏障功能的蛋白包括occludin、ZO-1和claudin-4等的表达显著降低;而加入自噬抑制剂3-MA后,肠道病理损伤恢复,肠道功能相关蛋白表达逐渐恢复。Huang等[21]对自噬与ANP大鼠肠道氧化应激的关系进行研究,结果显示,不存在肠道细菌移位的ANP组与存在肠道细菌移位的ANP组均存在自噬激活,且前者的表达高于后者,ZO-1、occludin、claudin-1表达亦明显升高。说明自噬可有效保护肠黏膜屏障免受氧自由基的伤害。本研究显示,随着造模时间延长,末端回肠组织中Beclin-1蛋白表达明显升高,与病理学表现、血淀粉酶、血清内毒素、I-FABP的变化一致,提示随着AP病程延长,肠道可能存在异常自噬,且异常自噬逐渐增强,导致肠道黏膜屏障功能受损。但加入自噬抑制剂3-MA后,末端回肠组织中Beclin-1表达较ANP组明显降低,肠道病理损伤减轻,肠道通透性改善,说明抑制自噬能有效保护SAP患者肠道黏膜屏障功能,促进病情恢复。
目前认为正常自噬对SAP患者有一定保护作用,但在SAP时,自噬通量受损,自噬过度激活,异常自噬会加重SAP炎症反应,加重病情。但对异常自噬导致SAP,还是SAP导致异常自噬的发生这一问题,目前尚无相关定论,从SAP异常自噬的上下游机制进行研究,有助于发现SAP治疗的新靶点。本研究发现加入自噬抑制剂3-MA后能减轻SAP肠道损伤,有望成为治疗SAP的潜在靶点之一。但自噬的启动、自噬体的形成涉及多个关节,目前尚未明确从哪个环节进行干预才能有效控制SAP肠道屏障功能的损伤。且长期抑制自噬可能对SAP恢复阶段产生不良影响,故不能单纯刺激或抑制自噬发生,使异常自噬正常化并发挥有利作用,才是SAP治疗的关键。

