外源性类活性氧诱导直肠癌细胞凋亡的机制
文雅蕾 赵 芳 徐宇翔 丁 良
河北大学,河北省保定市 071000
结肠直肠癌(Colorectal cancer,CRC)是消化道最常见的肿瘤,其发病率和死亡率已经位居全球第三[1],约占所有新发肿瘤的20%[2]。目前可治疗CRC的方式主要是手术及全身化疗。化疗药物虽能显著抑制CRC的发展,但容易使肿瘤对药物产生耐药性,使预后效果变差[3]。鉴于结肠直肠癌在我国及全球范围内的高发病率和高致死率,寻找新的作用靶点对非小细胞肺癌的研究有治疗意义[4]。现在认为活性氧(ROS)可以作为调节癌症中各种生理过程的信号分子[5-6]。当氧化—抗氧化系统失衡时,会激活氧化应激,引起DNA、脂质、蛋白质和其他生物大分子的损伤,ROS的增加在癌症的病因和发病机制中起重要作用[7]。因此,改变细胞内ROS水平有助于控制癌症的发生和发展。HClO是ROS的家族成员之一,是一种强氧化剂,在许多细胞的生物过程中起着重要的作用。最近有证据表明,内源性HClO可以作为激活半胱天冬酶和介导细胞凋亡的信号。目前尚无明确报道显示HClO对癌细胞的杀伤作用[8]。因此,我们以内皮细胞Ealy926和直肠癌细胞HCT-8的作用和机制,初步探讨HClO对其生物学影响及可能的机制。
1 材料与方法
1.1 细胞与试剂 内皮细胞Ealy926 购自中山大学细胞库,直肠癌细胞HCT-8购自中国典型培养物保藏中心(CCTCC®,武汉,中国);含有1%青霉素/链霉素混合物的DMEM培养液、0.25%胰酶均购自加拿大WISENT 公司;胎牛血清购自美国Gibco公司;MTT购自美国Sigma公司;Giemsa染液购自北京索莱宝科技有限公司;AnnexinV-FITC试剂盒购于生工生物工程(上海)股份有限公司。
1.2 细胞培养 HCT-8细胞购自中国典型培养物保藏中心(CCTCC®,武汉,中国)。在补充有10%胎牛血清(FBS)和1%青霉素/链霉素混合物溶液的高葡萄糖Dulbecco’s改良Eagle培养基(H-DMEM)中培养。
1.3 MTT法检测HClO对Ealy926细胞和HCT-8细胞增殖的抑制作用 将对数期生长的Ealy926细胞和HCT-8细胞按细胞密度5×103个/孔接种于96孔细胞培养板,终体积100μl,常规培养于37℃、5% CO2饱和湿度培养箱中。待24h细胞贴壁后,弃原培养液,分别将HClO溶液按50~800μmol/L的浓度梯度加入各组细胞中,终体积为100μl,空白对照组加入100μl不含血清的DMEM高糖培养基,各药物浓度均设4副孔。干预10min后换成100μl含10%血清的DMEM高糖培养基。处理后的细胞培养24h后按MTT试剂盒说明书处理各组细胞,在酶联免疫检测仪490nm处测量各孔的吸光值(OD)。实验重复3次,计算细胞增殖率。细胞增殖率(%)=实验组OD/对照组OD×100%。
1.4 Giemsa染色法观察细胞形态学改变及凋亡、坏死情况 将对数期生长的Ealy926细胞和HCT-8细胞按细胞密度5×105个/孔接种于6孔细胞培养板,终体积2 000μl,常规培养于37℃、5% CO2饱和湿度培养箱中。待24h细胞贴壁后,弃原培养液。分别将HClO溶液按50~800μmol/L的浓度梯度加入各组细胞中,终体积为2 000μl,空白对照组加入2ml不含血清的DMEM高糖培养基,各药物浓度均设3副孔。干预10min后换成2ml含10%血清的DMEM高糖培养基。处理后的细胞培养24h后,弃去原培养液,然后用PBS洗两遍;按Giemsa染色试剂盒说明书处理细胞。于400×普通光学显微镜下观察细胞形态学的变化并记录拍照。
1.5 流式细胞术检测凋亡细胞 将对数期生长的Ealy926细胞和HCT-8细胞按细胞密度5×105个/孔接种于6孔细胞培养板,终体积2 000μl,常规培养于37℃、5% CO2饱和湿度培养箱中。待24h细胞贴壁后,弃原培养液。分别将HClO溶液按50~800μmol/L的浓度梯度加入各组细胞中,终体积为2 000μl,空白对照组加入2 000μl不含血清的DMEM高糖培养基,各药物浓度均设3副孔。干预10min后换成2 000μl含10%血清的DMEM高糖培养基。处理的细胞培养24h后,按照AnnexinV-FITC试剂盒说明书处理各组细胞。使用 BD FACS Calibur 流式细胞仪进行检测,重复试验3次。激发波长Ex=488nm;发射波长 Em=530nm。Annexin V-FITC 的绿色荧光通过 FITC(FLI)检测;PI 红色荧光通过 PI 通道(FL3)检测。
1.6 统计学方法 采用SPSS22.0统计软件对数据进行分析处理,组间差异比较采用单因素方差分析,组内两两比较采用LSD-t检验,两实验组间采用独立样本t检验,P均<0.05 的检验标准表示差异有统计学意义。
2 结果
2.1 HClO以浓度依赖的方式直肠癌HCT-8细胞增殖活力 MTT结果显示(图1),采用不同浓度的HClO分别作用于各组细胞后, HClO浓度≤50μmol/L时对两种细胞增殖的影响较小,HClO浓度≥100μmol/L时,两种细胞的增殖率均明显降低(**P均<0.01)呈剂量—效应关系。且直肠癌HCT-8细胞的增殖率明显低于内皮细胞Ealy926的增殖率(#P均<0.05)。
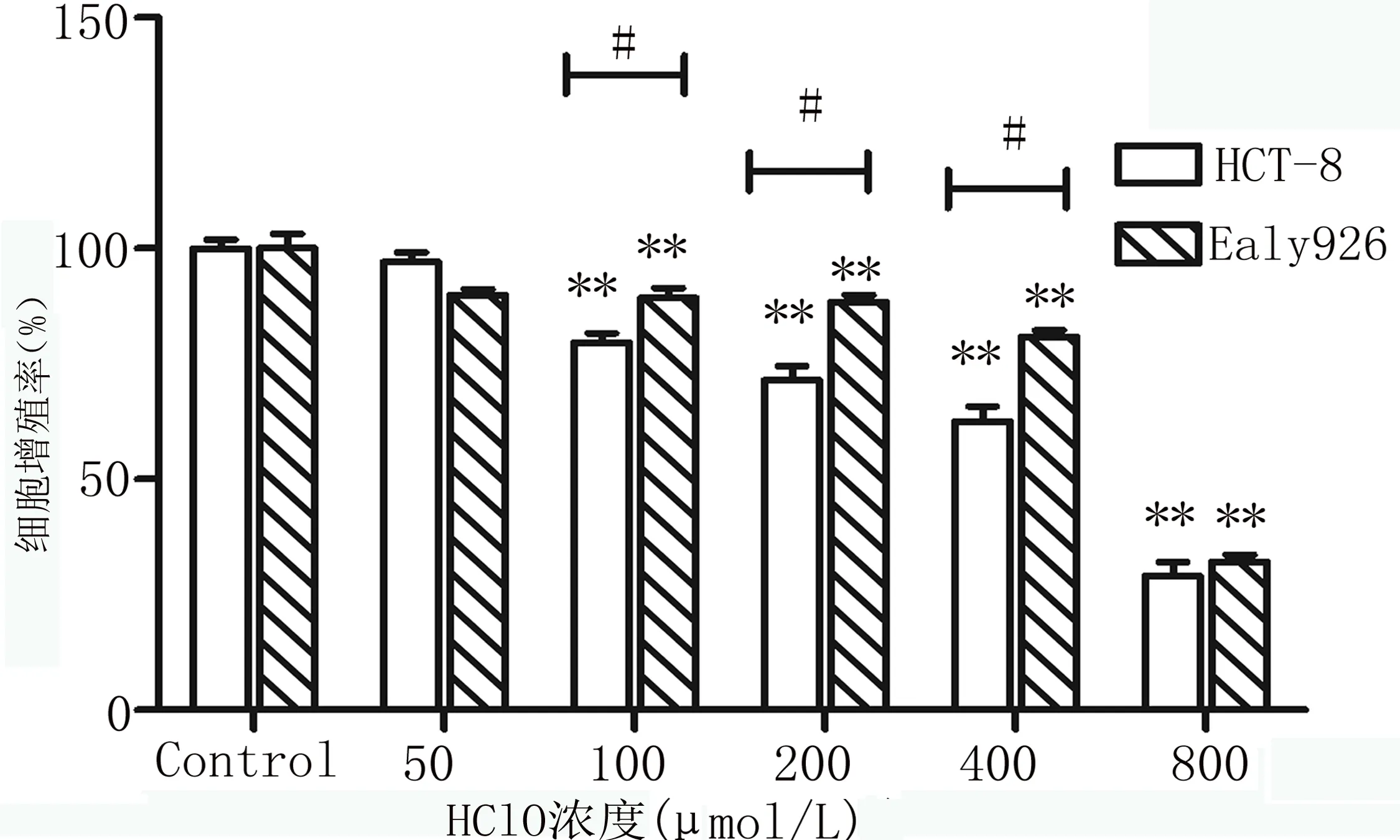
图1 不同浓度HClO对细胞增殖率的影响注:**与Control组相比,P均<0.01;#HCT-8与Ealy926相比,P均<0.05。
2.2 吉姆萨染色观察HClO处理两种细胞前后细胞形态学的变化及凋亡坏死情况 当HClO作用24h后,对照组细胞聚集生长,完全贴壁,生长良好,且具有清晰轮廓;50、200μmol/L HClO、组聚集连接减少,无明显细胞形态的改变;400、800μmol/L HClO处理的实验组细胞形态完全改变,出现细胞膜完整性的丧失、细胞核碎裂、细胞器变形等坏死现象。结果显示,在HClO的作用下,内皮细胞Ealy926和直肠癌HCT-8细胞发生形态学改变,且细胞量减少,呈浓度—效应关系。见图2、图3。
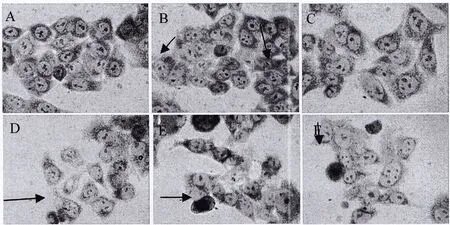
图2 不同浓度HClO作用下HCT-8细胞吉姆萨染色光学显微镜照片(400×,标尺20μm)注:A:Control组 B:HClO 50μmol/L组 C:HClO 100μmol/L组 D:HClO 200μmol/L组 E:HClO 400μmol/L组 F:HClO 800μmol/L组。
2.3 流式细胞术检测细胞凋亡的结果 随着HClO浓度升高,直肠癌HCT-8细胞和内皮细胞Ealy926的凋亡率也随之升高,当HClO浓度>200μmol/L时,两种细胞的实验组与空白组相比,差异有统计学意义(P<0.05)。且当HClO浓度为400μmol/L时,直肠癌HCT-8的死亡率明显高于内皮细胞Ealy926(P<0.05)。凋亡率(%)=早期凋亡+晚期凋亡。见图4。
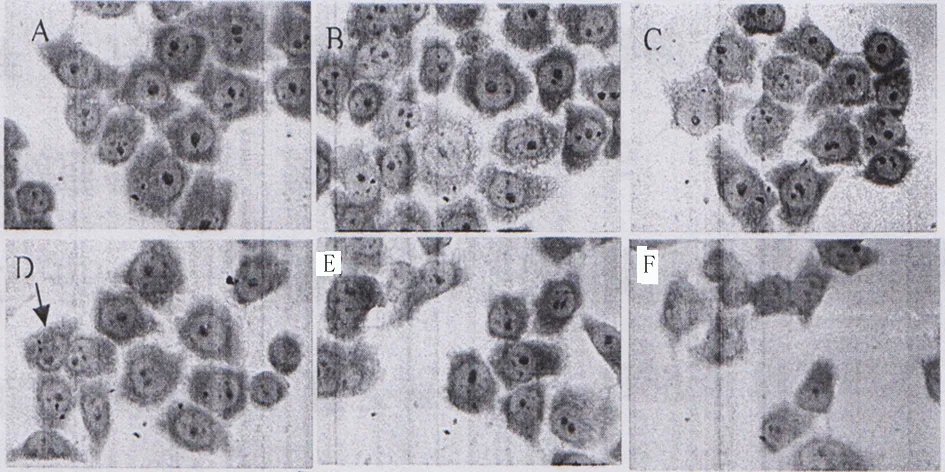
图3 不同浓度HClO作用下Ealy926细胞吉姆萨染色光学显微镜照片(400×,标尺20μm)注:A:Control组 B:HClO 50μmol/L组 C:HClO 100μmol/L组 D:HClO 200μmol/L组 E:HClO 400μmol/L组 F:HClO 800μmol/L组。
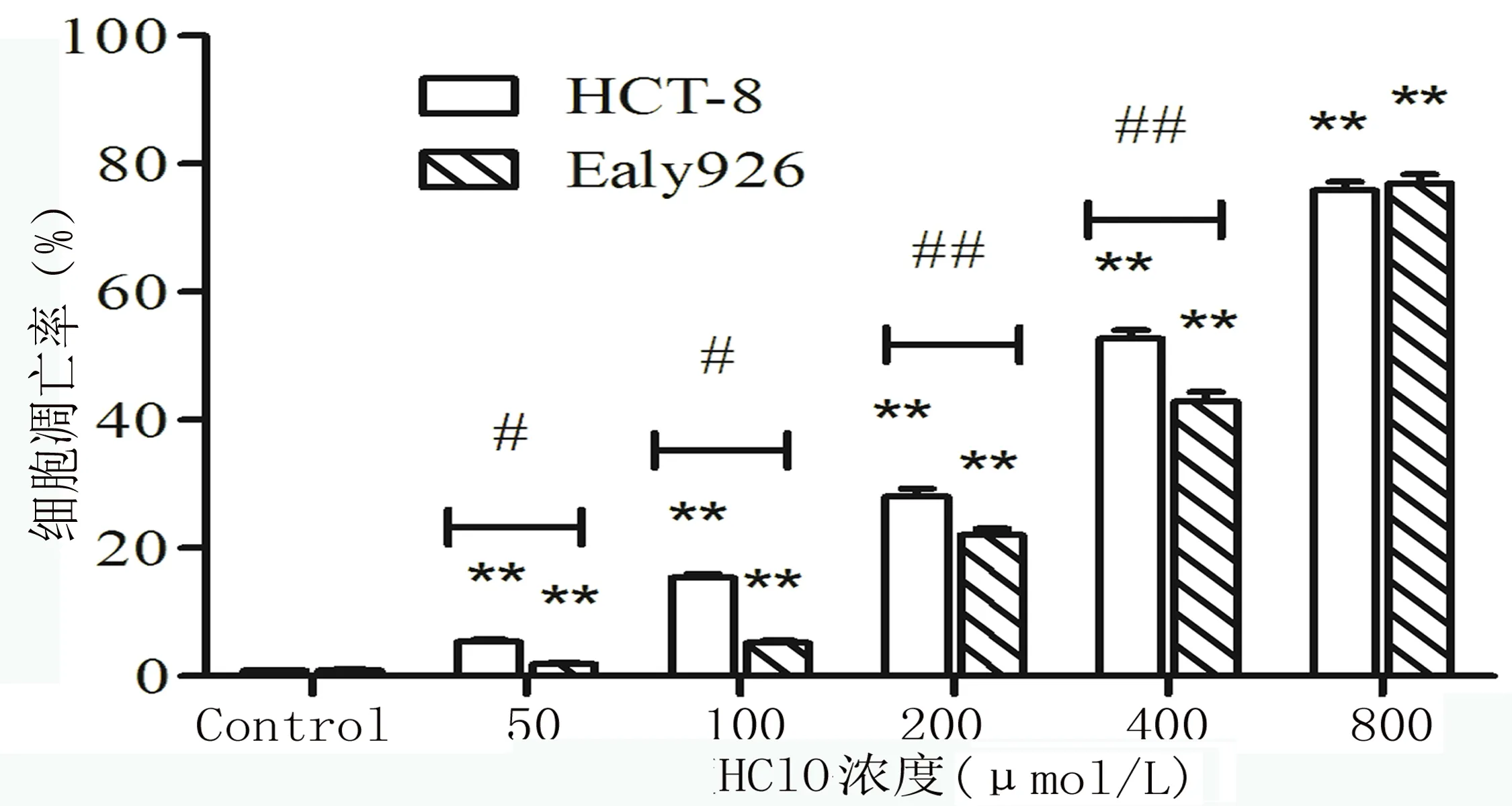
图4 不同浓度HCIO作用下HCT-8和Ealy926细胞凋亡统计结果注:**与Control组相比,P均<0.01;#HCT-8与Ealy926相比,P均<0.05;##HCT-8与Ealy926相比,P均<0.01。
3 讨论
CRC作为常见的疾病之一,对人体影响较大,具有全身转移性,严重者造成患者死亡。而近年来的研究表明,高浓度的ROS可以阻滞细胞周期、诱导肿瘤细胞的凋亡和坏死。因此,合理利用ROS 浓度对肿瘤细胞的影响来进行肿瘤治疗的方式成为近年来的热点,通过调节机体内ROS的浓度,来诱导肿瘤细胞的凋亡[6]。体外评价药物抑瘤作用可通过能否抑制细胞增殖率来体现。本实验中,50μmol/L的HClO便可抑制直肠癌细胞HCT-8的增殖。本研究通过添加外源性类氧化剂HClO,使正常细胞与肿瘤细胞内的ROS增加,通过氧化应激诱导了内皮细胞Ealy926和直肠癌细胞HCT-8的凋亡。且直肠癌细胞对氧化剂HClO的敏感性强于内皮细胞Ealy926,一定浓度的氧化剂氧化损伤直肠癌细胞HCT-8的凋亡率明显高于内皮细胞Ealy926。在800μmol/L HClO 干预的实验组中,细胞出现明显的细胞质泡沫化,可能是因为ROS过高导致内质网应激,破坏了细胞膜通透性,进而促进细胞死亡。
氧化策略在肿瘤中的应用尚存在争议,但目前已经证实多种化疗药物都通过ROS途径杀死肿瘤细胞。于正常的细胞,高浓度的ROS损伤脂质、蛋白质和DNA,这些氧化应激的积累则可能诱导癌变,而低浓度平衡状态下的ROS对维持细胞正常生理功能具有重要作用[8]。因此还应注意ROS的升高能否达到对肿瘤的毒性阈值。本研究初步探讨了HClO对内皮细胞Ealy926和直肠癌细胞HCT-8的影响,为深入研究外源性氧化剂诱导A549细胞凋亡以及出现细胞质空泡化的机制提供了新思路。

