参芍口服液对实验性脑出血大鼠脑内CD14/TLR4介导的继发性炎症损伤的干预效果研究
刘宏伟, 唐兴国, 李斌斌, 孟令丽, 秦博文
(1.承德护理职业学院, 河北 承德 067000 2.华北理工大学基础医学院, 河北 唐山 063000)
脑出血(intracerebral hemorrhage,ICH)是一种急性脑血管病,具有高发病率、高死亡率的特点,严重影响患者的健康和生存质量[1]。脑出血主要损伤是由脑水肿、炎性反应和细胞凋亡等因素参与的继发性脑组织损伤,炎性反应在损伤中起关键作用,成为研究热点[2]。白细胞分化抗原14(CD14)是脂多糖(LPS)受体,脑损伤后患者脑内小胶质细胞CD14表达显著增加。但CD14本身缺乏与细胞内信号交流的跨膜区及胞内结构,因此需由其他跨膜蛋白进行信号传递。TLR4是最早发现的人类Toll样受体,属于跨膜信号转导受体,在机体炎症及免疫反应中起重要作用。有研究表明,在大鼠脑缺血再灌注模型中,TLR4信号途径被激活,诱导大量炎性反应发生,加重神经元损伤,抑制TLR4能减少脑缺血再灌注损伤[3]。中医药对中风的治疗积累了丰富的经验,参芍口服液可降低动脉粥样硬化大鼠IL-8的表达,通过抑制炎症因子的表达缓解组织炎症。脑组织损伤中是否发挥抗炎作用及其作用机理尚未见报道,为此,本实验采用自体血法建立脑出血模型,选用CD14、TLR4、IL-8作为研究指标,探索参芍口服液对脑出血后继发性脑损伤的作用及其机制。
1 资料与方法
1.1一般资料:参芍口服液(10mL/支),由唐山市工人医院制剂室制备,批号:Z20050957;TLR4一抗、CD14一抗(武汉博士德生物公司);IL-8一抗(美国Santa Cruz Bio公司);SP系列免疫组化试剂盒(福建迈新试剂公司);β-actin 单克隆抗体(美国Sigma公司)。清洁级SD雄性大鼠48只,8~12周龄,体重250±20g,北京维通利华实验动物技术有限公司购买,分笼饲养于华北理工大学动物中心,室温23~26℃,湿度40%~60%,饲养环境符合实验动物环境设施要求,在笼中可自由摄食饮水。
1.2方 法
1.2.1动物分组与脑出血模型制备:实验大鼠随机分为3组:假手术组(Sham),脑出血模型组(ICH),参芍口服液干预组(SS)。各组大鼠按不同时间点又分为6h,12h,24h,72h和7d五个小组。10%水合氯醛(0.03mL/kg)腹腔麻醉,微量注射器抽取新鲜股动脉血注射到脑基底节区;Sham组注射等量生理盐水,余步骤与ICH组相同。SS组于术后2h大鼠完全苏醒后参芍口服液8mL/d灌胃,分两次给药,各组到时间点处死动物。
1.2.2检测指标
1.2.2.1血肿周围脑组织含水量测定:10%水合氯醛腹腔麻醉后,迅速断头取脑组织,收集血肿周围脑组织约120mg,电子天平称湿重,随后100℃恒温箱烘烤约48h,称干重。
1.2.2.2H-E染色观察脑组织神经元病理变化和计数未受损神经元数量变化:选取脑组织血肿周围各5张切片,每隔3张取1张,400倍镜下取不同区域4个视野计数未受损神经元阳性细胞数,取平均值。
1.2.2.3SP法免疫组织化学染色及CD14、TLR4和IL-8阳性细胞计数:SP法免疫组织化学染色,CD14、TLR4和IL-8阳性细胞结果评定:阳性细胞中出现棕色颗粒,细胞结构完整、定位明确、染色清晰。400倍镜下每张切片随机选6个具有代表性非相互重叠视野,分别计数CD14、TLR4和IL-8免疫组化阳性细胞数。
1.2.2.4蛋白免疫印迹法测定CD14、TLR4和IL-8:收集基底节区周围血肿新鲜脑组织,制备脑组织匀浆,提取脑组织总蛋白,根据BSA标准品和待测样品数量计算所需工作液,酶标仪测定A562nm,绘制标准曲线,计算蛋白浓度。蛋白免疫印迹平均光密度OD值测定及结果判定:所测结果进行半定量分析,将曝光的蛋白条带用Image Lab凝胶成像分析系统进行条带分析,得出光密度值,以目标蛋白OD值/内参OD值的比值来表示。

2 结 果
2.1脑组织含水量变化:与Sham组比较,ICH组各时间点脑组织含水量均明显升高(P<0.05)。6h小组后出现脑水肿,12h小组明显,24h~72h达到高峰,随后脑组织含水量出现下降趋势,ICH 7d基本恢复正常。SS各小组相应时间点脑组织含水量较ICH各组明显降低(P<0.05),见表1。

表1 各组大鼠脑组织含水量变化比较
注:a:与Sham组比,P<0.05;b:与ICH组比,P<0.05
2.2脑组织切片HE和尼氏染色结果观察:脑组织切片HE染色结果:Sham组脑组织神经细胞结构正常,胞核大、圆,胞质嗜酸性;ICH 6h组血肿周围脑组织水肿,神经元肿胀;术后24~72h,血肿周围组织高度水肿、坏死,细胞核皱缩浓染,胞浆淡染,部分神经元水肿变性、坏死,并伴有出现大量红细胞,炎细胞浸润,神经细胞疏松,呈网状结构,细胞外间隙增大;脑出血后7d此现象基本消失。SS组脑组织神经细胞肿胀缓解,细胞形态基本正常,病理改变减轻。(图1)Sham组脑组织神经细胞结构完整、形态正常,尼氏体较多。ICH 6h组尼氏体减少,脑组织轻度水肿;ICH 12h组神经元尼氏体明显减少,细胞间隙增宽,脑组织水肿明显;ICH 72h组仅见少量正常的神经元,神经元胞体皱缩,核碎裂,尼氏体消失,脑组织高度水肿、坏死。SS组核碎裂现象改善,受损神经元数量明显减少,尼氏体减少程度减轻,细胞间隙变窄。(图2)与Sham组相比,ICH后6h未受损神经元减少,12h~72h明显减少,72h达高峰,神经元损伤最严重;与模型组相比,SS各小组未受损神经元数均明显增多(P<0.05),见表2。

图1 不同组大鼠脑出血血肿周围脑组织神经细胞变化 HE染色(×400)
2.3IL-8、CD14和TLR4蛋白免疫组化染色结果:Sham组,IL-8阳性细胞在脑组织中少量表达。ICH后6h局部少量表达,12h后随时间延续,IL-8阳性细胞数逐渐增多,着色逐渐变深,免疫反应性增强(P<0.05)。ICH后72h时,脑组织血肿周围IL-8阳性细胞大量分布,细胞皱缩浓染,IL-8蛋白表达达到高峰,并见脑组织细胞间隙增宽。参芍口服液干预后IL-8阳性细胞表达明显减少(P<0.05)。Sham组TLR4未见蛋白表达或仅有少量表达;ICH后血肿周围TLR4阳性细胞表达明显增加,6h组有所增加,12h增加明显,72h达高峰,以后阳性表达呈下降趋势,7d后表达相对最弱,但仍高于Sham组(P<0.05);与ICH组相比,SS组TLR4阳性细胞数量明显减少(P<0.05)。Sham组脑组织细胞偶有CD14表达;ICH组中CD14表达明显增加(P<0.05),可观察到大量棕黄色深染阳性细胞;SS组较ICH组阳性细胞数显著减少(P<0.05),见表3、图3。

表2 大鼠血肿周围未受损神经元计数
注:a:与Sham 组比,P<0.05;b:与ICH组比,P<0.05

表3 各组大鼠血肿周围IL-8 TLR4和CD14阳性细胞数量的变化
注:a:与Sham组比,P<0.05;b:与ICH组比,P<0.05
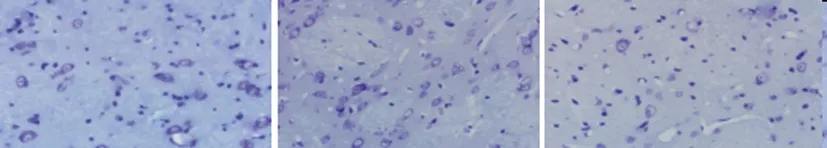
图2 不同组大鼠脑出血血肿周围尼氏染色结果观察(×400)
2.3IL-8、CD14和TLR4蛋白免疫组化染色结果:Sham组,IL-8阳性细胞在脑组织中少量表达。ICH后6h局部少量表达,12h后随时间延续,IL-8阳性细胞数逐渐增多,着色逐渐变深,免疫反应性增强(P<0.05)。ICH后72h时,脑组织血肿周围IL-8阳性细胞大量分布,细胞皱缩浓染,IL-8蛋白表达达到高峰,并见脑组织细胞间隙增宽。参芍口服液干预后IL-8阳性细胞表达明显减少(P<0.05)。Sham组TLR4未见蛋白表达或仅有少量表达;ICH后血肿周围TLR4阳性细胞表达明显增加,6h组有所增加,12h增加明显,72h达高峰,以后阳性表达呈下降趋势,7d后表达相对最弱,但仍高于Sham组(P<0.05);与ICH组相比,SS组TLR4阳性细胞数量明显减少(P<0.05)。Sham组脑组织细胞偶有CD14表达;ICH组中CD14表达明显增加(P<0.05),可观察到大量棕黄色深染阳性细胞;SS组较ICH组阳性细胞数显著减少(P<0.05),见表3、图3。
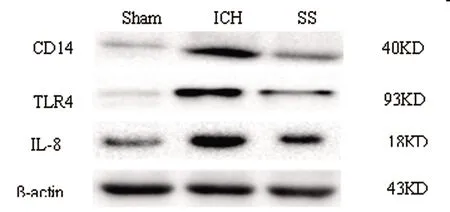
图3 血肿周围CD14、TLR4和IL-8免疫组化染色(×400)
2.4干预后各组IL-8、TLR4和CD14蛋白表达量:ICH组IL-8表达量较Sham组明显增加,差异有统计学意义(P<0.05)。与ICH组相比SS组大鼠脑组织血肿周围IL-8蛋白表达量显著减少(P<0.05)。Sham组TLR4蛋白表达微弱,ICH组TLR4表达量显著增加(P<0.05),与ICH组相比,SS组TLR4表达量减少明显(P<0.05)。正常大鼠脑组织内CD14蛋白少量表达,条带着色浅;与Sham组相比,ICH组CD14表达显著升高,蛋白条带显示深黑色;SS组较ICH组CD14蛋白条带着色变浅,表达量降低,差异具有统计学意义(P<0.05),见图4、表4。
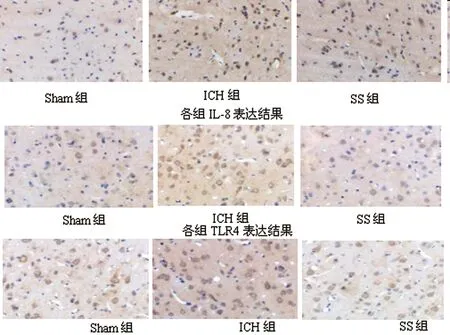
图4 各组大鼠脑组织IL-8、TLR4和CD14蛋白表达量

表4 各组大鼠脑组织IL-8 TLR4和CD14蛋白表达量
注:a:与Sham组比,P<0.05;b:与ICH组比,P<0.05
3 讨 论
IL-8是一种多源性细胞因子,对炎性细胞均具有趋化作用,在炎症过程中发挥重要作用。杨永青等[4]报道IL-8能召集白细胞聚集、促进白细胞浸润,诱导产生大量自由基及释放大量细胞因子,损害脑毛细血管内皮细胞,导致脑水肿的发生。蒋令修等[5]报道在脑缺血再灌注模型中,静脉注射IL-8单克隆抗体,可明显抑制白细胞的浸润,减轻炎症反应,最终减少继发性脑损伤。以上证据表明,IL-8可能参与介导了脑出血后继发性炎症反应,并在脑神经元损伤过程中起着重要作用。
CD14作为一种脂多糖(LPS)的高亲和受体,能够在脂多糖结合蛋白(LBP)的协同作用下结合LPS,引起细胞活化,吞噬LPS及诱导炎症因子(IL-8)的释放过程,启动炎症反应从而导致机体损伤[6]。脑组织损伤后引发白细胞浸润,诱发一系列炎症反应,这些白细胞表面表达的CD14在脑损伤后的局部炎症免疫反应中起着关键性的作用。张琦等[7]通过将尾动脉血注入大鼠右侧基底节区制作脑出血模型,发现血肿周围脑组织CD14mRNA表达增强,说明脑出血后存在某些因素诱发CD14高表达,提示CD14参与脑出血后的病理损伤过程。同时,CD14缺乏跨膜区和胞内结构,不能单独将胞外信号转导至胞内,需要其它蛋白协助完成[8]。CD14/TLR4信号通路能够介导炎性因子表达,参与多种炎症的发生发展过程。
TLR4能够特异识别非生物源性刺激,启动和放大炎性级联反应[9]。陶蕾等[10]也证明了TLR4在外伤性脑损伤模型中表达增加,并诱导炎症因子IL-8大量表达。这些证据说明,在脑出血模型中,CD14/TLR4可能参与调控炎症因子IL-8的表达。本实验观察了脑出血后IL-8和CD14、TLR4的表达关系,免疫组化结果显示,脑出血后6h血肿周围开始出现TLR4阳性细胞,与Sham组相比较阳性细胞数明显增多(P<0.05),随时间延续,脑出血72h后阳性细胞数量最多(P<0.05),之后有所下降。免疫蛋白印迹结果显示,脑出血后6h血肿周围CD14蛋白表达开始增加,12h增加更为明显,随时间推移,CD14表达逐渐增加,72h增加最为明显,此后逐渐下降。IL-8、TLR4在免疫组化和免印迹检测结果中表达变化与CD14趋势一致。两两相关性分析,结果表明TLR4与CD14表达水平呈正相关(P<0.05);TLR4与IL-8表达水平呈正相关(P<0.05);IL-8表达水平与脑含水量呈正相关(P<0.05)。提示,大鼠实验性脑出血后,CD14/TLR4信号通路可能通过诱导IL-8表达加重血肿周围脑组织的继发性损伤。
有研究认为,治疗出血性中风患者应以活血化瘀、通经活络为基本原则。而参芍口服液的主要功效为活血化瘀,益气通络。本研究结果表明,CD14/TLR4能够诱导脑出血模型IL-8炎性因子表达增加,导致脑组织的继发性损伤,参芍口服液干预后,脑组织的含水量下降;脑组织神经细胞肿胀明显减轻,胞间间隙变窄,未受损神经元数增加。免疫组化、免疫印迹结果显示IL-8阳性细胞数量明显减少。IL-8表达量显著降低,提示参芍口服液可通过CD14/TLR4信号通路减弱炎症因子IL-8介导的炎症损伤。

